外源性HGF对增龄和动脉硬化大鼠HGF和TGF-β1平衡的影响
2018-05-25赵晟昊
赵晟昊 李 彤 王 凡
新乡医学院第一附属医院,河南 卫辉 453100
目前脑卒中已是中老年人的常见病与多发疾病,也是我国居民的第一大死亡原因以及首位致残因素[1-2]。脑动脉粥样硬化(cerebral atherosclerosis,CAS)是缺血性脑血管病的首要诱发因素,尤其弥漫性的小血管病变类型,目前无有效的治疗办法[3-4]。为多发性、弥漫性CAS所致的脑缺血寻找一个有效的治疗方法,以改变目前治疗方法少且效果差的现状,目前想到的是改变血运情况,但如何重建有效的血供是值得广大医学工作者深思的问题[5-6],从而为解决老龄化社会痴呆和脑梗死预防的难题打下基础。自从“基因治疗使心脏生成新血管”被列为美国心脏学会1998年度公布的十大研究项目之首,促血管生长细胞因子促血管新生的研究便成为医学领域关注的热点[7-8]。从2005年至今,《Nature》《Science》《Cell》等有关脑血管形成的分子机制研究始终引领本学科的前沿领域。诸多相关基因的功能与信号转导机制在胚胎脑血管发生中的发现,为成年脑血管新生机制的研究奠定了理论基础[9]。Ad-HGF目前已经进入临床Ⅲ期试验,并在心肌缺血和骨骼肌缺血治疗并获良好评价,目前,与HGF关系密切并具有明确相互作用的是TGF-β1[10-11]。
本实验通过向老龄CAS大鼠蛛网膜下腔中注入外源性Ad-HGF,观察其促脑血管新生的作用,采用ELISA法分析CAS大鼠脑脊液中HGF和TGF-β1含量,采用免疫组化和免疫印迹法分析脑组织中HGF和TGF-β1含量,探讨HGF、TGF-β1相互间作用关系与大鼠老龄和CAS的相关性。
1 材料和方法
1.1主要材料Ad-HGF(携带人HGF基因的重组腺病毒,滴度为5×109pfu/100 μL,北京奥洛英),Westernblot试剂盒(碧云天),鼠抗HGF单克隆抗体,鼠抗TGF-β1单克隆抗体,Western blot试剂盒,人HGF及鼠TGF-β1的ELISA检测试剂盒(南京森贝伽),胆固醇、胆酸钠、丙基硫氧嘧啶、猪油、蛋黄粉、蔗糖(北京索莱宝),手术显微镜,大鼠脑立体定位仪,微型手持式颅钻,25 μL微量注射器,ML125鼠尾无创血压测定仪,Powerlab生理信号采集与处理系统(Powerlab/8SP Australia),奥林帕斯AU2700全自动生化分析仪。
1.2动物模型建立SPF级18月龄雄性SD大鼠30只,体质量300~400 g,购买于北京维通利华实验动物技术有限公司[动物生产许可证:SCXK(京)2012-0001,实验动物设施使用许可证:SYXK(豫)2014-0005],随机分为对照组(n=15)和脑动脉硬化模型组(CAS,n=15)。采用高血压合并高脂饲料喂养制备脑动脉硬化动物模型,造模方法按有关文献[12]处理,造模处理后凡血压较处理前高20 mmHg(1 mmHg=0.133 kPa)以上且高于115 mmHg认为形成高血压模型[13]。大鼠喂养16周后,模型组TC、TG、LDL-C水平均明显高于正常组,差异有统计学意义。模型组随机取大鼠5只,常规腹腔麻醉后,4%多聚甲醛磷酸盐缓冲液经心脏灌注后,断头取颈内动脉终段(约0.5 cm),制成石蜡切片并进行HE染色,光镜下观察颈内动脉血管病变。颈内血管形态学观察到血管内皮表面粗糙凹凸不平,细胞排列不规整,大量泡沫细胞堆积,血管内膜增厚显著,形成典型的AS斑快,提示CAS造模成功。
1.3药物处理建模成功后,另用40只造模大鼠随机分为模型组、模型Ad-HGF组各20只;模型Ad-HGF组20只大鼠5×109pfu/mL,0.05 mL的Ad-HGF经小脑延髓池注射入蛛网膜下腔中。模型组大鼠20只,经小脑延髓池注入蛛网膜下腔注射0.05 mL生理盐水。1月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池注入蛛网膜下腔中,注射5×109pfu/mL,0.05 mL Ad-HGF。另取40只1月龄大鼠,随机抽取20只经小脑延髓池注入蛛网膜下腔5×109pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池至蛛网膜下腔注射0.05 mL生理盐水。6月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池注入蛛网膜下腔注射5×109pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池注入蛛网膜下腔0.05 mL生理盐水。12月龄雄性SD大鼠40只,随机抽取20只经小脑延髓池至蛛网膜下腔注射5×109pfu/mL,0.05 mL Ad-HGF,另外20只经小脑延髓池注入蛛网膜下腔0.05 mL生理盐水。
1.4 实验方法
1.4.1 ELISA法测定脑脊液中HGF和TGF-β1浓度
1.4.1.1 脑脊液的采集:将大鼠麻醉后,再将头部固定于立体定位仪上,头颈部剃毛、消毒干净后,用手术刀在后颈部作一3 cm纵向切口,轻轻分离颈部背侧的肌肉。术中及时止血,在暴露出枕骨大孔后。将大鼠头部压低,垂直由枕骨大孔向内进针抽取脑脊液,注意勿插入过深。抽完后缝好里面肌肉及外面皮肤,用干净纱布包扎伤口,防止感染。采集脑脊液后,应注入等量的生理盐水,以维持原有颅内的压力。最后将脑脊液移入1.5 mL的EP管中,放入液氮或干冰中迅速冷冻后移入-80 ℃中保存备用。
1.4.1.2 ELISA检测实验步骤:依试剂盒所提供的方法,严格进行ELISA检测。配置2 000、1 000、500、250、125、62.5、31.25 pg/mL的标准品各0.1 mL,每孔加入100 μL标准品或待测脑脊液。另设零孔2个,酶标板加上盖,37 ℃反应90 min。反应后用力甩尽酶标板内液体,再对着吸水纸拍几下,不洗。将准备好的生物素一抗工作液以每孔0.1 mL的标准依次加入(TMB空白显色孔除外)孔内,温箱内37 ℃下反应60 min。然后用PBS液洗涤酶标板3次,每次浸泡1 min以上。再用试剂盒中的ABC工作液按每孔0.1 mL的标准依次加入(TMB空白显色孔除外)各孔中,温箱内37 ℃下反应30 min,然后重复前面洗板工作。最后每孔依次加入等量的TMB显色液,温箱内37 ℃下避光反应30 min。最后每孔依次加入TMB终止液1滴并混匀,用酶标仪在450 nm处测吸光值OD。结果计算与判断:以零孔为对照,测得的数据以吸光值OD作为纵坐标,以浓度作为横坐标,在电脑中绘制出标准曲线,计算样品含量。
1.4.2 Western印迹检测:取-80 ℃冰箱内保存的各组大鼠的脑皮质,每组80 mg,用液氮研磨后分别加入蛋白裂解液后离心、取上清液,BCA法测定各组蛋白质浓度,每个样品上样80 μg,按总的蛋白质量计算各样品所需体积,需配平体积,再加入3倍Buffer煮沸5 min。再用10%的SDS-PAGE凝胶电泳分离蛋白,转移至PVDF膜上,使用5%脱脂奶粉室温封闭1 h,然后加入HGF或TGF-β1一抗,一抗浓度均为1:1 000,在4 ℃下孵育过夜。第2天室温下复温60 min,用TBST洗膜3次,每次10 min以后,加入对应的辣根过氧化物酶标记的二抗(浓度均为1:2 000),室温摇床上孵育2 h,再加入DAB显色液在凝胶成像系统中进行曝光和图像分析,用Image Q软件分析蛋白质条带,并计算出各个条带的面积与灰度值大小,计算二者乘积为积分灰度值,取3次重复测定值的均数。
1.4.3 观察指标:采用ELISA法测定各组大鼠脑脊液中HGF、TGF-β1的动态变化。采用Western blotting测定各组大鼠脑组织中HGF、TGF-β1蛋白杂交条带,与内参进行相对密度扫描求OD值。
1.5统计学处理应用SPSS 21.0统计软件进行统计学分析,对于符合方差分析应用条件的,组间均数比较采用单因素方差分析,组间多重比较采用最小显著性差异(LSD)检验;不满足方差分析条件时,组间多重比较采用Dunnett’s T3检验。假设检验统一使用双侧检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1脑脊液中HGF、TGF-β1浓度未打入Ad-HGF组大鼠脑脊液中均未检测到HGF,打入Ad-HGF组可在脑脊液中可检测到HGF浓度。经Dunnett’s T3法组间多重比较,打入Ad-HGF组脑脊液HGF浓度值均高于未打入Ad-HGF组,差异均有统计学意义(P<0.05),脑脊液HGF浓度值随年龄增加而降低,脑脊液HGF浓度值未打入Ad-HGF组间比较差异无统计学意义,打入Ad-HGF组间比较差异无统计学意义(P<0.05)。见表1。
表1 不同时间点各组大鼠脑脊液HGF浓度比较
经Dunnett’s T3法组间多重比较,打入Ad-HGF的组别脑脊液TGF-β1浓度值均高于未打入Ad-HGF的组别,差异均有统计学意义(P<0.05);脑脊液TGF-β1浓度值随年龄增加而增加,各组内不同时间比较,经one way ANOVA分析,未打入Ad-HGF的组别脑脊液TGF-β1浓度值随时间变化差异无统计学意义,3个年龄Ad-HGF组脑脊液TGF-β1浓度值随时间变化差异有统计学意义,经LSD法组间多重比较,TGF-β1浓度第20天组低于第10天和第30天组(表2)。
表2 不同时间点各组大鼠脑脊液TGF-β1浓度比较
2.2 Western blotting法检测脑组织HGF、TGF-β1蛋白表达未打入Ad-HGF的组别大鼠脑组织中只有较少HGF表达,打入Ad-HGF的组别脑组织可见HGF表达增多,同一时间点打入Ad-HGF的组别均较未打入Ad-HGF的组别有明显增加。经Dunnett’s T3法组间多重比较,未打入Ad-HGF的模型组HGF OD值高于未打入Ad-HGF的增龄组,差异无统计学意义(P>0.05)。打入Ad-HGF的增龄组HGF值随年龄增加而降低,经LSD法组间多重比较,第20天组高于第10天和第30天组(图1,表3)。
未打入Ad-HGF增龄组大鼠脑组织中TGF-β1表达较少,但在未打入Ad-HGF的模型组大鼠脑组织中TGF-β1明显增加。打入Ad-HGF组脑组织可见TGF-β1表达减少。TGF-β1 OD值随年龄的增加呈正相关(表4)。各组内不同时间之间比较,经one way ANOVA分析,未打入Ad-HGF增龄组大鼠脑组织中TGF-β1 OD值随时间变化无差异,未打入Ad-HGF的模型组和3个年龄Ad-HGF组脑组织中TGF-β1 OD值随时间变化有差异,经LSD法组间多重比较,第20天组低于第10天和第30天组(P<0.05,图2,表4)。

表3 不同时间点各组大鼠脑组织中HGF OD值比较

表4 不同时间点各组大鼠脑组织中TGF-β1 OD值比较
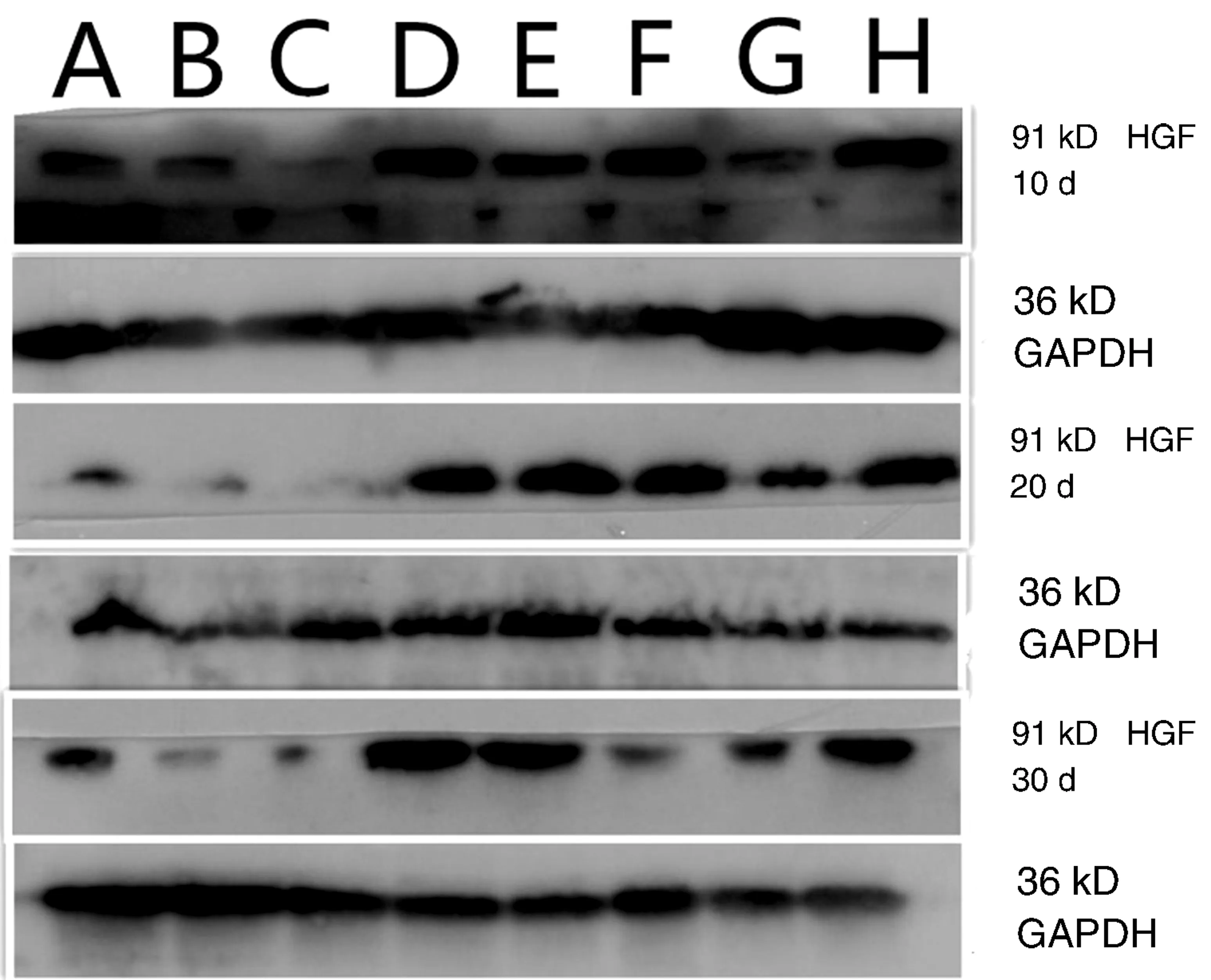
图1 Western blotting HGF蛋白表达 A:1月组;B:6月组;C:12月组;D:1月Ad-HGF组;E:6月Ad-HGF组;F:12月Ad-HGF组;G:模型组;H:模型Ad-HGF组
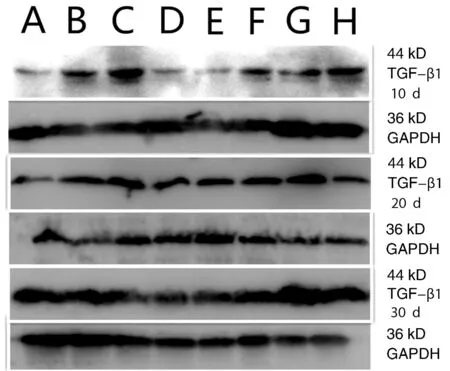
图2 Western blotting TGF-β1蛋白表达 A:1月组;B:6月组;C:12月组;D:1月Ad-HGF组;E:6月Ad-HGF组;F:12月Ad-HGF组;G:模型组;H:模型Ad-HGF组
3 讨论
本实验将外源性HGF打入3组增龄大鼠组,发现随着年龄的增加,HGF水平逐渐降低,随年龄增加,TGF-β1水平逐渐升高。而将外源性HGF打入老龄脑动脉粥样硬化模型大鼠后,随着动脉硬化程度加深,机体内HGF水平逐渐增加,TGF-β1水平却逐渐降低。说明HGF与动脉硬化程度呈正相关,与年龄呈负相关,TGF-β1与动脉硬化程度呈负相关,与年龄呈正相关。HGF、TGF-β1水平随年龄变化呈动态互逆平衡,HGF、TGF-β1水平随脑动脉硬化程度呈动态互逆平衡。
HGF 的快速诱导表达在遥远的完整器官中很常见,如肝、肾、肺、脾,以及在受伤在大鼠缺血再灌注损伤后的心及大脑中[14],表明内源性HGF可能来自这些器官。在肝、肾损伤大鼠血浆中,也有体液因子诱导HGF的表达[15]。转化生长因子β1可以由急性和慢性脑损伤引起,包括卒中、外伤、癫痫、多发性硬化症和阿尔茨海默病[16]。转化生长因子β1在不同类型的脑损伤中表达是不一样的,不同类型脑损伤时,TGF-β1有不同对应:卒中时TGF-β1的mRNA至少升高1周以上,明确发挥保护神经细胞的作用[17]。有文献报道,卒中时TGF-β1过度表达[18-20];当TGFβ信号被阻断,缺血损害加剧[21]。因此,它可能是一种有效的卒中治疗剂。
HGF、TGF-β1之间相互的平衡,参与确定的慢性器官疾病的预后,如脑梗死、肝硬化、肾硬化和肺纤维化[22-23]。在慢性疾病的早期阶段,HGF生产增强抑制TGF-β1产生。一般来说,HGF只在细胞再生和抗肝纤维化事件中作为代偿反应发生[24-25]。相比之下,在晚期TGF-β1表达的上调抑制HGF的表达[26]。在TGF-β1占主导地位的条件下,容易导致器官纤维化的发生和器官发展为功能障碍。为扭转这种不利的平衡,根据这种发病机制,所以用HGF治疗器官的功能衰竭以及纤维化(及增生)应视为一种新策略[27-29]。
本实验通过建立增龄及动脉硬化模型大鼠实验,探讨了脑组织和脑脊液中HGF和TGF-β1含量变化与年龄以及动脉硬化的关系,初步显示HGF-TGF-β1平衡在老龄以及脑动脉硬化发生、发展中的神经保护和血管形成过程中的作用,明确外源性Ad-HGF应用于中枢神经系统的有效性和不良反应。本实验对Ad-HGF应用于脑动脉硬化临床提供了科学依据,对脑血管病的防治提供了一种新的治疗方法和研究方向,也为神经康复治疗提供一个新途径。
[1] SHEN C Y,TANG L C,LI Y T.Epidemiological investigation and risk factors of cerebral apoplexy in young and middle-aged population in western Guangdong[J].J Guangdong Med Coll,2015,4:42-44.
[2] LUO J,HO P P,BUCKWALTER M S,et al.Glia-dependent TGF-beta signaling,acting independently of the TH17 pathway,is critical for initiation of murine autoimmune encephalomyelitis[J].J Clin Invest,2007,117(11):3 306-3 315.
[3] TOMIC G,STOJANOVIC M,PAVLOVIC A.Speech and language disorders secondary to diffuse subcortical vascular lesion:Neurolinguistic and acoustic analysis.A case report[J].J Neurologic Sci,2009,283(1/2):163-169.
[4] POORTHUIS M H F,LGRAAM M D,ALGRA A,et al.Female-and Male-Specific Risk Factors for Stroke A Systematic Review and Meta-analysis[J].JAMA Neurol,2017,74(1):75-81.
[5] CARR K R,ZUCKERMAN S L,MOCCO J,et al.Inflammation,Cerebral Vasospasm,and Evolving Theories of Delayed Cerebral Ischemia[J].Neurol Res Int,2013,6:12.
[6] LI M,PENG T,SHI X,et al.Applied anatomic study and three-dimension reconstruction of the blood supply of pancreatic head[J].Chin J Clin Anat,2014,8:15-17.
[7] SHIMAMURA M,NAKAGAMI H,TANIYAMA Y,et al.Gene therapy for peripheral arterial disease[J].Exp Opin Biol Ther,2014,14(8):1 175-1 184.
[8] KAMINSKY S M,ROSENGARTT K,ROSENBERG J,et al.Gene Therapy to Stimulate Angiogenesis to Treat Diffuse Coronary Artery Disease[J].Human Gene Ther,2013,24(11):948-963.
[9] CARMELIET P,JAIN R K.Molecular mechanisms and clinical applications of angiogenesis[J].Nature,2011,473(7 347):298-307.
[10] NAKAMURA T,MIZUNO S.The discovery of hepatocyte growth factor (HGF) and its significance for cell biology,life sciences and clinical medicine[J].Proc Jpn Acad Ser B Phys Biol Sci,2010,86(6):588-610.
[11] MULLEN A C,ORLANDO D A,NEWMAN J J,et al.Master transcription factors determine cell-type-specific responses to TGF-β signaling[J].Cell,2011,147(3):565-576.
[12] 申冠洋,宋志秀,常利,等.肝细胞生长因子、TGF-β1含量与脑动脉粥样硬化程度关系[J].中国动脉硬化杂志,2014,22(3):269-273.
[13] 药红梅,吕吉元.几种冠状动脉粥样硬化大鼠模型建立方法比较[J].中西医结合心脑血管病杂志,2011,4(9):450-451.
[14] YILDIZ Y,SOKMENSUER C,YALCIN S.Evaluation of c-Met,HGF,and HER-2 expressions in gastric carcinoma and their association with other clinicopathological factors[J].Onco Targets Ther,2016,9:5 809-5 817.
[15] COTA B D C V,LIMA K S,MORAD A M.Expression of the c-MET,HGF and VEGF biomarkers in intes-tinal and diffuse gastric cancer in the Brazilian population:a pilot study for the standardization of the quantitative PCR technique[J].Appl Cancer Res,2017,37(1):18.
[16] BUCKWALTER M,WYSS-CORAY T.Modelling neu-roinflammatory phenotypes invivo[J].J Neuroinflammation,2004,1:10.
[17] SUGIMOTO K,NISHIOKA R,IKEDA A,et al.Activated microglia in a rat stroke model express NG2 proteoglycan in peri-infarct tissue through the involvement of TGF-β1[J].Glia,2014,62(2):185.
[18] BUISSON A,LESNE S,DOCAGNE F,et al.Transforming growth factor-beta and ischemic brain injury[J].Cell Mol Neurobiol,2003,23(4/5):539-550.
[19] WANG S,YIN J,GE M,et al.Transforming growth-beta 1 contributes to isoflurane postconditioning against cerebral ischemia-reperfusion injury by regulating the c-Jun N-terminal kinase signaling pathway[J].Biomed Pharmacother,2016,78(2):280-290.
[20] MA M,MA Y,YI X,et al.Intranasal delivery of transforming growth factor-beta 1 in mice after stroke reduces infarct volume and increases neurogenesis in the subventricular zone[J].BMC Neurosci,2008,9:117.
[21] YOO S W,CHANG D Y,LEE H S,et al.Immune following suppression mesenchymal stem cell transplantation in the ischemic brain is mediated by TGF-β[J].Neurobiol Dis,2013,58:249-257.
[22] MIZUNO S,MATSUMOTO K,NAKAMURA T,et al.Hepatocyte growth factor suppresses interstitial fibrosis in a mouse model of obstructive enephropathy[J].Kidney Int,2001,59(4):1 304-1 314.
[23] GIEBELER A,BOEKSCHOTEN M V,KLEIN C,et al.c-Meconfers protection against chronic liver tissue damage and fibrosis progression after bile duct ligation in mice[J].Gastroenterology,2009,137(1):297-308.
[24] LIN Y,FANG Z P,LIU H J,et al.HGF/R-spondin1 rescues liver dysfunction through the induction of Lgr5+ liver stem cells[J].Nature Commun,2017,8(1):1 175.
[25] ISHIKAWA T,FACTOR V M,MARQUARDT J U,et al.Hepatocyte Growth Factor(HGF)/c-Met Signaling is required for Stem Cell Mediated Liver Regeneration[J].Hepatology,2012,55(4):1 215-1 226.
[26] BYE N,ZIEBA M,WREFORD N G,et al.Resistance of the dentate gyrus to induced apoptosis during ageing is associated with increases in transforming growth factor-b1 messenger RNA[J].Neuroscience,2001,105:853-862.
[27] POWELL R J,SIMONS M,MENDELSOHN F O,et al.Results of a double-blind,placebo-controlled study to assess the safety of intramuscular injection of hepatocyte growth factor plasmid to improve limb perfusion in patients with critical limb ischemia[J].Circulation,2008,118(1):58-65.
[28] KO B,HE T,GADGEEL S,et al.MET/HGF pathway activation as a paradigm of resistance to targeted therapies[J].Ann Transl Med,2017,5(1):4.
[29] WANG J,FU X,ZHANG D,et al.Effects of crenol-anib,a nonselective inhibitor of PDGFR,in a mouse model of transient middle cerebral artery occlusion[J].Neuroscience,2017,364:202-211.
