荧光定量PCR技术在食品包装材料致病菌监测中的应用
2018-05-24雷琼
雷 琼
(贵州省产品质量监督检验院,贵州 贵阳 550016)
现今,食品安全问题在我国矛盾突出,食品问题层出不穷,严重影响国民的生活健康。为了进一步加强食品安全,找出影响食品安全的因素成为解决问题的关键。食品包装作为食品的外衣,污染物可通过扩散、溶解和分散进入到食品,食品包装已成为影响食品安全性的主要因素[1]。在我国食品安全突出的大环境下,建立一种快速安全的食品包装材检测方法至关重要。食品包装材料的安全性检测主要是通过化学物理等方法进行如气相色谱-质谱联用(GC-MS)、气相色谱(GC)、高效液相色谱(HPLC)、顶空气相色和高效液相色谱-质谱连用(HPLC-MS)等[2]。采用分子生物学方法进行包装材料致病菌检测就所查文献,尚未报到。
实时荧光PCR(Quantitative Real-time PCR)是在PCR 技术基础上建立的一种新型核酸定量技术,可进一步将荧光能量传递技术应用于常规的PCR 仪器中,现已成为微生物学诊断最强有力的工具[3]。该技术不仅实现了对DNA模板的定量,还具有高灵敏度、高特异性和高可靠性等优点。雷永良等在2009年将Real-time PCR技术运用于食品污染物监测中,并采用传统细菌培养法进行对比,结果表明荧光PCR方法较传统的细菌培养法具有更高的特异性和准确性[4]。周丽民等在2009 年至 2010 年将实时荧光定量 PCR 技术应用于临床快速筛查致病菌,认为该法是快速筛查致病菌的理想检测方法[5]。高涛等于2017年将免疫磁珠富集-实时荧PCR技术应用于检测单核细胞增生李斯特菌、金黄色葡萄球菌、沙门菌 3 种致病菌,建立食品微生物及其致病因子的监测新技术[6]。张靖雯在2017年报道,荧光定量 PCR 技术已经被应用于国内外的环境监测方面,有助于环境中微生物的检测及研究[7]。目前,荧光定量PCR已广泛应用于食品、分子生物学、医学及环境等多研究等领域,但尚未应用于食品包装材料安全性检测中。
面对国内食品安全事件日益严峻,备受重点关注的现状,为了进一步保护消费者的切身利益,将荧光定量PCR技术应用于食品包装材料中致病菌的检测,建立一种新型快速简便的高效检测方法,从分子生物学角度为食品安全性检测奠定基础。
1 材料与方法
1.1 试验材料
材料:食品包装材料(空白及添加阳性菌);试剂:基因组提取试剂盒(TaKaRa,9763);荧光定量试剂盒(深圳生科源);琼脂糖(Agarose)、无水乙醇、三羟甲基氨基甲烷(Tris)等试剂均为国产。
仪器:移液器量程覆盖0.1~100μL共5 支(Eppendorf);C1000TM Thermal Cycler PCR仪;Gel Doc XR凝胶成像系统(Bio-Rad);2-16k高速冷冻离心机(Eppendorf); DYY-4型电泳仪(北京六一仪器厂)。
1.2 实验方法
1.2.1 基因组提取
称取样品5.0 g与450 mLPBS缓冲液中,按照基因组提取试剂盒说明书提取细菌基因组DNA,加入0.7%琼脂糖凝胶电泳30min,利用凝胶成像系统检测DNA纯度及完整度,核酸测定仪检测质量和浓度。
1.2.2 荧光定量PCR检测体系

表1 荧光定量PCR反应体系
根据荧光定量试剂盒说明书反应体系为2×SYBR Primex Ex Taq 12.5μL、PCR forward primer 1μL、PCR Reverse primer 1μL、DNA模板2μL、ddH2O 8.5μL。反应体系见表1。
2 实验结果
2.1 基因组提取结果图
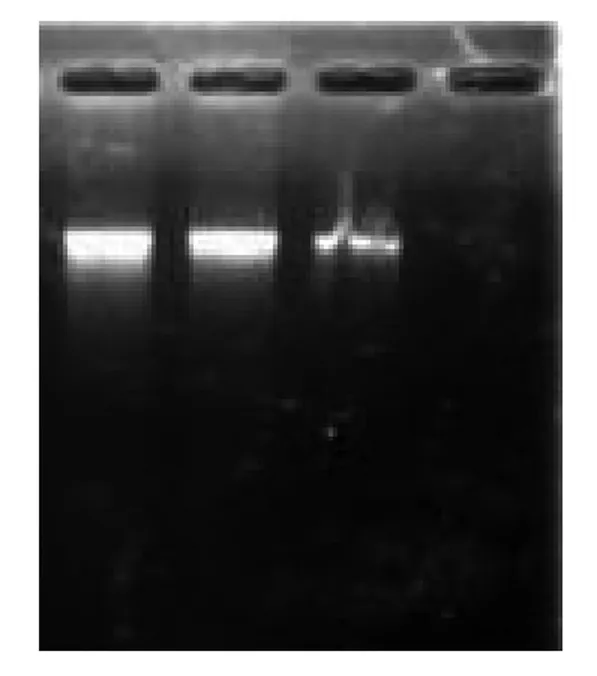
图1 细菌基因组
由图1可知,细菌基因组DNA提取结果正确,条带单一且明亮整齐,无降解。点样孔没有亮点,表明提取的基因组DNA纯度较高,没有蛋白质和RNA污染。核酸测定仪结果显示,OD260/OD280为1.82及1.80,满足PCR反应要求。
2.2 荧光定量PCR结果图
构建标准曲线,由图2可知扩增效率为101.5%,R2为0.99。溶解峰峰型单一,无杂峰,说明无非特异性扩增。标准曲线及溶解峰结果均满足荧光定量PCR要求,数据可信。
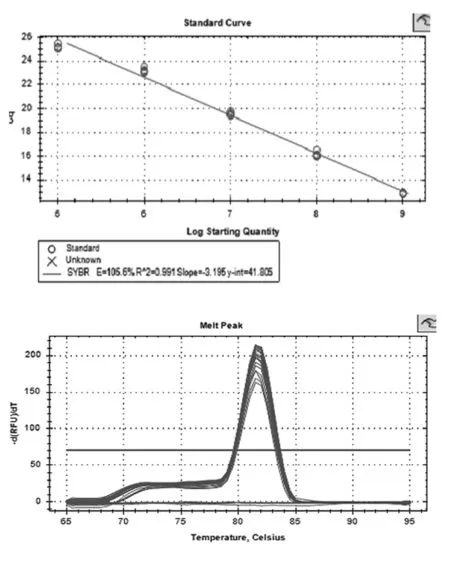
图2 溶解曲线及溶解峰
荧光定量PCR结果见图3,5~8常规样品,其扩增曲线为直线,无Ct值,无扩增效率,表明没有致病菌存在;1~4号添加标准菌株的样品,其Ct≤35,出现明显的扩增曲线,根据试剂盒说明书判定结果为阳性,实验结果与实验设计完全一致。
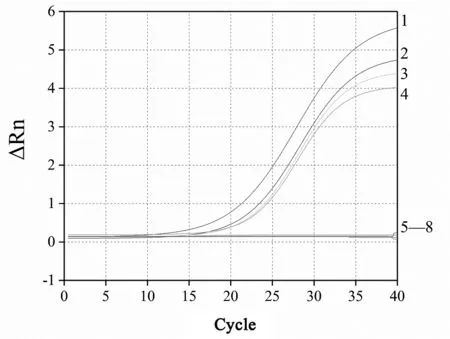
图3 荧光定量PCR结果图
3 结果与分析
试验表明,实时荧光PCR 测定食品包装材料中致病菌的结果为阳性,与预期结果一致。证明荧光定量PCR技术可用于食品包装材料致病菌检测。实验结果可知,本方法具有准确度高、过程简单安全、节省人力及实验耗材、重复性好等特点,能够快速高效地测定批量的样品。
近年来,食品安全事件频发,目前检测病原细菌的方法主要是细菌学培养法,要经过富集培养、生理生化鉴定、形态观察等。赵琢等在2013年采用多重PCR的方法对食品包装材料中对沙门氏菌的检测,取得了较为满意的检测灵敏度[8]。本研究建立的荧光定量PCR 方法可完成对多种致病菌的检测,与传统的细菌学培养法及普通PCR技术相比较,步骤简单,具有更高的特异性和灵敏度,更加简便经济,具有更高的应用价值,为食品包装材料中致病菌检测提供了一种分子生物学技术,对于提升食源性致病菌的综合检测能力,满足国家食品包装及食品检验中心的建设需求具有重要意义,为今后食品包装材料的安全性检测科研数据等奠定基础[9]。
参考文献
[1]唐 玉,张峻岭.食品包装安全分析[J].食品界,2016(6):26-27.
[2]秦 蓓.塑料食品包装材料安全性研究现状[J].包装工程,2011(19):33-37.
[3] Sachse K.Specificity and performance of diagnostic PCR assays[J].Methods in Molecular Biology,2003,216(216):3-29.
[4]雷永良,王晓光,叶碧峰,等.实时荧光定量PCR技术在食品污染物监测中的应用[J].中国卫生检验杂志,2009(4):828-830.
[5]周丽民,雷永良,王小光,等.实时荧光定量PCR技术在致病菌检测中的应用[J].标记免疫分析与临床,2012,19(5):296-299.
[6]高 涛,张丽萍,魏 雯,等.免疫磁珠富集-实时荧光PCR技术在食源性致病菌监测中的应用研究[J].医学动物防制,2017(1):18-20.
[7]张靖雯.荧光定量PCR技术在环境微生物检测中的应用研究[J].智库时代,2017(5):43-45.
[8]赵 琢,栗建永,贾晓川,等.食品接触材料中沙门氏菌的多重PCR检测方法[J].食品研究与开发,2013(24):193-196.
[9]左泽彦,孙端方.实时荧光PCR检测食品中牛及猪源性成分[J].贵州农业科学,2016,44(4):130-132.
