乳腺癌术前外周血循环肿瘤细胞计数的临床应用价值研究
2018-05-23单海琳邵清苏瑛周斌邹润龙
单海琳,邵清,苏瑛,周斌,邹润龙
(东南大学附属江阴市人民医院 乳甲外科,江苏 江阴 214400)
自1869年Ashworth[1]首次探查到循环肿瘤细胞(CTCs)后,经过多年的努力探索揭示了CTCs及CTCs微栓(CTM)在肿瘤的复发转移中扮演的重要角色。多项研究表明,CTCs不仅与肿瘤患者的生存预后密切相关,还在预测疗效和预后方面发挥重要作用[2- 3],CTCs检测较穿刺或手术活检等有创检查的局限性及影像学检查的滞后性[4- 5]能更有效、经济、及时地评估患者预后和监测病情进展。
本研究旨在应用免疫磁珠阴性富集联合荧光原位杂交法检测乳腺癌患者术前CTCs,通过与临床病理特征的相关性研究探讨原发灶的CTCs作为早中期乳腺癌预后的一种潜在肿瘤分子标志物的价值。
1 对象与方法
1.1 研究对象
以2015年1月至2016年5月本院136例初发乳腺癌患者及60例良性乳腺结节患者为研究对象,取其术前1 d的外周血,排除接受新辅助化疗及存在第二原发肿瘤的患者。年龄29~86岁,中位年龄51岁。术后按WHO肿瘤病理学及遗传学分类(2004年)行病理组织学分类及病理分级,病理类型均为浸润性导管癌,Ⅰ~Ⅲ期。本研究经医院伦理委员会批准,患者签署有关收集临床及病理资料的知情同意书。
1.2 检测方法
1.2.1 富集实验 采用ACD抗凝真空抽取3.2 ml外周血,移至离心管,补充磷酸盐缓冲液至45 ml,离心5 min,去上清至12 ml,加氯化铵缓冲液至45 ml混匀,室温下以20 r·min-1离心8 min,弃上清至500 μl,混匀后加磷酸盐缓冲液至5 ml。吸取150 μl·人-1磁微粒混悬液至2 ml EP管中,用磷酸盐缓冲液清洗磁珠,每份加入150 μl磁微粒,35°~40°室温摇动20 min(100~120 r·min-1)。取50 ml离心管中加入3 ml磷酸盐分离缓冲液,将所有含磁微粒液体轻轻叠加到顶层,1 ml磷酸盐缓冲液清洗离心管管壁后亦转移至上述顶层,移取最上2层,加磷酸盐缓冲液至14 ml,颠倒混匀3次后离心,弃上清至300 μl,加入1 ml 磷酸盐缓冲液,轻柔吹打5次重悬沉淀细胞。将标本转移至2 ml离心管中,靠于磁力架上2~3 min,将液体转移至1.5 ml离心管中离心(2 070×g,3 min),弃上清至100 μl,加入100 μl醇类固定液,轻柔吹打混匀10次以上,涂片至标本框中干燥。
1.2.2 荧光原位杂交实验 取醇类磷酸盐固定液200~300 μl完全覆盖标本区域,室温固定8 min。吸去固定液,放入预热的2×SSC中静置10 min,脱水,取10 μl探针加入标本区,盖片,封片。76 ℃变性5 min,37 ℃杂交1.5 h。43 ℃甲酰胺工作液中静置3次,5 min·次-1。室温下在染色缸Ⅰ、Ⅱ(2×SSC)中各静置1次、5 min。
1.2.3 免疫荧光染色操作 按每人份20 μl CD45- AF594荧光抗体、180 μl 2%BSA溶液的比例配制抗体工作液,避光待用。0.2% BSA洗标本区2次,每次300 μl,将配置好的抗体加至标本区,室温并避光孵育1 h。用0.2% BSA洗标本区2次,吸净残留液体,取10 μl DAPI染液复染,盖片。
1.2.4 结果判读 任一探针信号点>2个,且无血源性白细胞表面抗原着色时计为一个阳性细胞;当细胞有血源性白细胞表面抗原,或信号≤2个计为阴性细胞;Cut- off值=2个CTCs/3.75 ml血液。
1.3 统计学处理
应用SPSS 17.0软件进行统计学处理,本资料数据为非正态分布,数据描述采用中位数及四分位数间距,多分类变量统计采用卡方检验。多因素分析采用Logistic回归模型。双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌患者与乳腺良性结节患者CTCs的检测结果
136例乳腺癌患者外周血中CTCs阳性率为46.32%,60例乳腺良性结节均未检出CTCs,两组比较差异有统计学意义(P<0.01)。见表1。
2.2 CTCs与乳腺癌癌组临床特征的关系
卡方检验分析表明,136例乳腺癌患者CTCs阳性率在年龄、肿瘤大小、分级、淋巴结分期、AJCC分期、ER、PR、Ki67状态、分子分型表达差异均无统计学意义(P>0.05)。Her2阳性乳腺癌检出率低于Her2阴性组(36.2%vs51.7%),但差异无统计学意义(P>0.05)。见表2。
表1乳腺癌患者与乳腺良性结节患者CTCs的检测结果

病理性质nCTCs阴性/例CTCs阳性/例χ2值P值恶性136736340.9600.000良性60600
2.3 乳腺癌患者CTCs与其临床病理特征的Logistic回归分析
Logistic回归结果表明,CTCs阳性水平与AJCC分期及Her2状态具有相关性。
AJCC分期:OR=1.882,P=0.011;Her2状态:OR=0.477,P=0.057。见表3。
表2乳腺癌患者CTCs与临床病理特征的关系
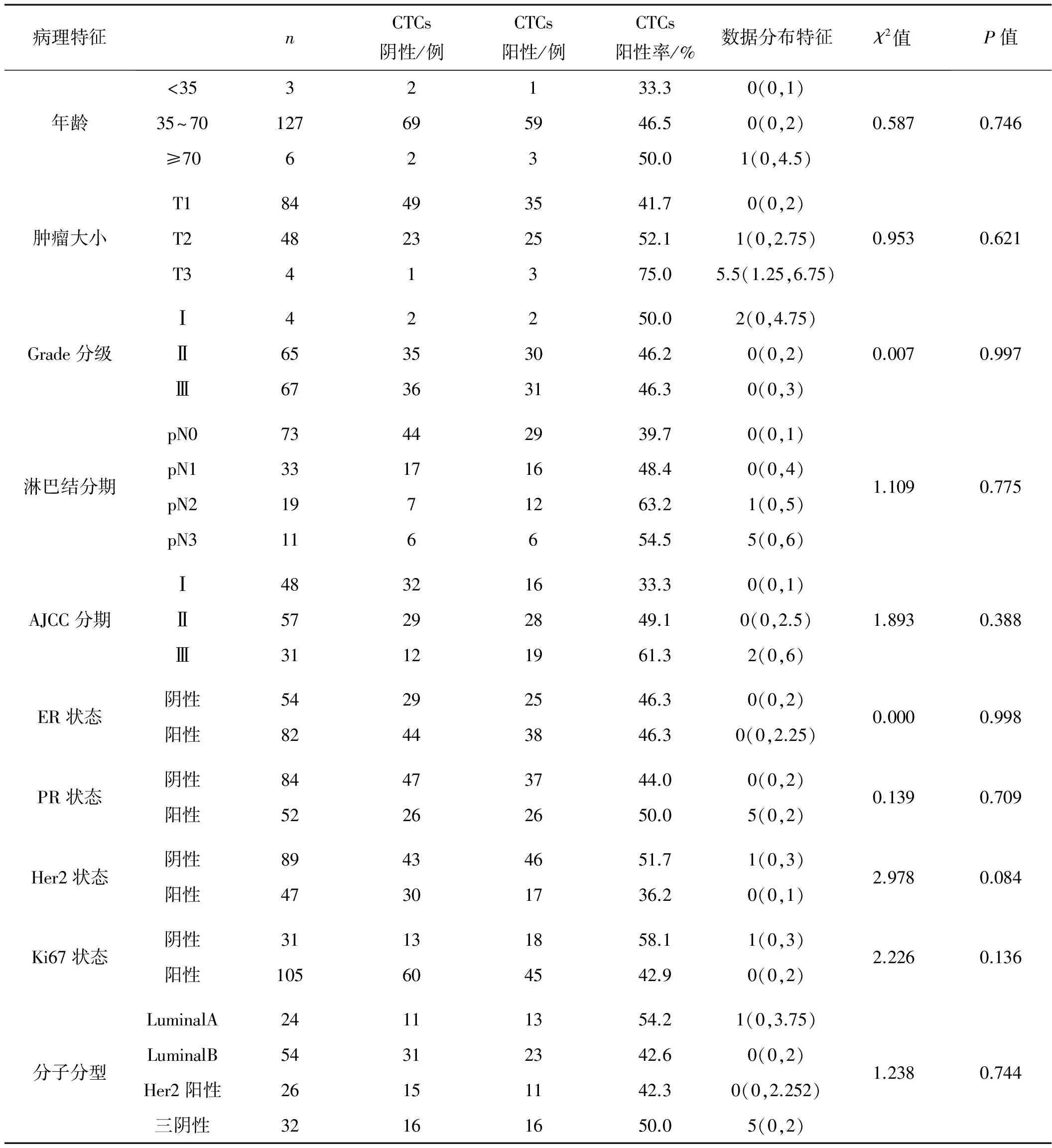
病理特征nCTCs阴性/例CTCs阳性/例CTCs阳性率/%数据分布特征χ2值P值年龄<3532133.30(0,1)35~70127695946.50(0,2)≥7062350.01(0,4.5)0.5870.746肿瘤大小T184493541.70(0,2)T248232552.11(0,2.75)T341375.05.5(1.25,6.75)0.9530.621Grade分级Ⅰ42250.02(0,4.75)Ⅱ65353046.20(0,2)Ⅲ67363146.30(0,3)0.0070.997淋巴结分期pN073442939.70(0,1)pN133171648.40(0,4)pN21971263.21(0,5)pN3116654.55(0,6)1.1090.775AJCC分期Ⅰ48321633.30(0,1)Ⅱ57292849.10(0,2.5)Ⅲ31121961.32(0,6)1.8930.388ER状态阴性54292546.30(0,2)阳性82443846.30(0,2.25)0.0000.998PR状态阴性84473744.00(0,2)阳性52262650.05(0,2)0.1390.709Her2状态阴性89434651.71(0,3)阳性47301736.20(0,1)2.9780.084Ki67状态阴性31131858.11(0,3)阳性105604542.90(0,2)2.2260.136分子分型LuminalA24111354.21(0,3.75)LuminalB54312342.60(0,2)Her2阳性26151142.30(0,2.252)三阴性32161650.05(0,2)1.2380.744
表3乳腺癌CTCs与病理特征的Logistic回归分析纳入模型的变量检验结果
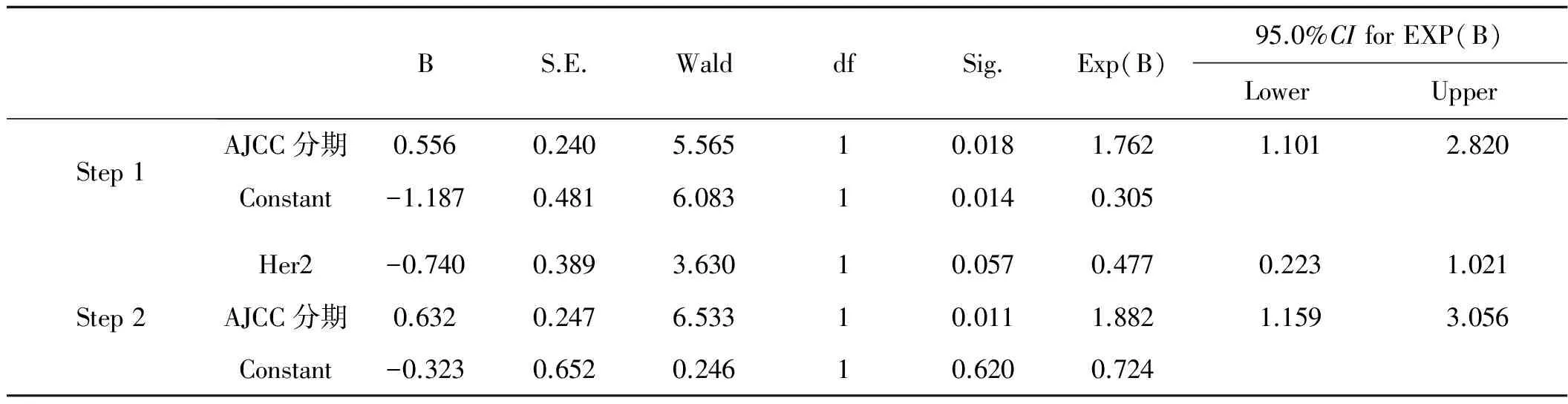
BS.E.WalddfSig.Exp(B)95.0%CIforEXP(B)LowerUpperStep1AJCC分期0.5560.2405.56510.0181.7621.1012.820Constant-1.1870.4816.08310.0140.305Step2Her2-0.7400.3893.63010.0570.4770.2231.021AJCC分期0.6320.2476.53310.0111.8821.1593.056Constant-0.3230.6520.24610.6200.724
3 讨 论
CTCs是自发或因诊疗操作由原发灶或转移灶释放进入外周血循环的肿瘤细胞,是恶性肿瘤术后复发和远处转移的重要原因。多项分析显示CTCs是肿瘤患者PFS 和OS 的独立预测指标[6- 7],既往研究肯定了CTCs在评判转移性乳腺癌预后中的作用,治疗后的CTCs数量也是影响患者生存的独立预测因子。
以往CTCs在乳腺癌中的研究多集中在晚期,这是由于晚期肿瘤负荷大及多发远处转移灶形成,较早期患者易捕获。随着细胞富集技术、免疫学技术在CTCs检测中的应用,提高了检测的敏感性和特异性[8],如将间质特异性抗原纳入检测系统后,灵敏度和特异度较之Cellsearch分别由47%和83%提升为85%和94%,使得在早期乳腺癌中检测CTCs成为可能。近年免疫磁珠阴性富集法对外周血CTCs具有更高效的回收率,其优点是去除外周血肿大部分白细胞,不受肿瘤细胞表达上皮抗原量的影响。根据该原理,我们采用免疫磁珠阴性富集联合荧光免疫化学染色法检测其在Ⅰ~Ⅲ期乳腺癌病例中的表达。
乳腺癌组检出CTCs总阳性率为46.32%,乳腺良性结节组阳性率为0(P<0.01),特异性100%,与蔡清清等[9]报道接近。既往较多研究报道CTCs和乳腺癌病理特征缺乏相关性[10],如Lang等[11]认为,Her2状态是唯一与CTCs有关的肿瘤特征;Ferro等[12]认为淋巴结转移、肿瘤大小、ER阳性的肿瘤更易检出CTCs;国内原晓燕[13]认为肿瘤直径是CTCs阳性的独立影响因素;李蕾等[14]认为转移性乳腺癌CTCs水平与组织学Her2状态及转移灶数目具有相关性,对早期患者进行CTCs检测可能对肿瘤复发转移具有预测作用。本研究卡方检验分析表明CTCs 阳性率在Her2状态有微弱差异(P=0.084),而与其它病理特征缺乏相关性。Logistic回归结果表明CTCs阳性水平与乳腺癌AJCC分期具有相关性(P<0.01),分期越晚CTCs检出率越高,提示CTCs是肿瘤发生远处转移的早期事件,这在有关文献中也有证实[15- 16]。回归分析也表明CTCs阳性水平与原发灶Her2状态显示出微弱的负相关性,Her2阴性者有更高的CTCs表达,这与卡方检验的结果一致,但该结果是否具有现实临床意义有待进一步研究,因为这与有些研究得出的结论不尽相同。有学者推测肿瘤细胞可能是间歇性成群释放,使单点检测值低于实际表达情况,致CTCs阳性检出率仍有限,建议连续多次取样或加大样本量可能会提高检出率;还有报道在肿瘤原发灶与CTCs中检测Her2状态不符合率达14%~48%,原因是肿瘤在脱落、侵袭和转移过程中CTCs 可获得Her2基因的扩增,建议检测CTCs中Her2水平显得更有意义,对于那些原发灶Her2阴性而CTCs Her2阳性的患者应用靶向治疗仍然可能有效;另外还需考虑到不同检测方法、每个患者抽取的外周血容积不尽相同、标准化程序上的不同、阳性界定标准不同等原因都可能造成上述结论的差异。
2017年AJCC第8版乳腺癌分期系统中作为Ⅱ级证据提出,早期乳腺癌CTCs≥1个,晚期乳腺癌CTCs≥5个时提示预后不良。本研究仅初步探讨了早中期乳腺癌患者CTCs与临床病理特征之间的关系,提示术前检测对病情评估有一定的临床应用价值。下一步应追踪早中期患者治疗后的CTCs数量变化及进行长期随访综合治疗后相关性和判断预后的临床价值研究;随着捕获技术的不断进步,研究关注的焦点也应从单纯CTCs计数转移到对CTCs表型及分子特征的探讨,为制订个体化治疗方案提供依据。
[参考文献]
[1] ASHWORTH T.A case of cancer in which cells similar to those in the tumors were seen in the blood after death[J]. Aust Med J,1869,14(5):146- 149.
[2] NAKAMURA S,YAGATA H,OHNO S,et al.Multi- center study evaluating circulating tumor cells as a surrogate for response to treatment and overall survival in metastatic breast cancer[J].Breast Cancer,2010,17(3):199- 204.
[3] HOU J M,KREBS M G,SLOANE R,et al.Molecular features and clinical relevance of circulating tumor cells(CTC)and circulating tumor microemboli (CTM)in patients with small cell lung cancer(SCLC)[J].Clinical & Experimental Metastasis,2011,28(2):221- 222.
[4] EISENHAUER E A,THERASSE P,BOGAERTS J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline( version1.1) [J].Eu J Cancer,2009,45(2):228- 247.
[5] 姜华,国光菊,刘刚.超声引导下组织切除活检对乳腺癌Ⅱ、Ⅲ级预防的价值[J].现代医学,2011,39(5):575- 577.
[6] HOU J M,KREBS M G,LANCASHIRE L,et al.Clinical significance and molecular characteristics of circulating tumor cells and circulating tumor microemboli in patients with small- cell lung cancer[J].J Clin Oncol,2012,30(5):525- 532.
[7] KREBS M G,SLOANE R,PRIEST L,et al.Evaluation and prognostic significance of circulating tumor cells in patients with non- small- cell lung cancer[J].J Clin Oncol,2011,29(12):1556- 1563.
[8] ALIX- PANABIERES C,RIETHDORF S,PANTEL K.Circulating tumor cells and bone marrow micrometastasis[J].Clin Cancer Res,2008,14(16):5013- 5021.
[9] 蔡清清,黄慧强,林天歆,等.乳腺癌患者外周血中循环癌细胞的检测及其临床意义[J].癌症,2005,24(7):837- 841.
[10] KRISHNAMURTHY S,CRISTOFANILLI M,SINGH B,et al.Detection of minimal residual disease in blood and bone marrow in early stage breast cancer[J].Cancer,2010,116(14):3330- 3337.
[11] LANG J L,MOSALPURIA K,CRISTOFANILLI M,et a1.HER2 status predicts the presence of circulating tumor cells in patients with operable breast cancer[J].Breast Cancer Res Treat,2009,113(3):501- 507.
[12] FERRO P,FRANCESCHINI M C,BACIGALUPO B,et a1.Detection of circulating tumor cells in breast cancer patients using human mammaglobin RT- PCR:association with clinical prognostic factors[J].Anticancer Res,2010,30(6):2377- 2382.
[13] 原晓燕.可手术乳腺癌患者的循环肿瘤细胞与临床病理特征的关系[J].解放军医学院学报,2016,37(5):429- 431.
[14] 李蕾,江泽飞.循环肿瘤细胞检测在不同阶段不同类型乳腺癌中的应用[J].中国癌症杂志,2013,23:570- 575.
[15] WU C,HAO H J,LI L Y,et al.Preliminary investigation of the clinical significance of detecting circulating tumor cells enriched from lung cancer patients[J].J Thorac Oncol,2009,4(1):30- 36.
[16] COELLO M C,LUKETICH J D,LITLE V R,et al.Prognostic significance of micrometastasis in non- small- cell lung cancer[J].Clin Lung Cancer,2004,5(4):214- 215.
