基于miR- 21/Smad7探讨芍药苷在抗血管紧张素Ⅱ诱导心肌肥大中的作用
2018-05-23张会超徐里芮浩淼曹程浩杨凤鸣袁彬
张会超,徐里,芮浩淼,曹程浩,杨凤鸣,袁彬
(1.河南省中医院 心病科,河南 郑州 450000; 2.河南中医药大学 基础医学院,河南 郑州 450000;3.河南中医药大学 研究生院,河南 郑州 450000)
心肌肥厚是指心脏在各种生理以及病理因素的刺激下,为适应做功、维持心脏功能而表现出的体积与质量的增加,持续性心肌肥厚是心力衰竭及突发心源性死亡的主要原因,预防及逆转心肌细胞肥厚及心室重构是治疗心力衰竭的首要方法[1- 2]。芍药苷(Pae)是从中药毛莨科植物芍药中分离获得的一种单萜类糖苷化合物,是芍药的主要活性成分之一,具有抑制心室重塑、减轻缺血缺氧对心肌的损伤、改善心衰患者心功能等心脏保护作用[3- 4],Pae对心肌细胞肥大的作用及其机制的研究目前尚不充分。微小RNA(microRNAs,miRs)是影响心脏发育及心脏疾病进展的重要调节器,大量研究显示miRs在心肌肥大的过程中发挥重要作用,其中异常表达的microRNA- 21(miR- 21)与心肌肥厚、心肌细胞纤维化、心室重构及心脏功能的改善密切相关[5- 6]。然而,miR- 21是否参与了Pae防治及逆转心肌细胞肥大,发挥保护心肌细胞的作用及其潜在机制研究尚未见报道。本研究通过模拟心肌细胞肥大模型,基于miR- 21调控探讨Pae在抵抗血管紧张素Ⅱ(Ang- Ⅱ)诱导的心肌细胞肥大过程中的作用及其潜在机制。
1 材料与方法
1.1 乳鼠心肌细胞培养及分组
新生1~3日龄SD大鼠(购于北京维通利华实验动物技术有限公司)常规消毒后置于超净工作台开胸迅速取出心脏,分离心室后使用预冷的D- Hanks液冲洗3次,剪成约1 mm3大小的碎块后用0.2% 胰蛋白酶和0.1%胶原酶B 的混合消化液37 ℃水浴分次消化。采用差速贴壁原理分离去除非心肌细胞,调整细胞密度为3×105L-1,使用含5% 胎牛血清的改良Eagle培养基(DMEM) 置于二氧化碳培养箱中常规培养48 h后换用无血清培养基适应性培养10 h。实验分组:对照组(n=9);Ang- Ⅱ组(Ang- Ⅱ, Sigma, USA,150 nmol·L-1,n=9);Pae组(Pae,北京博奥森生物技术有限公司,25 μmol·L-1,n=9);Pae+Ang Ⅱ组,(n=9)。药物处理24 h后收集细胞进行各项指标的测定。
1.2 心肌细胞转染
心肌细胞以3×105孔-1接种于6孔板,待细胞达到70%~80%融合时进行转染,按照试剂盒(Cell signaling, USA)提供的说明书指示,将Smad7 siRNA、Lipofectamine 2000稀释于100 μl无血清的基础培养基opti- MEM中,室温放置5 min。随后将稀释的siRNA溶液加入脂质体溶液中,轻缓混匀,室温放置20 min;用基础培养opti- MEM漂洗2次,加入无血清基础培养基opti- MEM 1 ml·孔-1;将siRNA- 脂质体复合物加入细胞中,轻轻混匀,孵育6 h后换完全培养基,48 h后收集各组细胞待测。同法转染miR- 21 模拟物(mimic)、miR- 阴性对照(NC)及siRNA- NC。
1.3 双荧光素酶报告检测
PCR扩增Smad7 mRNA 3′- UTR,将扩增产物克隆到pMD18- T载体构建含野生型Smad7基因载体(Smad7- WT)。根据miRBase预测并利用点突变方法构建Smad7- 3′UTR 突变载体(Smad7- Mut),PsiCHECKTM- 2 载体(Promega,美国) 含萤火虫和海肾双荧光素酶。将构建的载体Smad7- WT UTR、Smad7- Mut进行XhoⅠ和NotⅠ双酶切,将野生型及含有突变位点的ROCK2- 3′UTR 克隆置于psiCHECKTM- 2 载体的海肾荧光素酶开放读码框架的下游,构建含该野生及突变载体的双荧光素酶报告载体。将所构建的荧光素酶报告载体与miR- 21(miR- 21 mimic)表达载体或者阴性对照(miR- NC)载体共转染至HEK- 293细胞,转染后24 h收集细胞进行双荧光素酶报告基因测定。计算公式:相对荧光值=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。
1.4 心肌细胞表面积大小的检测
心肌细胞经Ang Ⅱ处理24 h后,根据试剂盒(Santa Cruze,USA)提供的操作说明,携带荧光基团的染料鬼笔环肽(fluorescent phallotoxins)染心肌细胞骨架蛋白F- actinin,4′,6- 二脒基- 2- 苯基吲哚(DAPI)染核,Zeiss (AX10) 倒置荧光显微镜进行拍照,随机选取10个视野,测量100个细胞进而计算细胞的表面积,取平均值。每组重复测量3次。
1.5 Western blotting检测
将培养的各组心肌细胞用0.05%胰蛋白酶消化,PBS洗涤3次;加入450 μl蛋白裂解液常规方法裂解细胞,BCA 法测定蛋白浓度,样品经10%聚丙烯酰胺凝胶(SDS)电泳后转至聚偏氟乙烯(PVDF)膜,封闭后兔抗小鼠一抗GAPDH (1∶2 000,Cell Signaling,美国)、兔抗鼠心房利尿钠肽(ANP)(1∶1 000, Santa Cruz, 美国)及脑利尿钠肽(BNP)(1∶1 000,Santa Cruz,美国) 4 ℃孵育过夜,辣根过氧化物酶(HRP)标记山羊抗兔二抗,Western blotting检测ANP及BNP蛋白表达, FluorChem Q凝胶成像系统(Alpha Innotech,美国)显影,Scion Image图像分析系统对条带进行分析,目的蛋白的相对含量以目的蛋白与GAPDH条带光密度的比值表示,每组重复检测3次。
1.6 SYBR Green实时荧光定量PCR
Trizol(Invitrogen, 美国)抽提法提取细胞总RNA,紫外分光光度计测吸光度值确定RNA的浓度和纯度。Quantscript RT kit反转录合成cDNA,采用SYBR Green Ⅰ(Invitrogen, 美国)荧光染料嵌合法20 μl反应体系,即10 μl SYBR Green实时PCR Master Mix、1 μl 0.2 μmol·L-1引物、2 μl cDNA及7 μl无菌双蒸水。避光置于荧光定量PCR仪(ABI 7 500 Fast PCR)采集荧光信号检测miR- 21及ANP、BNP mRNA表达,U6 (Mus musculus U6 small nuclear RNA)及GAPDH分别作为miR- 21及mRNA内参,ABI7500配套软件采用2- ΔΔCт法处理数据。PCR扩增引物采用Oligo 6.0设计,由上海生工生物工程有限公司合成,引物及其序列见表1。
表1实时PCR引物序列
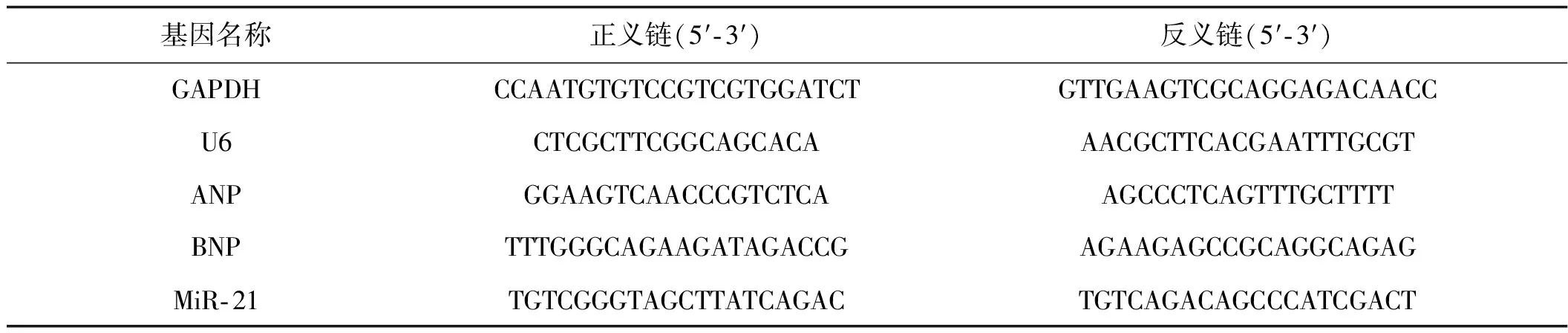
基因名称正义链(5′⁃3′)反义链(5′⁃3′)GAPDHCCAATGTGTCCGTCGTGGATCTGTTGAAGTCGCAGGAGACAACCU6CTCGCTTCGGCAGCACAAACGCTTCACGAATTTGCGTANPGGAAGTCAACCCGTCTCAAGCCCTCAGTTTGCTTTTBNPTTTGGGCAGAAGATAGACCGAGAAGAGCCGCAGGCAGAGMiR⁃21TGTCGGGTAGCTTATCAGACTGTCAGACAGCCCATCGACT
1.7 统计学处理
应用SPSS 20.0统计软件进行数据处理,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验分析,检验水准为双侧α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 Pae能有效抑制Ang- Ⅱ诱导的心肌细胞肥厚
结果显示,与对照组相比,Ang- Ⅱ处理能显著增加心肌细胞表面积约1.3倍(P<0.05)。Pae处理能显著抑制Ang- Ⅱ诱导的心肌细胞表面积增大,对心肌细胞表面积的抑制率约39%(P<0.05)(图1A、B)。实时PCR及Western blotting结果显示,与正常心肌细胞相比,Ang- Ⅱ组心肌细胞肥厚性标志基因ANP及BNP表达显著增加,Pae预处理对Ang- Ⅱ诱导的细胞表面积增加及ANP、BNP表达的上调均具有显著的抑制作用(均P<0.05) (图1C、D)。
2.2 Pae能显著降低Ang- Ⅱ诱导的肥厚性心肌细胞miR- 21表达
实时PCR检测结果显示,与对照组相比,Ang- Ⅱ组心肌细胞miR- 21相对表达量显著上调(P<0.05),Pae处理后能显著抑制Ang- Ⅱ诱导的miR- 21表达的增加(P<0.05) (图2),提示Pae可能是通过抑制miR- 21表达的增加发挥抵抗心肌细胞肥大的作用。
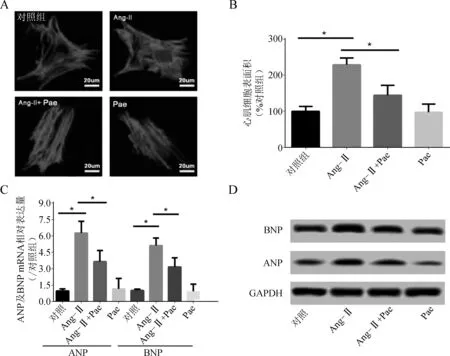
A、B.各组心肌细胞表面积,Scale bar=20 μm;C.ANP、BNP mRNA相对表达量;D.ANP、BNP蛋白表达 (*P<0.05)
图1Pae对AngⅡ诱导的心肌细胞肥大效应的影响
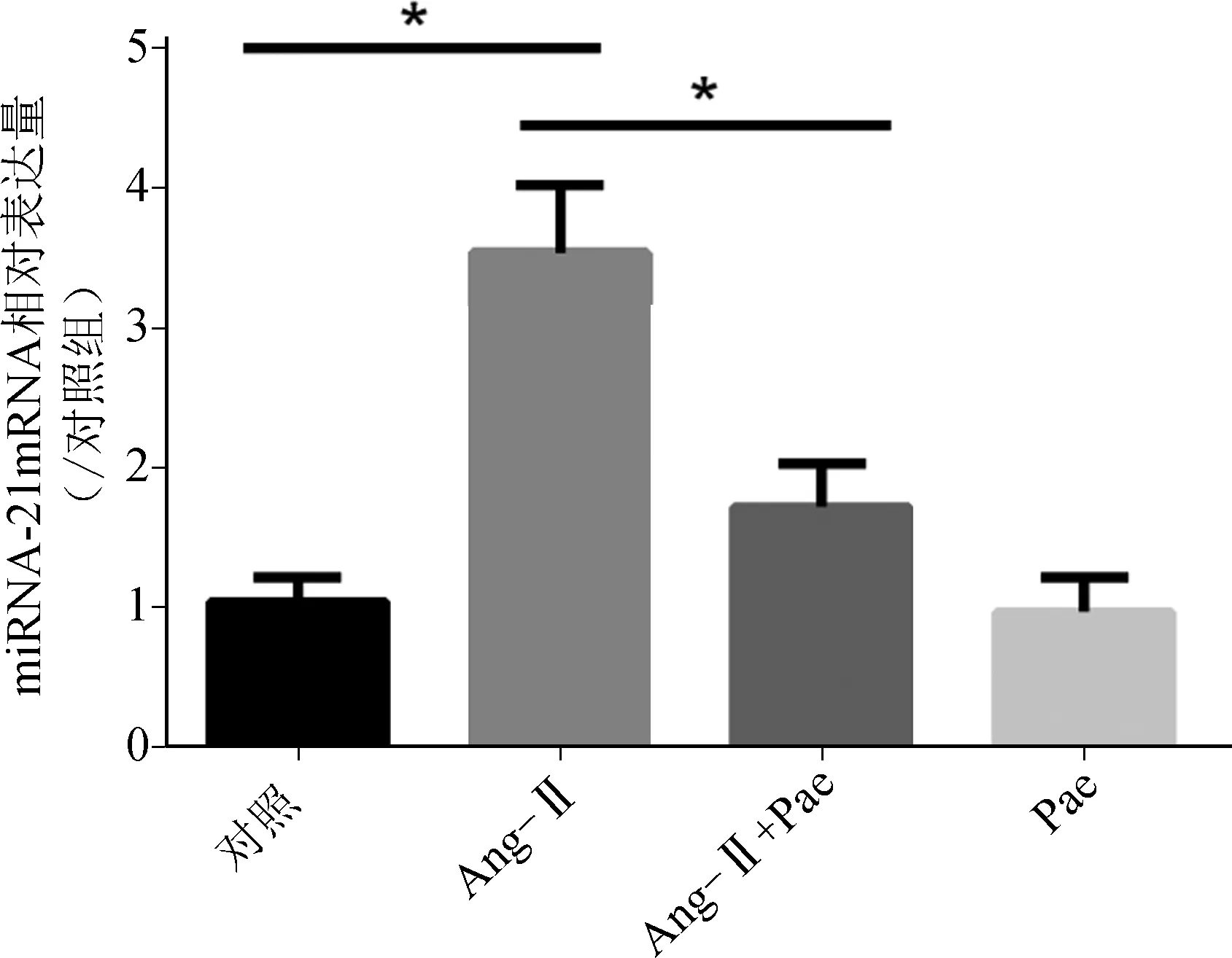
*P<0.05
图2各组心肌细胞miR-21相对表达量
2.3 miR- 21介导Pae抵抗心肌细胞肥大的作用
结果显示,与Ang- Ⅱ组相比,Pae预处理能显著抑制心肌细胞相对表面积的增加,下调肥厚性标志基因ANF及BNP表达 (P<0.05) (图3A、B、C),miR- 21 mimic 转染后显著削弱了Pae对Ang- Ⅱ诱导的细胞表面积及ANP、BNP表达增加的抑制作用(P<0.05) (图3D),提示miR- 21介导了Pae对心肌细胞的保护作用。
2.4 miR- 21直接靶向Smad7介导Pae对心肌细胞肥大的抵抗作用
生物信息学(http://www.targetscan.org)预测分析显示,Smad7 mRNA的3′- UTR存在miRNA- 21的结合序列(图4A)。荧光素酶检测显示与miR- NC阴性对照相比,miRNA- 21过表达抑制Smad7 mRNA的3′- UTR载体的相对荧光素酶活性。而对Smad7的该序列进行突变(Mut)后这种抑制作用消失,证实miR- 21能靶向作用于Smad7 (图4B)。
进一步检测发现,与对照组相比,Ang- Ⅱ作用下伴随着miR- 21表达的升高,心肌细胞Smad7 mRNA及蛋白表达显著下降,Pae预处理可部分抵消该效应,而miR- 21 mimic转染则削弱了Pae对Smad7表达的调控作用,提示Pae对Ang- Ⅱ诱导的心肌细胞肥大的抵抗作用可能是通过调控miR- 21表达,影响靶分子Smad7表达水平实现的(图4C)。
2.5 Smad7调控Pae对心肌细胞肥大的抵抗作用
进一步分析Smad7在Pae抵抗Ang- Ⅱ诱导的心肌细胞肥大中的作用,结果如图5所示,Pae能显著增加Smad7蛋白表达(P<0.05)(图5A),Smad7 siRNA转染后显著减弱了Pae对Ang- Ⅱ诱导的心肌细胞表面积及ANP、BNP mRNA及蛋白表达的降低,逆转了Pae对Ang- Ⅱ诱导的心肌细胞肥厚的抵抗性保护作用(P<0.05) (图5B、C、D),提示Smad7在Pae对抗心肌细胞肥厚中具有一定的调控作用。

A.各组心肌细胞相对表面积;B.ANP、BNP蛋白相对表达量;C.ANP、BNP mRNA相对表达量;D.miR- 21相对表达量(*P<0.05)
图3miR-21介导Pae抵抗心肌细胞肥大的作用
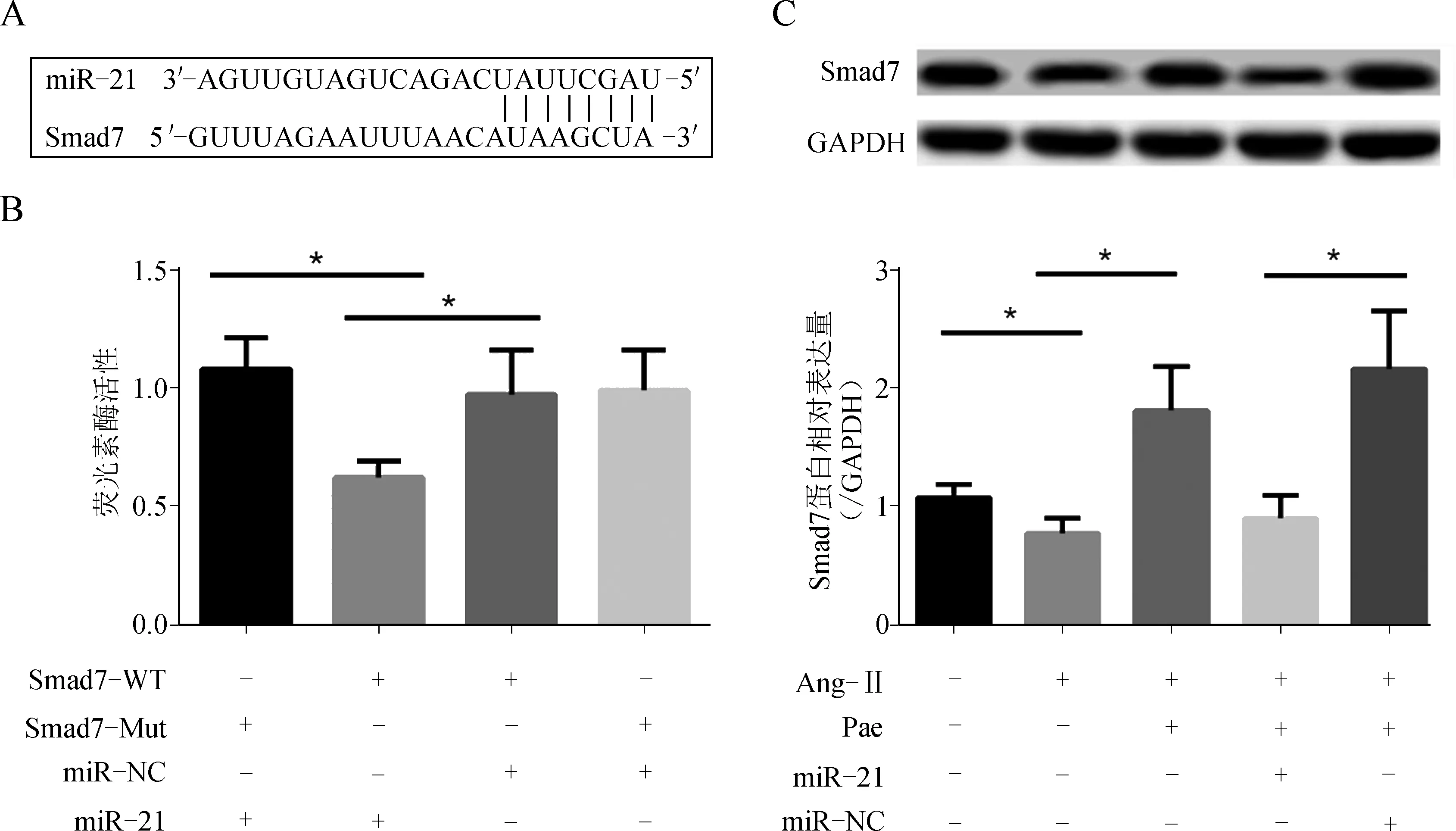
A、B.miR- 21与Smad7靶向关系;C.心肌细胞Smad7蛋白表达的变化(*P<0.05)
图4miR-21靶向Smad7介导Pae对心肌细胞肥大的抵抗作用

A.各组心肌细胞Smad7蛋白表达的变化;B.各组心肌细胞相对表面积;C、D.ANP、BNP 蛋白及mRNA相对表达量(*P<0.05)
图5Smad7调控Pae对心肌细胞肥大的抵抗作用
3 讨 论
心肌肥大是心脏在各种病理因素刺激下通过增加室壁厚度来增加室壁张力的代偿性反应,早期心肌肥厚有利于维持心脏的正常功能,然而持续性心肌肥厚会导致心力衰竭及突发性死亡。临床数据显示约1/3确诊的心衰病人会在1年内死亡,心衰往往由心肌肥厚发展而来,因此对心肌肥厚机制的研究以及寻找预防和治疗心肌肥厚的药物具有重要意义[7]。Pae是从中草药毛莨科植物芍药的根茎中提取的一种单萜类糖苷化合物,具有抗氧化、抗炎、抗凝血、解痉镇痛及免疫调节等作用[8]。对心血管疾病的预防与治疗发挥着重要作用,能够减轻缺血缺氧造成的心肌损伤,抑制梗死后心室重塑,通过抑制还原型辅酶Ⅱ(NAPDH)氧化酶的活性抑制心肌细胞凋亡[9]。此外,Pae还能够抑制持续性压力负荷下心脏病大鼠心肌收缩功能的下降和心肌壁厚度的增加[10]。本次研究显示,Pae能有效逆转Ang- Ⅱ诱导的心肌细胞表面积的增加以及心肌肥厚标志物ANP、BNP的表达,通过负性调控miR- 21解除对Smad7表达的抑制而发挥对心肌的保护作用。
MiR- 21是一种在进化上高度保守的单基因编码的miRNA,广泛表达于心脏、脾脏、小肠等器官,在心肌细胞的分化生长及心肌肥厚中发挥重要的调节作用[11]。既往研究证实miR- 21 抑制不仅能够减缓心肌肥厚的进展,同时可以逆转压力负荷下的心室重构[12]。此外,miR- 21过表达能够靶向作用于信号通路特异性抑制蛋白(Spry)2,诱导心肌细胞间特异性细丝状缝隙连接的生成,参与促进心肌细胞肥厚及心室重构过程的进展[13]。与上述研究一致,本次研究发现Ang- Ⅱ诱导的心肌肥厚细胞miR- 21表达显著增加,Pae可以通过降低miR- 21表达发挥一定的抗心肌细胞肥大的作用。心肌肥厚的进行性加重可导致心肌纤维化,继而促进心肌肥厚进展,内皮—间叶组织转化是心脏纤维化的主要来源,研究指出miR- 21通过PTEN/AKT通路参与TGF- β1介导的上皮间质化(EMT)过程[14]。这些研究进一步佐证miR- 21可增强EMT过程,增加心脏成纤维细胞数量,加重心肌细胞肥厚、心脏重塑及心力衰竭。
Smad7是Smad家族的一个重要的抑制性成员,不仅能直接与活化的TGF- β1受体结合,抑制Smad3的磷酸化,还能在细胞内竞争性结合Smad3,阻断TGF- β1信号通路传导,报道指出Pae能通过调节心脏、肺脏及肾脏TGF- β1/Smad信号通路发挥一定的抗炎、抗氧化、抗纤维化的保护性作用[15]。本次研究显示,心肌细胞经Ang- Ⅱ处理后,miR- 21表达增加,伴随Smad7表达的降低。Pae处理能逆转Ang- Ⅱ处理后心肌细胞miR- 21表达的增加,增加Smad7表达,通过减弱miR- 21对Smad7的抑制,降低心肌肥厚细胞表面积及肥厚性标志ANP、BNP的表达,对心肌细胞肥厚的进展发挥明显的抑制作用。
本次研究发现,Ang- Ⅱ诱导的肥厚性心肌细胞中miR- 21表达显著增加,Pae能够通过抑制miR- 21表达进而降低其对靶蛋白Smad7的抑制作用,降低心肌细胞表面积及心肌肥厚性标志物ANP、BNP的相对表达量,发挥对心肌的保护性作用。本研究明确了miR- 21/Smad7在Pae抵抗心肌细胞肥大过程中的作用,加深了对Pae在抵抗心肌肥厚研究方面的认识,同时为中医药在治疗心血管疾病方面对miRs调控机制的深入研究提供了新的方向和理论支持。
[参考文献]
[1] BELL D,CAMPBELL M,WANG X,et al.Adrenomedullin gene delivery is cardio- protective in a model of chronic nitric oxide deficiency combining pressure overload, oxidative stress and cardiomyocyte hypertrophy[J].Cell Physiol Biochem, 2010,26(3):383- 394.
[2] 于迎根,彭颖秀,史咏秋.慢性心衰患者心率减速力与室性心律失常的相关性研究[J].现代医学,2016,44(8):1074- 1076.
[3] ZHAI J,GUO Y.Paeoniflorin attenuates cardiac dysfunction in endotoxemic mice via the inhibition of nuclear factor- kappaB[J].Biomed Pharmacother,2016,80:200- 206.
[4] HAN F,ZHOU D,YIN X,et al.Paeoniflorin protects diabetic mice against myocardial ischemic injury via the transient receptor potential vanilloid 1/calcitonin gene- related peptide pathway[J].Cell Biosci,2016,6:37- 40.
[5] YAN M,CHEN C,GONG W,et al.miR- 21- 3p regulates cardiac hypertrophic response by targeting histone deacetylase- 8[J].Cardiovasc Res,2015,105(3):340- 352.
[6] BANG C,BATKAI S,DANGWAL S,et al.Cardiac fibroblast- derived microRNA passenger strand- enriched exosomes mediate cardiomyocyte hypertrophy[J].J Clin Invest,2014,124(5):2136- 2146.
[7] MOSTERD A,HOES A W.Clinical epidemiology of heart failure[J].Heart,2007, 93(9):1137- 1146.
[8] 郑世存,李晓宇,欧阳兵,等.芍药苷药理作用研究新进展[J].中国药物警戒, 2012(2):100- 103.
[9] QIAN G Q,DING J,ZHANG X,et al.Preconditioning with glycyrrhizic, ferulic, paeoniflorin, cinnamic prevents rat hearts from ischemia/reperfusion injury via endothelial nitric oxide pathway[J].Pharmacogn Mag,2015,11(42):292- 296.
[10] ZHOU H,YANG H X,YUAN Y,et al.Paeoniflorin attenuates pressure overload- induced cardiac remodeling via inhibition of TGFbeta/Smads and NF- kappaB pathways[J].J Mol Histol,2013,44(3):357- 367.
[11] OLIVEIRA- CARVALHO V,CARVALHO V O,SILVA M M,et al. MicroRNAs:a new paradigm in the treatment and diagnosis of heart failure? [J].Arq Bras Cardiol, 2012,98(4):362- 369.
[12] THUM T,GROSS C,FIEDLER J,et al.MicroRNA- 21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008, 456(7224):980- 984.
[13] SAYED D,RANE S,LYPOWY J,et al.MicroRNA- 21 targets Sprouty2 and promotes cellular outgrowths[J].Mol Biol Cell,2008,19(8):3272- 3282.
[14] BRONNUM H,ANDERSEN D C,SCHNEIDER M,et al.miR- 21 promotes fibrogenic epithelial- to- mesenchymal transition of epicardial mesothelial cells involving. Programmed Cell Death 4 and Sprouty- 1[J].PLoS One, 2013,8(2):e56280.
[15] JI Y,DOU Y N,ZHAO Q W,et al.Paeoniflorin suppresses TGF- beta mediated epithelial- mesenchymal transition in pulmonary fibrosis through a Smad- dependent pathway[J]. Acta Pharmacol Sin,2016,37(6):794- 804.
