siRNA沉默FoxO1对STZ诱导的糖尿病大鼠视网膜IL- 1β的影响及其作用机制
2018-05-23廖洪霞魏艳丽朱晓燕叶剑周琦吕红彬
廖洪霞,魏艳丽,朱晓燕,叶剑,周琦,吕红彬
(1.第三军医大学大坪医院野战外科研究所 眼科,重庆 400042; 2.西南医科大学附属医院 眼科,四川 泸州 646000)
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病(diabetes mellitus, DM)最常见的并发症之一,也是工业化国家人民致盲的首要病因[1- 2]。尽管激光光凝、玻璃体切除术等眼科治疗技术明显改善了患者的预后,但是血糖精准控制的难度、部分患者对治疗不敏感等原因导致DR患者数量依然居高不下。因此,探讨DR的发生机制对提高治疗效果、改善患者预后具有重要意义。白细胞介素- 1β(interleukin- 1β, IL- 1β)参与早期的炎症反应,并调节细胞的凋亡、变性等过程。有研究[3]显示,DR大鼠模型的血浆、玻璃体和视网膜IL- 1β表达明显增加,IL- 1β持续升高又会反馈性诱导视网膜炎症扩大。叉头状转录因子O1(forkhead transcription factor O1, FoxO1)是叉头状转录因子O家族蛋白中最早被发现的成员,既往研究[4]称DM大鼠视网膜组织中FoxO1表达增加,且FoxO1表达与炎症反应和凋亡的增加呈正相关。但是在DR的发生和进展中,FoxO1、IL- 1β之间的调控机制依然不清楚。本研究利用小干扰RNA(small interfering RNA, siRNA)技术干扰DM大鼠视网膜和人视网膜血管内皮细胞中的FoxO1表达,旨在探讨FoxO1对IL- 1β的影响及可能的调控机制,现将研究成果报道如下。
1 材料与方法
1.1 细胞与动物来源
原代人视网膜微血管内皮细胞(HRCECs)购自美国菌种保藏中心(ATCC),细胞加入内皮细胞生长完全培养基,培养箱中37 ℃、5%CO2培养,隔日更换1次培养基。
60只SPF级Sprague- Dawley大鼠购自第三军医大学实验动物中心,大鼠8周龄,均为雄性,体重(200±20)g。大鼠于12 h光照/12 h黑暗条件下饲养,适应性喂养1周后开始实验。本研究大鼠的使用、喂养和操作均严格遵守科技部《关于善待实验动物的指导性意见》的相关要求。
1.2 实验试剂
内皮细胞生长完全培养基(Gibco公司,美国),链脲佐菌素(STZ,Sigma公司,美国),SYBR Green master mix(Exiqon公司,丹麦),BCA蛋白定量试剂盒(北京中杉金桥生物技术有限公司),FoxO1 miRNA慢病毒载体及阴性对照组(si- FoxO1,上海吉凯基因化学技术有限公司),胰蛋白酶(北京索莱宝科技有限公司),Total RNA提取试剂(日本TaKaRa公司),PCR引物(上海生工生物工程有限公司),辣根过氧化物酶标记的二抗(Earthox公司,美国),4,6- 二脒基- 2- 苯基吲哚(DAPI,罗氏公司,瑞士),鼠抗大鼠GAPDH抗体(Sigma公司,美国),鼠抗人IL- 1β抗体(Sigma公司,美国),鼠抗人P38、p- P38抗体(Cell Signaling Technology公司,美国),鼠抗人JNK、p- JNK抗体(Cell Signaling Technology公司,美国),鼠抗人ERK、p- ERK抗体(Cell Signaling Technology公司,美国),鼠抗人FoxO1抗体(Sigma公司,美国)。
1.3 实验仪器
流式细胞仪(BD公司,美国),倒置荧光显微镜(奥林巴斯公司,日本),Real time- PCR仪(ABI公司,美国),电泳仪(北京市六一仪器厂)。
1.4 实验方法
1.4.1 细胞分组与处理 本研究前期委托上海吉凯基因化学技术有限公司合成si- FoxO1及相应的阴性对照(NC- FoxO1),并构建至pGLV3- GFP慢病毒穿梭质粒中,si- FoxO1序列为5′- TCTGTCCGTACACAGVAAG- 3′,NC- FoxO1序列为5′- TTCTCGGAAGCTGTCACGT- 3′。HRCECs按照处理方式分为空白对照组(Mock组)、阴性对照组(NC- FoxO1组)和si- FoxO1组(si- FoxO1组)3组。取对数生长期的HRCECs细胞,以1×104个·孔-1接种于96孔板,用全培养基将转染腺病毒稀释为6×108TU·ml-1,分别向每孔加入100 μl上述稀释病毒,置于CO2培养箱中常规培养,72 h后倒置显微镜下观察GFP的表达情况。取对数生长期细胞接种于6孔板中,待细胞70%融合后分别加入含5、15、25、35 mmol·L-1葡萄糖的培养基继续培养24 h,采用RT- PCR和Western blot检测各组细胞FoxO1、IL- 1β表达。
1.4.2 DM大鼠分组及模型建立 60只大鼠随机分为对照组(Control组)、DM组、si- FoxO1转染组(LV- si- FoxO1组)和空病毒转染组(LV- NC组)4组,每组15只。DM组、LV- si- FoxO1组、LV- NC组建立DM大鼠模型。造模前大鼠禁食12 h,自由饮水,分别向大鼠腹腔注射60 mg·kg-11%STZ溶液,Control组大鼠注射等体积生理盐水,72 h后取尾静脉血检测血糖,以连续3次尾部血糖≥16.7 mmol·L-1作为DM大鼠成模标准。造模成功后腹腔注射戊巴比妥钠3 ml·kg-1麻醉大鼠,滴加托比卡胺滴眼液扩瞳,用29 G针头抽取10 μl 慢病毒载体溶液(Control组、DM组不注射,LV- si- FoxO1组注射si- FoxO1溶液,LV- NC组注射空载体病毒溶液),以45°从角巩膜缘进针,注射完毕后局部涂抹左氧氟沙星预防感染。
1.4.3 标本采集 腺病毒注射12周后腹腔注射戊巴比妥钠3 ml·kg-1麻醉,完全麻醉后仰卧位固定于动物实验台。将大鼠眼球完整剥离后分为两部分,一部分用4%多聚甲醛固定48 h,梯度乙醇洗脱,石蜡包埋,用于免疫组化染色。另外一部分新鲜眼球组织用手术剪剪成2 mm×2 mm小块状后立即置于液氮保存,用于后续RT- PCR和Western blot检测。
1.4.4 免疫组织化学染色检测样本FoxO1、IL- 1β表达 取组织切片,脱蜡和水化后PBS冲洗3次,高压锅水浴法修复组织抗原,滴加3%H2O2室温孵育10 min,消除内源性过氧化物酶,PBS冲洗3次。滴加100 μl FoxO1或IL- 1β抗体,4 ℃孵育过夜,第2天PBS冲洗3次,再滴加1~2滴二抗,室温孵育40 min,PBS冲洗后滴加DAB染液,苏木精复染,HCl分化,自来水反复冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封固,镜下观察。PBS代替一抗作为阴性对照。
1.4.5 RT- PCR检测FoxO1、IL- 1β mRNA表达 取处理后的细胞,弃去培养基,加入胰蛋白酶消化,PBS冲洗,加入1 ml Total RNA提取试剂提取总RNA。取40 mg 眼球组织置于EP管中,加入Total RNA提取试剂振荡提取总RNA。按照逆转录反应试剂说明书将总RNA逆转录为cDNA。以cDNA为模板进行PCR扩增,FoxO1上游为5′- GGCTGAGGGTTAGTGAGCA- 3′,下游为5′- AGGGAGTTGGTGAAAGACATC- 3′;IL- 1β上游为5′- AGGGCAGAATCATGAGCAAGT- 3′,下游为5′- AGGGTCTGCATTGGATGGCA- 3′;GAPDH上游为5′- CACCATTGGCAATGAGGGGTTC- 3′,下游为5′- AGGTCTTTGCGGATGTCCACGT- 3′。PCR反应条件:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,总计40个循环。定量分析结果以Ct值表示,以GAPDH作为内参,2-ΔΔCt计算目的基因相对表达量。
1.4.6 Western blot检测FoxO1、IL- 1β、p- P38、p- JNK、p- ERK蛋白表达 收集对数生长期细胞,或将眼球组织切片研磨粉碎,加入1 ml RIPA裂解液提取总蛋白,BCA蛋白浓度试剂盒检测蛋白纯度。将50 μg蛋白提取液置于10% SDS- PAGE电泳分离,常规湿法转膜,加入5%脱脂牛奶孵育封闭2 h。分别加入相应一抗:FoxO1(1∶200)、IL- 1β(1∶200)、P38(1∶100)、p- P38(1∶100)、JNK(1∶500)、p- JNK(1∶500)、ERK(1∶200)、p- ERK(1∶200)、GAPDH(1∶100),4 ℃孵育24 h。再滴加二抗37 ℃孵育2 h。PBS冲洗3次,用ECL化学发光显影试剂盒显影,以GAPDH作为内参照,扫描目的条带和内参条带,使用Image J软件对条带进行分析,计算目的条带相对表达量。
1.5 统计学处理
采用SPSS 19.0软件和GraphPad Prism 7.0软件对数据进行处理,计量资料用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 高糖环境诱导HRCECs FoxO1、IL- 1β表达增加
与5 mmol·L-1葡萄糖浓度组比较,15 mmol·L-1浓度组FoxO1、IL- 1β mRNA和蛋白表达差异无统计学意义(P>0.05),25 mmol·L-1浓度组FoxO1、IL- 1β mRNA和蛋白表达明显高于5 mmol·L-1浓度组,而35 mmol·L-1浓度组FoxO1、IL- 1β mRNA和蛋白表达增加的更明显,组间比较差异具有统计学意义(P<0.05),说明葡萄糖以浓度依赖性的方式诱导HRCECs FoxO1、IL- 1β表达增加,见图1。
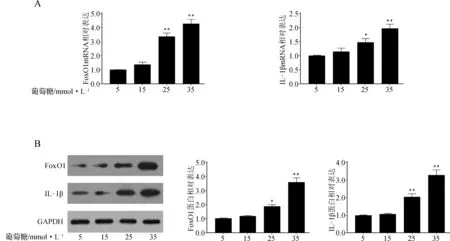
与5 mmol·L-1浓度组比较,*P<0.05,**P<0.05
A.RT- PCR检测HRMECs FoxO1、IL- 1β mRNA表达;B.Western blot检测HRMECs FoxO1、IL- 1β蛋白表达
图1高糖诱导HRCECsFoxO1、IL-1β表达
2.2 si- FoxO1抑制HRCECs IL- 1β表达
NC- FoxO1、si- FoxO1转染72 h后倒置荧光显微镜下观察,NC- FoxO1、si- FoxO1组可见大量GFP表达,而Mock组仅见少量GFP表达(图2A),说明慢病毒载体呈稳定、高效转染。RT- PCR和Western blot检测结果显示,si- FoxO1组FoxO1 mRNA和蛋白表达明显低于NC- FoxO1组和Mock组(P<0.05),证实si- FoxO1转染细胞模型建立成功。与NC- FoxO1组比较,si- FoxO1组IL- 1β mRNA和蛋白表达明显降低(P<0.05),NC- FoxO1组和Mock组IL- 1β mRNA和蛋白表达比较差异无统计学意义(P>0.05)。见图2B~C。
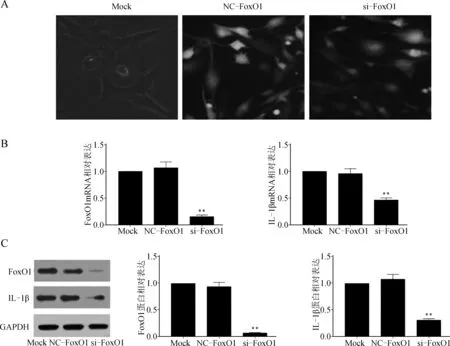
与NC- FoxO1组比较,**P<0.05
A.倒置荧光显微镜观察转染后细胞GFP表达;B.RT- PCR检测转染后细胞FoxO1、IL- 1β mRNA表达;C.Western blot检测转染后细胞FoxO1、IL- 1β蛋白表达
图2si-FoxO1慢病毒转染后对FoxO1、IL-1β表达的影响
2.3 免疫组化染色检测大鼠视网膜FoxO1、IL- 1β表达
免疫组化染色结果显示,DM组大鼠FoxO1阳性染色主要分布于神经节细胞层、内网状层,IL- 1β阳性染色细胞分布于视网膜全层。与Control组和LV- si- FoxO1组比较,DM、LV- NC组FoxO1、IL- 1β表达明显增加(P<0.05);LV- NC组与Control组FoxO1、IL- 1β表达差异无统计学意义(P>0.05),DM组和LV- NC组FoxO1、IL- 1β表达差异无统计学意义(P>0.05)。见图3。
2.4 si- FoxO1抑制大鼠视网膜IL- 1β表达
DM组和LV- NC组FoxO1、IL- 1β mRNA和蛋白表达明显高于Control组和LV- si- FoxO1组(P<0.05),LV- NC组与Control组FoxO1、IL- 1β表达差异无统计学意义(P>0.05),DM组和LV- NC组FoxO1、IL- 1β表达差异无统计学意义(P>0.05)。见图4。
2.5 FoxO1通过MARK信号通路调节IL- 1β表达
si- FoxO1组p- P38、p- JNK、p- ERK蛋白表达明显低于NC- FoxO1组和Mock组(P<0.05),NC- FoxO1组和Mock组p- P38、p- JNK、p- ERK蛋白表达比较差异无统计学意义(P>0.05)。见图5。

图3免疫组化染色检测大鼠视网膜FoxO1、IL-1β表达×200

与Control组比较,**P<0.05;与LV- NC组比较,##P<0.05
A.RT- PCR检测大鼠视网膜FoxO1、IL- 1β mRNA表达;B.Western blot检测大鼠视网膜FoxO1、IL- 1β蛋白表达
图4si-FoxO1抑制大鼠视网膜IL-1β表达
3 讨 论
DR是DM最常见的微血管并发症,目前研究[5- 6]证实黏附分子、炎症因子和趋化因子等与DR的发病和进展密切相关。在DM患者和DR大鼠模型的视网膜、玻璃体及血浆中,促炎因子IL- 1β及下游靶基因Caspase- 1表达明显上调[7],提示IL- 1β可能参与了DR的发病。本研究显示葡萄糖以浓度依赖性的方式诱导HRCECs IL- 1β表达增加,提示高血糖能够诱导IL- 1β表达升高,进而参与视网膜病变的进程。与TNF- α不同,IL- 1β虽然不能杀死细胞,但是可以诱导细胞凋亡[8]。有研究[9]显示,向大鼠玻璃体内注射IL- 1β可以引起视网膜微血管细胞凋亡,导致视网膜出现组织病理改变。FoxO1可以调节多种细胞分化、增殖、自噬和氧化应激,也是DR早期炎症激活的主要诱导因素。Battiprolu等[10]报道称1型和2型DM大鼠视网膜中FoxO1活性增加,同时伴有炎症反应增强和视网膜细胞凋亡增加。本研究在体外实验中发现,随着葡萄糖浓度升高HRMECs FoxO1表达逐渐增加,说明高血糖环境也可以激活FoxO1的活性。
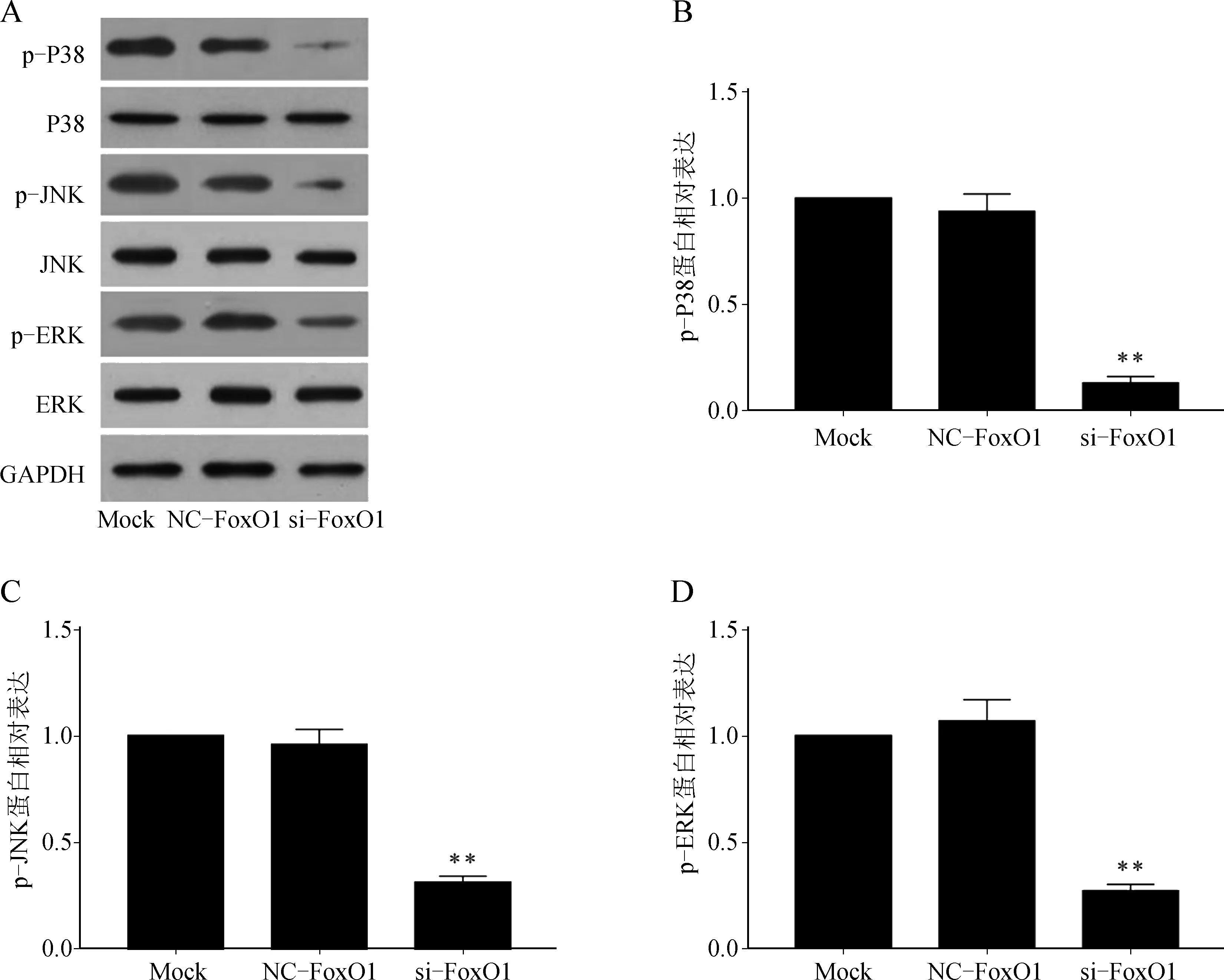
与NC- FoxO1组比较,**P<0.05
A.Western blot检测转染后细胞MAPK通路相关蛋白电泳图;B.Western blot检测转染后细胞p- P38蛋白表达;C.Western blot检测转染后细胞p- JNK蛋白表达;D.Western blot检测转染后细胞p- ERK蛋白表达
图5si-FoxO1慢病毒转染后对MAPK通路相关蛋白表达的影响
既往有报道[11]证实FoxO1可以调控IL- 1β表达,但是在视网膜内皮细胞中是否存在相似情况依然未见报道。本研究利用siRNA技术干扰HRMECs FoxO1表达,结果显示si- FoxO1组IL- 1β mRNA和蛋白表达明显低于NC- FoxO1组和Mock组,说明抑制FoxO1可以降低视网膜内皮细胞IL- 1β表达,从而降低视网膜微血管炎症反应。Wang等[12]也证实,FoxO1与靶基因的辅阻遏物或共活化剂直接结合调节IL- 1β的转录。国外一项最新研究[13]显示,FoxO1与IL- 1β启动子结合促进IL- 1β受体表达增加和炎症反应的放大。另外一项研究[14]称,在大鼠肝细胞中IL- 1β与相应的受体结合诱导细胞质和细胞核内FoxO1过表达,提示FoxO1调控IL- 1β表达可能起到类似正反馈的作用。本研究进一步建立DM大鼠模型,通过动物模型验证FoxO1在体内对IL- 1β的调控作用。首先根据Huang等[15]报道的方法,向DM大鼠模型的玻璃体腔注射LV- si- FoxO1下调FoxO1的表达,免疫组化显示FoxO1阳性染色主要分布于神经节细胞层、内网状层,IL- 1β阳性染色细胞分布于视网膜全层,这与Xu等[16]报道结论一致。RT- PCR和Western blot检测结果显示,LV- si- FoxO1组FoxO1、IL- 1β mRNA和蛋白表达明显低于DM组和LV- NC组,说明在DM大鼠视网膜中FoxO1亦参与了IL- 1β的表达。
虽然通过体外和体内实验均证实了抑制FoxO1可以下调IL- 1β的表达,但是FoxO1调控IL- 1β的机制依然少见报道。丝裂素活化蛋白激酶(MAPK)[17]属于丝蛋白/苏氨酸激酶,也是调控基因表达、细胞增殖和凋亡的重要信号通路。P38、JNK、ERK是MAPK家族重要成员,其中P38、JNK可被氧化应激、高糖环境等诱导活化,而ERK则主要参与细胞的凋亡。李永浩等[18]证实MAPK、晚期糖基化终末产物均参与了DM视网膜血管功能的损伤。刁雪红等[19]对2型DM小鼠模型动脉内皮细胞进行研究,结果显示模型组、阴性对照组P38、JNK、ERK蛋白表达差异无统计学意义,但是模型组p- P38、p- JNK、p- ERK蛋白表达明显高于阴性对照组,提示MAPK磷酸化改变参与了DM所致血管内皮功能失调。本研究显示si- FoxO1组p- P38、p- JNK、p- ERK蛋白表达明显低于NC- FoxO1组和Mock组,提示抑制FoxO1表达可能是通过降低MAPK磷酸化下调IL- 1β表达。Khan等[20]报道称,高糖干预视网膜内皮细胞,MAPK信号通路的关键蛋白(P38、JNK、ERK)磷酸化表达增加,抑制MAPK信号通路可以抑制DR和其他DM并发症的早期病变。
综上所述,高糖能够诱导HRCECs FoxO1、IL- 1β表达增加,抑制FoxO1表达可能是通过降低MAPK磷酸化下调IL- 1β表达,FoxO1有望成为DR治疗的潜在分子靶点之一。
[参考文献]
[1] WELIKALA R A,DEHMESHKI J,HOPPE A,et al.Automated detection of proliferative diabetic retinopathy using a modified line operator and dual classification[J].Comput Methods Programs Biomed,2014,114(3):247- 261.
[2] MCANANY J J,WANEK J,ZELKHA R,et al.Neural constraints on visual acuity in proliferative diabetic retinopathy[J].Optom Vis Sci,2014,91(2):194- 199.
[3] SCUDERI S,D′AMICO A G,FEDERICO C,et al.Different retinal expression patterns of IL- 1α,IL- 1β,and their receptors in a rat model of type 1 STZ- induced diabetes[J].J Mol Neurosci,2015,56(2):431- 439.
[4] BEHL Y,KROTHAPALLI P,DESTA T,et al.FOXO1 plays an important role in enhanced microvascular cell apoptosis and microvascular cell loss in type 1 and type 2 diabetic rats[J].Diabetes,2009,58(4):917- 925.
[5] 刘晓静,朱弼珺,邹海东,等.氨甲酰促红细胞生成素防治糖尿病视网膜病变的作用及机制[J].中华实验眼科杂志,2014,32(11):980- 988.
[6] 韩改玲.2型糖尿病患者CTGF及25- 羟维生素D与视网膜病变的相关性[J].现代医学,2016,44(8):1064- 1067.
[7] DAY T E,RAVI N,XIAN H,et al.Sensitivity of diabetic retinopathy associated vision loss to screening interval in an agent- based/discrete event simulation model[J].Comput Biol Med,2014,47:7- 12.
[8] 曹瑞琪,卢新兰,任牡丹,等.盐酸青藤碱诱导人肝癌细胞凋亡及其对IL- 1β,TNF及C/EBPβ水平的影响[J].西安交通大学学报:医学版,2017,38(2):290- 294.
[9] RIVERA J C,SITARAS N,NOUEIHED B,et al.Microglia and interleukin- 1β in ischemic retinopathy elicit microvascular degeneration through neuronal semaphorin- 3A[J].Arterioscler Thromb Vasc Biol,2013,33(8):1881- 1891.
[10] BATTIPROLU P K,HOJAYEV B,JIANG N,et al.Metabolic stress- induced activation of FoxO1 triggers diabetic cardiomyopathy in mice[J].J Clin Invest,2012,122(3):1109- 1118.
[11] 周英旎,王庆祝,秦贵军,等.FoxO1过表达对大鼠糖尿病肾病的影响及机制研究[J].中华内分泌代谢杂志,2015(2):155- 161.
[12] WANG Q,WANG N,DONG M,et al.GdCl3 reduces hyperglycaemia through Akt/FoxO1- induced suppression of hepatic gluconeogenesis in type 2 diabetic mice[J].Clin Sci,2014,127(2):91- 100.
[13] DOBIERZEWSKA A,SHI L,KARAKASHIAN A A,et al.Interleukin 1β regulation of FoxO1 protein content and localization:evidence for a novel ceramide-dependent mechanism[J].J Biol Chem,2012,287(53):44749- 44760.
[14] 李娜娜,任寿安.慢性间歇低氧对大鼠肝细胞IRS- 2、 FoxO1表达的影响[J].国际内分泌代谢杂志,2015,35(1):1- 5.
[15] HUANG W,YU J,JIA X,et al.Zhenqing recipe improves glucose metabolism and insulin sensitivity by repressing hepatic FOXO1 in type 2 diabetic rats[J].Am J Chin Med,2012,40(4):721- 733.
[16] XU F,OTHMAN B,LIM J,et al.Foxo1 inhibits diabetic mucosal wound healing but enhances healing of normoglycemic wounds[J].Diabetes,2015,64(1):243- 256.
[17] CHOU M Y,KAO C T,HUNG C J,et al.Role of the P38 pathway in calcium silicate cement- induced cell viability and angiogenesis- related proteins of human dental pulp cellinvitro[J].J Endod,2014,40(6):818- 824.
[18] 李永浩,吕林,陈凌燕,等.P38丝裂素活化蛋白激酶信号通路阻断对糖尿病鼠早期血视网膜屏障和视网膜节细胞的保护作用[J].中华眼底病杂志,2010,26(2):139- 142.
[19] 刁雪红,申鍔,张跃力,等.抑制Rac1通过降低磷酸化p38 MAPK提高1型糖尿病小鼠的心脏功能[J].中国病理生理杂志,2010,26(7):1285- 1289.
[20] KHAN S,JENA G B.Protective role of sodium butyrate,a HDAC inhibitor on beta- cell proliferation,function and glucose homeostasis through modulation of p38/ERK MAPK and apoptotic pathways:Study in juvenile diabetic rat[J].Chem Biol Interact,2014,213:1- 12.
