单增李斯特菌prsA1基因的截短表达、纯化及多克隆抗体的制备
2018-05-23孙静娟邱景璇曾海娟丁承超王广彬王淑娟
孙静娟, 邱景璇, 曾海娟, 丁承超, 王广彬, 李 杰, 王淑娟, 刘 箐*
1.上海理工大学医疗器械与食品学院, 上海 200093;2.徐州绿健乳品饮料有限公司, 江苏 徐州 221006
单增李斯特菌能在生物体内转变成细胞内的病原体,是常见的四大食源性致病菌之一,一般在健康个体中引起轻度疾病,但是在免疫功能低下者体内,该菌感染易患败血症、脑膜炎、脑脓肿等,甚至可通过孕妇胎盘感染发育中的胎儿,导致死产和流产[1,2]。单增李斯特菌能够粘附在食品加工器械上形成菌膜,进而增加食品污染的可能性[3,4]。同时伴随着抗生素的滥用,单增李斯特菌对抗生素的耐药性增加[5,6],对食品安全构成严重威胁。单增李斯特菌能够在广泛的环境条件下生存,使得其在食品加工企业难以得到控制[7]。但目前,对单增李斯特菌的检测仍缺乏高效快速的检测手段,因此,亟需开发一种快速高效的检测方法。
单增李斯特菌从腐生菌到胞内病原体的转移依赖于分泌性致病因子介导细胞入侵及细胞内增殖[8]。蛋白质在细菌表面的转运是细菌正常生命活动的必需过程,如鞭毛等复杂结构的组装、营养物质的获取、细胞壁的合成与分裂、细菌粘附在环境表面等过程都离不开蛋白质的转运[9]。对革兰氏阳性菌而言,蛋白质的分泌需跨越细胞膜,并在膜-细胞壁界面外部暴露的环境中完成蛋白质折叠[10]。而PrsA作为一种细胞膜上的折叠酶,与多种生理表型有关,包括膜蛋白折叠、致病菌毒力、抗渗透胁迫和极端pH、细胞壁完整性和细菌运动性等[11]。单增李斯特菌有两个已知的PrsA亚型,即PrsA1和PrsA2。PrsA2已被证实是单增李斯特菌维持运动性、抗压力、维持细胞壁完整性和毒力所必需的[12,13]。目前,PrsA1功能研究尚不明确。
利用生物信息学方法从数据库中筛选得到单增李斯特菌prsA1基因具有种内保守、种间特异的特点,另外PrsA1还具有良好的抗原表位,是预测的理想检测靶标。本实验对prsA1进行克隆和截短表达,并以重组蛋白Δ28PrsA1为免疫原制备多克隆抗体,对预测结果进行免疫学验证,旨在为单增李斯特菌检测靶标的筛选和免疫学检测提供实践基础。
1 材料与方法
1.1 主要试剂
单增李斯特菌株(EGD-e)、质粒pET30a、大肠杆菌DH5α由上海理工大学系统生物医学研究中心提供;大肠杆菌BL21(DE3)购自天根生化科技(北京)有限公司;限制性内切酶购自大连宝生物工程有限公司;高保真酶试剂盒(Phanta© Max Super-Fidelity DNA Polymerase)、一步克隆试剂盒(One Step Cloning Kit)购自南京诺唯赞生物科技有限公司;一步法细菌活性蛋白提取试剂盒(One Step Bacterial Active Protein Extraction Kit)、His标签纯化柱(Ni-IDA-Sefinose Column)购自生工生物工程(上海)股份有限公司;琼脂糖割胶回收试剂盒(BioSpin Gel Extraction Kit)、质粒抽提试剂盒(BioSpin Plasmid DNA Extraction Kit)购自杭州博日科技生物有限责任公司。引物由生工生物工程(上海)股份有限公司合成;测序由上海华大基因科技有限公司完成。
1.2 生物信息学预测
运行综合性数据库NCBI上的ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)工具分析prsA1开放阅读框。运行SignalP4.1 Server程序(http://www.cbs.dtu.dk/services/SignalP/)预测PrsA1是否含有信号肽及其剪切位点[14,15]。运行TMHMM Server V.2.0程序(http://www.cbs.dtu.dk/services/ TMHMM-2.0/)预测PrsA1是否为跨膜蛋白及其跨膜区域[16]。运行SEPPA2.0程序预测PrsA1的空间抗原表位[17,18]。
1.3 Δ84prsA1的扩增与克隆
根据NCBI上公布的李斯特菌prsA1(Gene ID: 986457)基因序列(全长885 bp),考虑到跨膜区会阻碍原核表达,根据跨膜区预测结果,运用Primer 3.0设计1对特异性引物F1-R1用于扩增prsA1非跨膜区基因片段,即缺少第1个至第84个核苷酸的基因片段,Δ84prsA1其编码的蛋白为Δ28PrsA1。引物信息如下:F1:5′-ACATGGACAGCCCAGATCTGAAAACAGATGCAGGAAGTGT-3′;R1:5′-TGGTGGTGGTGGTGCTCGAGTTAGTTAGATGTAGTCGTTG-3′(划线部分分别为BglⅡ和XhoⅠ酶切位点)。PCR反应程序为:95℃ 3 min;95℃ 15 s,56℃ 15 s,72℃ 45 s,35个循环;72℃ 5 min。割胶回收PCR产物后连接至pET30a载体上,把重组质粒pET30a-Δ84prsA1导入大肠杆菌DH5α感受态细胞中。提取质粒送测序,将测序正确的质粒导入大肠杆菌BL21(DE3)感受态细胞中,采用菌落PCR鉴定[19]。
1.4 Δ28PrsA1的原核表达与鉴定
将阳性克隆菌落过夜培养,次日,1∶100转接至新培养基(卡那霉素终浓度25 μg/mL)中继续培养至OD600为0.6时,加入IPTG进行诱导表达,终浓度0.1 mmol/L,诱导表达6 h,然后采用一步法细菌活性蛋白提取试剂盒提取可溶性蛋白,用8 mol/L尿素变性包涵体,最后经SDS-PAGE分析Δ28PrsA1表达情况及可溶性。将目的蛋白从胶上切下,送北京华大蛋白质研发中心有限公司进行质谱鉴定[20]。
1.5 Δ28PrsA1的纯化
诱导表达结束后离心收集菌体,PBS重悬后使用超声破碎仪破碎菌体,离心弃上清,6 mol/L盐酸胍处理包涵体,参照Ni-IDA纯化柱说明书纯化重组蛋白Δ28PrsA1,SDS-PAGE电泳分析蛋白纯化效果。
1.6 多克隆抗体的制备及纯化
新西兰大耳兔适应性饲养一周后进行动物免疫[21]。首次免疫时弗氏完全佐剂与纯化的Δ28PrsA1等体积混合,充分乳化后皮下多点免疫。加强免疫时弗氏不完全佐剂与纯化的Δ28PrsA1等体积混合,充分乳化后免疫。每次免疫剂量为1 mg Δ28PrsA1,间隔2周,加强免疫3次。末次免疫一周后,心脏取血,分离血清,饱和硫酸铵沉淀法粗提多克隆抗体,然后利用Protein A亲和层析柱纯化多抗,-20℃冷冻保存。
1.7 多克隆抗体的效价测定
第3次免疫后一周耳边缘取血,采用间接ELISA方法检测兔血清中抗体水平[22],具体操作:以纯化的Δ28PrsA1(3 μg/孔)包被酶标板,3%(m/V)脱脂奶粉封闭,以梯度稀释的兔血清为一抗(1∶1 000~1∶128 000),以HRP标记的山羊抗兔抗体为二抗,TMB显色后加终止液终止显色反应,测定OD450。
1.8 Western blotting法检测单增李斯特菌
按溶菌酶-超声破碎-TCA-丙酮沉淀法提取单增李斯特蛋白[23],经SDS-PAGE电泳并转移至硝酸纤维素膜上,以兔多抗为一抗,以荧光标记的山羊抗兔抗体为二抗,使用双色红外荧光成像系统Odyssey扫描NC膜。Western blotting分析该多克隆抗体与单增李斯特菌提取PrsA1蛋白的结合能力。
2 结果与分析
2.1 PrsA1的信号肽预测
信号肽预测结果显示信号肽分值S的平均值>0.5,表明PrsA1的N端存在信号肽,该信号肽负责将PrsA1靶向细菌表面,属于分泌蛋白,剪切位点处于第26个氨基酸和第27个氨基酸间,如图1(彩图见图版二)、表1所示。
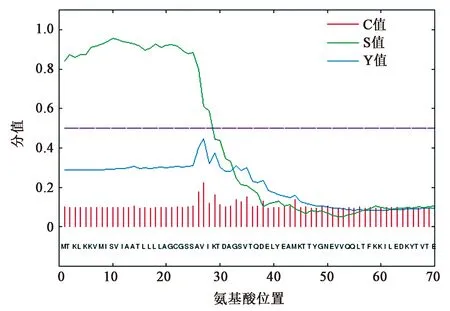
图1 PrsA1的信号肽预测Fig.1 Prediction of PrsA1 signal peptide.(彩图见图版二)

表1 PrsA1信号肽预测的数值信息Table 1 The numerical information of PrsA1 signal peptide prediction.
注:Name=Sequence, SP=“YES”,剪切位点介于pos.26 and 27, SSA-VI D=0.626, D-cutoff=0.450, Networks=SignalP-TM. C值:剪切位点分值;S值:信号肽分值;Y值:综合剪切点分值;D值:辨别率分值。
2.2 PrsA1的跨膜区域预测
跨膜区域预测结果显示PrsA1的N端第7个到第28个氨基酸形成一个跨膜区,如图2(彩图见图版二)、表2所示。跨膜区氨基酸残基主要是疏水性的,并且α螺旋结构规则且不易变形,阻碍蛋白的原核表达,所以设计一对特异性引物扩增PrsA1的非跨膜区,并构建重组质粒用于原核表达。
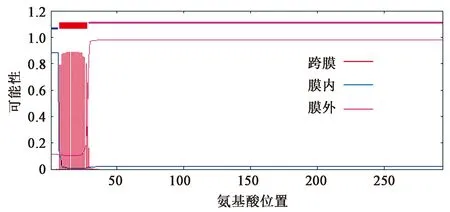
图2 PrsA1的跨膜区预测Fig.2 Prediction of PrsA1 transmembrane region.(彩图见图版二)
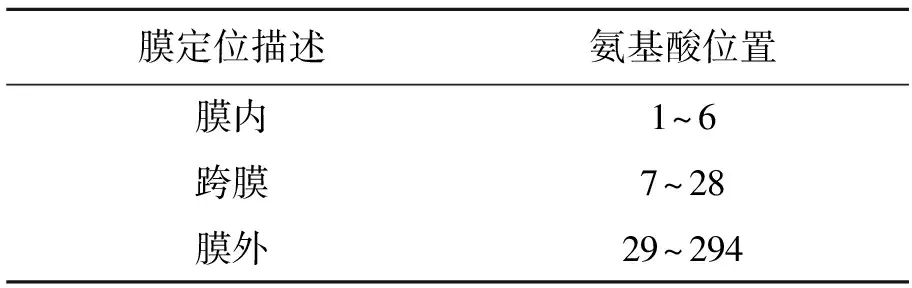
表2 PrsA1跨膜区域预测的数值信息Table 2 The numerical information of PrsA1 transmembrane region prediction.
注:WEBSEQUENCE Number of predicted TMHs: 1。
2.3 PrsA1的空间抗原表位预测
将PrsA1的空间结构信息提交至SEPPA 2.0预测空间抗原表位,0~1表示氨基酸打分阈值,分值越高颜色越红则表示该氨基酸形成抗原表位的可能性越大。如图3(彩图见图版二)所示,红色区域裸露在外侧且分布相对集中,表明PrsA1上存在良好的空间抗原表位。
2.4 Δ84prsA1的扩增与pET30a-Δ84prsA1的PCR鉴定
PCR反应结束后经琼脂糖凝胶电泳检测可见在801 bp左右出现亮白条带,与预期片段大小一致,表明成功获得Δ84prsA1片段,如图4所示。 将测序正确的重组质粒pET30a-Δ84prsA1导入大肠杆菌BL21(DE3)感受态细胞中,菌落PCR鉴定结果如图5所示,在801 bp左右出现条带,表明Δ84prsA1片段已连接至pET30a载体上并成功转化至大肠杆菌中。测序结果与NCBI数据库公布的prsA1序列比对,同源性达到100%。
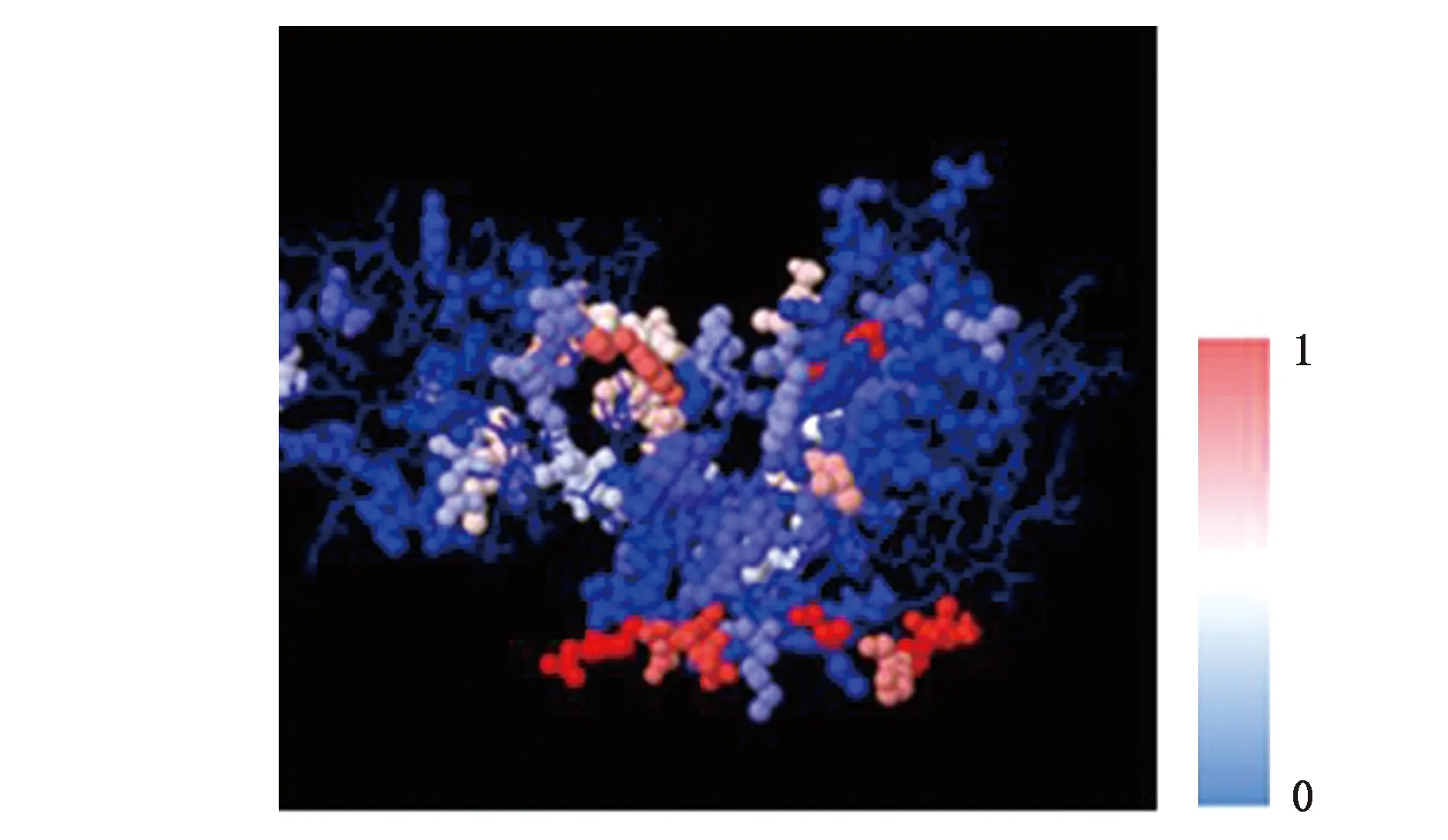
图3 PrsA1的空间抗原表位预测Fig.3 Prediction of PrsA1 spatial epitope.(彩图见图版二)
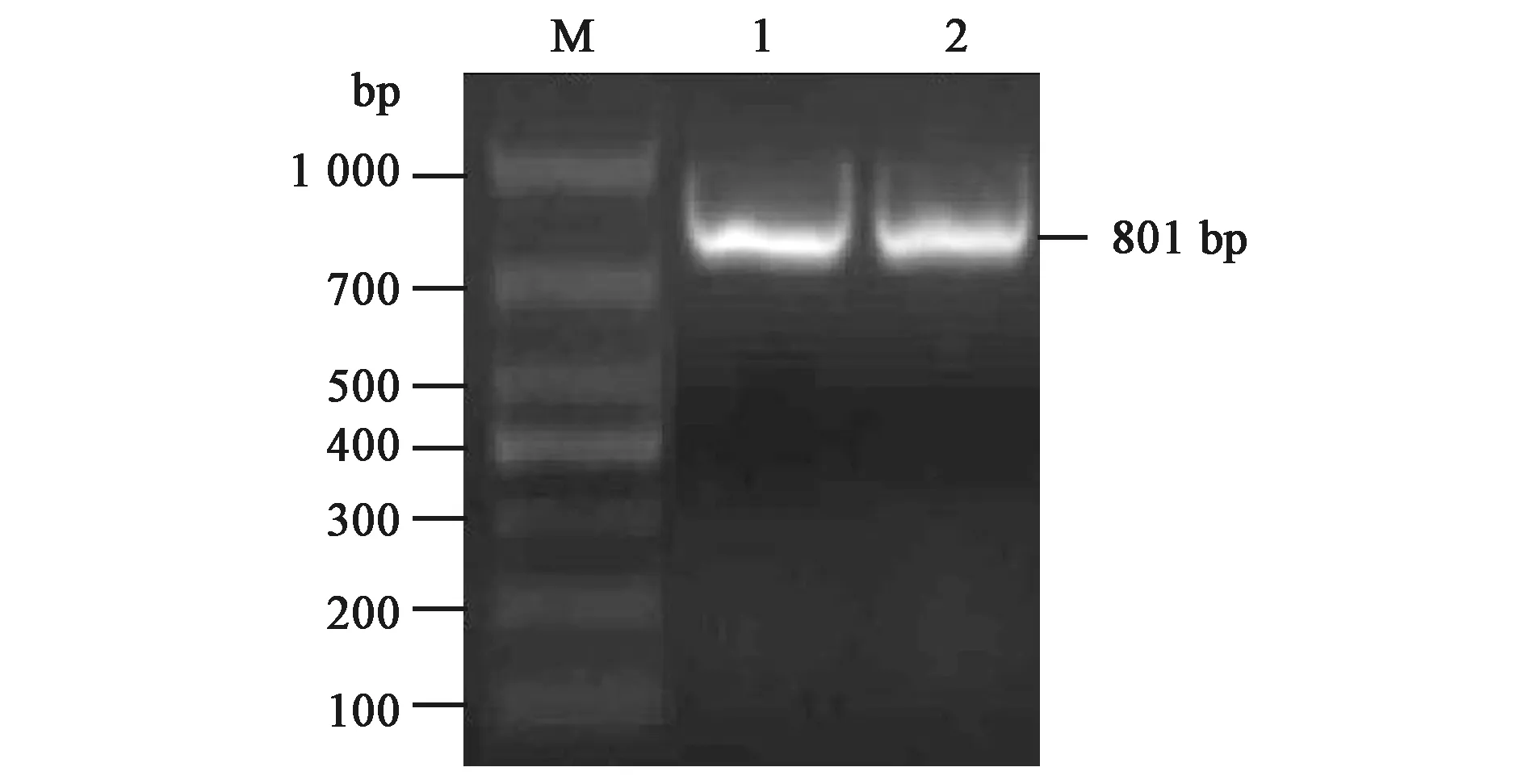
图4 Δ84prsA1片段的扩增Fig.4 Amplification of Δ84prsA1M:DL1000 DNA Marker; 1,2:Δ84PrsA1片段。

图5 pET30a-Δ84prsA1的PCR鉴定Fig.5 Identification of pET30a-Δ84prsA1 by PCR.M. DL1000 DNA Marker; 1. 阴性对照; 2~10. 9个单菌落。
2.5 Δ28PrsA1的原核表达与鉴定
重组质粒pET30a-Δ84prsA1经IPTG诱导可表达出重组蛋白,在33 kDa处有明显条带(Δ28PrsA1的分子量大小为29 kDa。His标签的分子量大小为4 kDa),与预期大小一致。空载体不表达该蛋白,重组质粒不经IPTG诱导不表达该蛋白(泳道5、泳道7所示),泳道6和泳道8分别为诱导表达上清、诱导表达包涵体,可见诱导表达的重组蛋白以包涵体的形式存在,如图6A所示。重组蛋白条带的质谱鉴定结果如图6B所示,数据经Mascot检索分析可知,蛋白匹配度为61%(下划线表示质谱结果能与NCBI中氨基酸序列匹配上的氨基酸),确定其为Δ28PrsA1。
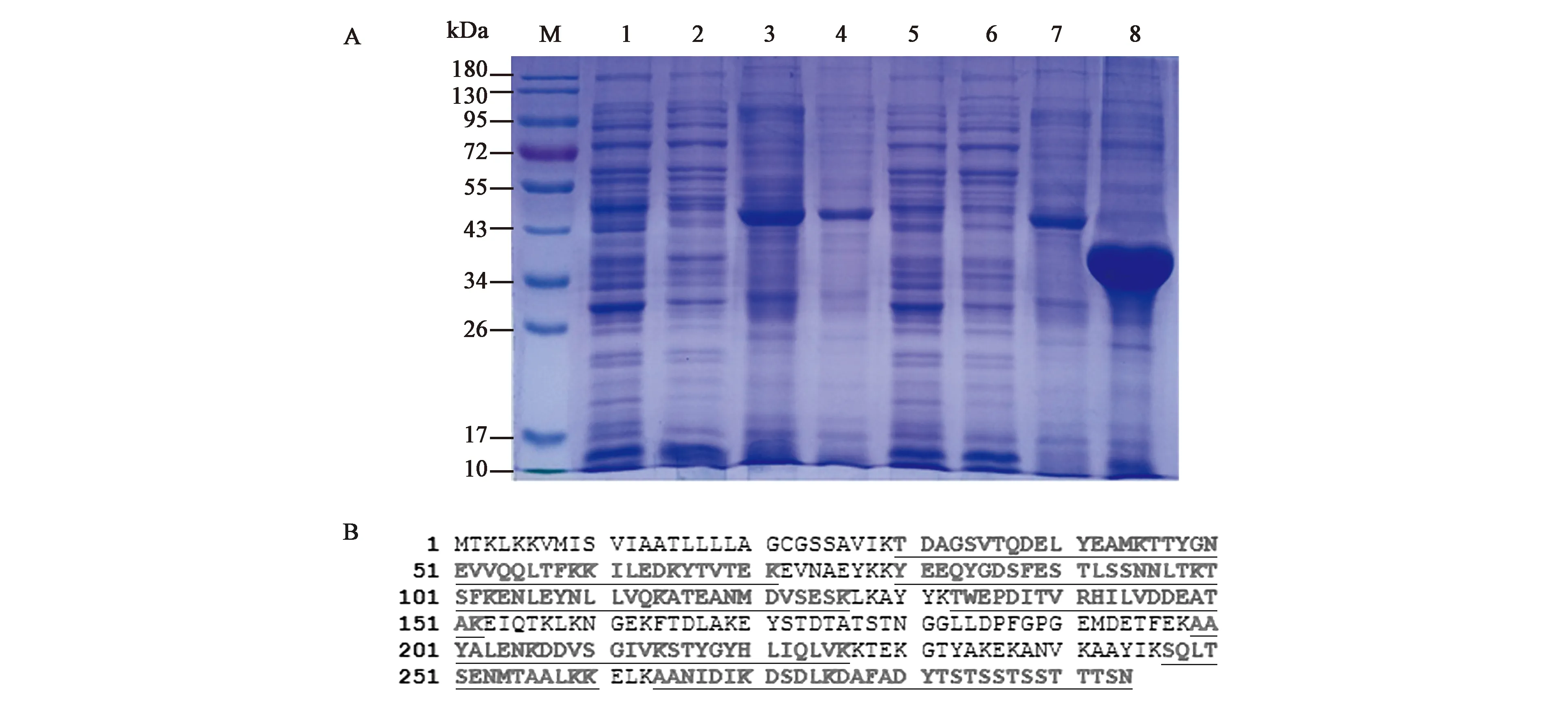
图6 Δ28PrsA1的表达与鉴定Fig.6 Induced expression and identification of Δ28PrsA1.A. SDS-PAGE鉴定结果; M. 彩色预染蛋白质分子量标准(10~180 kDa); 1. 空载体未诱导上清; 2. 空载体诱导上清; 3. 空载体未诱导包涵体; 4. 空载体诱导包涵体; 5. 重组质粒未诱导上清; 6. 重组质粒诱导上清; 7. 重组质粒未诱导包涵体; 8. 重组质粒诱导包涵体; B.重组蛋白的质谱鉴定结果。
2.6 Δ28PrsA1的纯化
利用重组蛋白的His标签采用Ni-IDA-Sefinose 纯化柱对其进行纯化,SDS-PAGE结果如图7所示,泳道2为纯化后的Δ28PrsA1,在泳道2上33 kDa处有明显的蛋白条带,几乎没有杂蛋白条带,表明该蛋白确实是原核表达的Δ28PrsA1蛋白,并且纯化的蛋白具有较高的纯度。
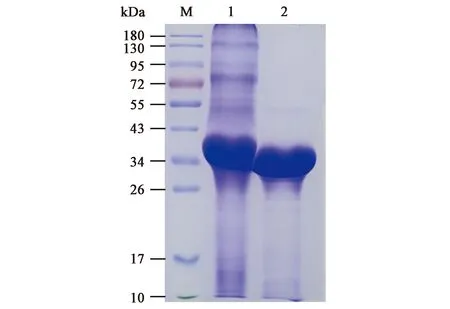
图7 Δ28PrsA1的纯化Fig.7 Purification of Δ28PrsA1.M.彩色预染蛋白质分子量标准(10~180 kDa); 1.纯化前的Δ28PrsA1; 2.纯化后的Δ28PrsA1。
2.7 多克隆抗体的效价测定
间接ELISA法检测兔血清中特异性抗体水平,OD450吸光值大于阴性血清的2.1倍即可确定为最终效价。由图8可知,该蛋白能较好地引起兔子的免疫反应,具有较好的免疫原性,该多抗效价高达1∶128 000。
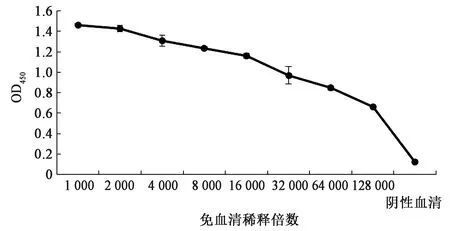
图8 多克隆抗体的效价测定Fig.8 Determination of the polyclonal antibody titer.
2.8 多克隆抗体的纯化
由图9所示,泳道1为饱和硫酸铵沉淀法粗提的抗体,泳道2为亲和层析柱纯化过程中的穿透液,在55 kDa左右没有蛋白条带,表明在纯化过程中抗体没有丢失,泳道3为洗脱的抗体,在55 kDa左右有一明显条带,为抗体的重链,在26 kDa左右有弥散条带,为抗体轻链,除此之外没有杂带,表明纯化后抗体纯度较高。
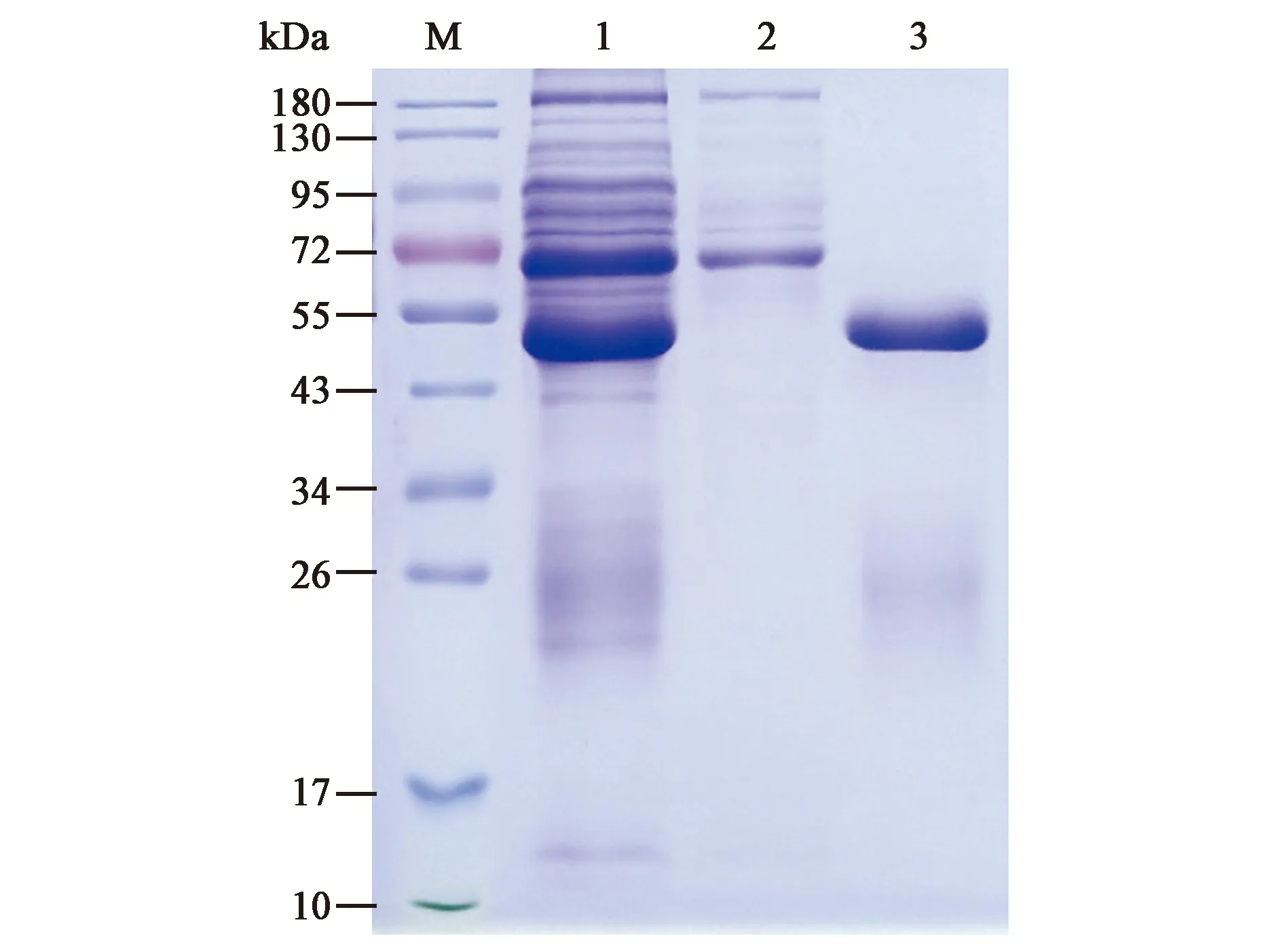
图9 多克隆抗体的纯化Fig.9 Purification of the polyclonal antibody.M. 彩色预染蛋白质分子量标准(10~180 kDa);1.纯化前的抗体;2. 穿透液;3.纯化后的抗体.
2.9 Western blotting法检测单增李斯特菌
在单增李斯特菌中,prsA1编码的PrsA1的分子量大约为33 kDa。由图10可知,在大约33 kDa处呈现出蛋白印迹,与预测大小相符,该多抗可与天然PrsA1特异性结合,表明已成功制备单增李斯特菌PrsA1多抗,抗体特异性较好,但与其他蛋白存在一定交叉性。
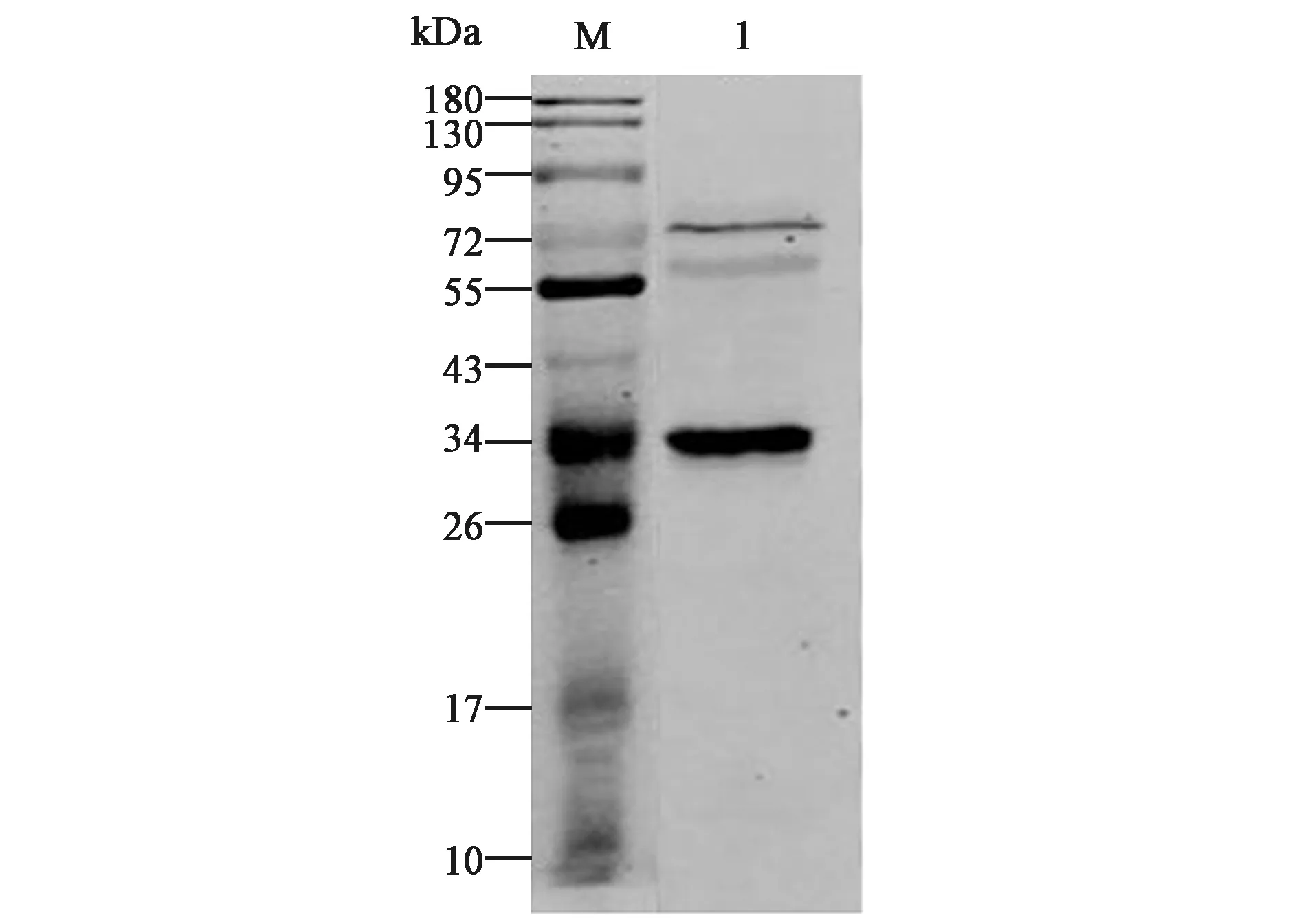
图10 Western blotting法检测单增李斯特菌Fig.10 Detection of Listeria monocytogenes by Western blotting.M: 彩色预染蛋白质分子量标准(10~180 kDa); 1:单增李斯特菌提取蛋白。
3 讨论
单增李斯特菌是一种常见的食源性致病菌,由其引发的食品安全事件层出不穷[24],因此开发对单增李斯特菌快捷灵敏、准确高效的检测方法是目前的研究热点。免疫学方法检测单增李斯特菌是利用抗体能够高亲和力特异性地结合表面蛋白或菌体,具有简便快捷的优势,使得免疫学检测方法成为大样本快速筛选的首选。如免疫层析试纸条等检测产品具有携带方便、检测快速、适合现场检测等优点使其成为有效的筛查工具,具有巨大的潜在市场和应用价值[25]。所以,高质量的抗体对实现单增李斯特菌的快速检测是很有必要的。
生物信息学地迅速发展使其成为了解蛋白质结构与功能的有力工具。研究中利用生物信息学方法在数据库中筛选出单增李斯特菌种内保守、种间特异的基因即prsA1。利用SEPPA 2.0程序预测PrsA1的空间抗原表位,结果显示PrsA1的非跨膜区具有良好的空间抗原表位,理论上具有良好的免疫原性。分别利用SignalP 4.1 Server程序和TMHMM Server V.2.0程序预测PrsA1的信号肽段、跨膜区域,预测结果显示PrsA1是分泌蛋白,在它的N端存在信号肽,对蛋白定位起重要作用,主要是将它靶向细胞膜;此外,它具有跨膜结构,跨膜区主要是把它锚定在细胞膜上,非跨膜区作为主要的酶结构域,参与重要的酶催化活动。前期原核表达PrsA1效果不佳,优化诱导表达条件也不能提高蛋白表达量,这可能与N端存在跨膜区相关。跨膜蛋白一方面由于结构复杂性,镶嵌在膜中的蛋白质呈α螺旋结构,结构相对复杂;另一方面由于功能多样性,膜蛋白作为离子通道具有一定的转运功能和传递信号的功能,可作为信号分子,为维持细胞内部稳定平衡,膜蛋白的合成可能受到严格调控[26,27]。PrsA1的信号肽序列在信号肽酶的作用下被切除,跨膜区氨基酸嵌入膜结构未暴露出来不易形成抗原表位结构。所以,在此基础上,原核表达非跨膜区片段Δ84prsA1,并对Δ28PrsA1进行免疫学验证,以纯化的Δ28PrsA1制备多克隆抗体,抗体的效价高达1∶128 000,并且该多抗能较好地与单增李斯特菌中天然PrsA1蛋白结合。本研究利用生物信息学筛选检测靶标并分析抗原表位结构,最后成功制备多克隆抗体,为单增李斯特菌检测靶标的筛选和免疫学检测提供了实践基础。
参 考 文 献
[1] Auvolat A, Besse N G. The challenge of enumeratingListeriamonocytogenesin food [J]. Food Microbiol., 2016, 53:135-149.
[2] Välimaa A L, Tilsala-Timisjärvi A, Virtanen E. Rapid detection and identification methods forListeriamonocytogenesin the food chain [J]. Food Control, 2015, 55: 103-114.
[3] Kocot A M, Olszewska M A. Biofilm formation and microscopic analysis of biofilms formed byListeriamonocytogenesin a food processing context [J]. LWT-Food Sci. Technol., 2017, 84: 47-57.
[4] Abeysundara P D A, Dhowlaghar N, Nannapaneni R,etal.. Growth and biofilm formation byListeriamonocytogenesin cantaloupe flesh and peel extracts on four food-contact surfaces at 22℃ and 10℃[J]. Food Control, 2017, 80:131-142.
[5] Komora N, Bruschi C, Magalhães R,etal.. Survival ofListeriamonocytogeneswith different antibiotic resistance patterns to food-associated stresses [J]. Int. J. Food Microbiol., 2017, 245:79-87.
[6] 王天姝,王 艳,贺春月,等. 中国部分食品分离单增李斯特菌的抗菌药物敏感性及耐药基因检测[J].疾病监测,2013,28(3):224-229.
[7] Vongkamjan K, Benjakul S, Vuddhakul V,etal.. Longitudinal monitoring ofListeriamonocytogenesandListeriaphagesin seafood processing environments in Thailand[J]. Food Microbiol., 2017, 66:11-19..
[8] 吴淑燕,张 超,陈国薇,等.单增李斯特菌入侵宿主分子机理研究进展[J]. 食品科学, 2014,35(19):290-294.
[9] Cahoon L A, Freitag N E, Prehna G. A structural comparison ofListeriamonocytogenesprotein chaperones PrsA1 and PrsA2 reveals molecular features required for virulence [J]. Mol. Microbiol., 2016,101(1):42-61.
[10] Sarvas M, Harwood C R, Bron S,etal.. Post-translocational folding of secretory proteins in Gram-positive bacteria [J]. Biochim. Biophys. Acta, 2004,1694(1-3): 311-327.
[11] Cahoon L A, Freitag N E. Identification of conserved and species-specific functions of theListeriamonocytogenesPrsA2 secretion chaperone [J]. Infect. Immun., 2015, 83(10): 4028-4041.
[12] Francis A I, Freitag N E.ListeriamonocytogenesPrsA2 is required for virulence factor secretion and bacterial viability within the host cell cytosol [J]. Infect. Immun., 2010, 78(11): 4944-4957.
[13] Francis A I, Xayarath B, Whisstock J C,etal.. Functional analysis of theListeriamonocytogenessecretion chaperonePrsA2 and its multiple contributions to bacterial virulence[J]. Mol. Microbiol., 2011, 80(6):1530-1548.
[14] 王 芬,王海龙,殷丽天,等. 刚地弓形虫磷酸甘油酸酯变位酶2基因编码蛋白主要特性与抗原表位的生物信息学分析[J]. 中国病原生物学杂志,2010,5(11):840-843.
[15] 吴祖建,高芳銮,沈建国. 生物信息学分析实践[M]. 北京:科学出版社,2010,112-116.
[16] 朱丹丹,段义农,陈金铃. 卡氏肺孢子虫Kexin蛋白抗原表位预测[J]. 现代预防医学, 2011,38(6):1077-1079.
[17] Qi T, Qiu T Y, Zhang Q C,etal.. SEPPA 2.0——more refined server to predict spatial epitope considering species of immune host and subcellular localization of protein antigen [J]. Nucl. Acids Res., 2014, 42 (W1):59-63.
[18] Sun J, Wu D, Xu T L,etal.. SEPPA: A computational server for spatial epitope prediction of protein antigens [J]. Nucl. Acids Res., 2009, 37: 612-616.
[19] 谢小冬,姜艳平,崔文,等. 单增李斯特菌内化素A分段表达及多克隆抗体的制备[J]. 黑龙江畜牧兽医,2015(3):137-139,237.
[20] 童吉宇,李志清,闻一鸣,等. 原核表达MurA蛋白并制备其多克隆抗体用于免疫磁珠快速检测单增李斯特菌[J]. 微生物学通报,2014,41(6):1234-1242.
[21] 王 羽,廖 翔,岳俊杰,等. 福氏志贺菌5a型M90T株GAPDH蛋白多克隆抗体的制备和鉴定[J]. 细胞与分子免疫学杂志,2014,30(4):407-410.
[22] 张佳锴,孟庆宇,程小峰,等. Fas胞外区基因的构建、表达、纯化及多克隆抗体的制备[J]. 中国生化药物杂志,2010,31(1):35-39.
[23] 徐宗凯,林青青,周梦莹,等. 三种李斯特菌菌体蛋白提取方法的比较[J]. 生命科学研究, 2015,19(1):29-33.
[24] 赵怀龙,付留杰,唐功臣. 我国主要的食源性致病菌[J]. 医学动物防制, 2012, 28(11): 1212-1216.
[25] 李建武,宋春美,刘 芳,等. 免疫层析试纸技术及其在食品安全检测中的应用[J]. 食品科学, 2014,35(8):36-41.
[26] 廖 丹,谢建平,王洪海. 结核分枝杆菌膜蛋白的异源表达与纯化研究进展[J]. 微生物学报, 2007,47(5):932-936.
[27] 左利民,康艳晶,罗施中. α-螺旋跨膜蛋白的折叠和自组装[J]. 科学通报, 2010, 55 (15): 1426-1437.
