牛肌肉生长抑制素基因突变的遗传效应与育种应用
2018-05-23魏著英白春玲李光鹏
魏著英, 白春玲, 李光鹏
内蒙古大学生命科学学院, 省部共建草原家畜生殖调控与繁育国家重点实验室, 呼和浩特 010071
肌肉生长抑制素(myostatin,MSTN)属于转化生长因子β(transforming growth factor β,TGFβ)超家族成员。MSTN主要在骨骼肌中表达,并分泌到细胞外间隙,通过血液循环运输到各组织器官从而起调节作用。MSTN不仅与骨骼肌的生长发育直接相关,而且参与糖代谢、脂代谢和蛋白质代谢等生理活动的调节[1, 2]。MSTN基因在不同物种中具有极强的进化保守性,说明该基因在动物生长发育与躯体模式形成中具有重要作用。同时,MSTN基因在同一物种中还具有较多的突变多态性。如果该基因发生突变,那么动物的表型将发生显著变化,出现肌肉过度发育或肌肉发达现象。本文将对牛的MSTN基因突变类型、突变后遗传效应及肉牛育种应用等作重点阐述,以期为牛MSTN基因的相关研究提供参考,为我国地方品种牛的改良和选育提供理论支持。
1 MSTN基因的保守性
对于MSTN基因的认识,是从发现了牛的双肌表型(double muscling)开始的。1807年,英国人Cuelly首次记录了牛的双肌表型;1888年,Kaiser对这种牛的表型做了较为清楚的记录;1929年,Wriedt认为这种表型是由单因子(单基因)控制的;1934年,Kronacher等提出该表型由三因子(tri-factorial)调控;1971年,Quesada与Cachafeiro又提出牛的双肌性状由双因子调控[3,4];直到1997年,才鉴定出MSTN基因与双肌臀表型相关[5],该基因定位于牛基因组的2号染色体[6]。利用人工突变技术使小鼠的MSTN基因发生突变,突变小鼠也表现出肌肉发达的双肌表型[5,7],由此将MSTN基因称为抑制肌肉发育基因(抑肌基因)。
研究发现,MSTN基因对于维持动物躯体性状和肌肉结构发挥重要调节作用[8]。MSTN基因在牛、羊、兔、狗、人、鱼、猪、鸡、狒狒、斑马鱼等不同物种间高度保守,其C端序列的同源性>90%[5]。小鼠、大鼠、人、猪、鸡与火鸡的同源性为100%;狒狒、牛、绵羊仅有1~3 bp的差别;斑马鱼与上述物种的同源性为88%[5]。除在牛中发现MSTN基因突变引起肌肉肥大外,在小鼠[9]、羊[10]、狗[11]和人[12]中也发现了自然突变的个例。
2 牛MSTN基因结构与有义突变类型
2.1 牛MSTN基因结构
牛MSTN基因位于2号染色体的2q11,包含3个外显子和2个内含子。外显子1和外显子2的长度分别为506 bp和374 bp,外显子3的长度随着poly(A)长度的不同而有所不同(1 701 bp、1 812 bp或1 887 bp);内含子分别是1 840 bp和2 033 bp(图1)。

图1 牛MSTN基因的结构示意图Fig.1 The diagram of the bovine MSTN gene.
牛MSTN基因序列仅有一个转录起始位点,在转录起始密码子ATG上游133 bp处,其cDNA只有一个阅读框(ORF),翻译376个氨基酸。MSTN蛋白具有TGF-β超家族的典型特征,是一种分泌型多肽,其前体蛋白N端为疏水的信号肽;C端是包含9个保守的半胱氨酸的成熟肽,中间区段为前肽。在前肽和成熟肽之间有一个RSRR蛋白酶解位点,酶切释放出26 kDa的成熟肽,成熟肽与特异性受体结合从而发挥生物学功能[13]。
2.2 牛MSTN有义突变类型
到目前为止,不同品种牛的MSTN基因中发现了至少6个功能性突变位点,包括比利时蓝牛(Belgian blue cattle)、皮尔蒙特牛(Peidmontese)、夏洛莱牛(Charolais)、阿奎坦牛(Blonde d’Aquitaine)、利木赞牛(Limousin)和德国黄牛(German gelbvieh)。比利时蓝牛由英国短角牛(English shorthorns)与荷兰牛(Dutch friesians)杂交,并与比利时本地牛杂交选育而成。比利时蓝牛的MSTN基因在nt821~831的位置发生了11个碱基的缺失,导致275位、276位和277位的3个氨基酸的丢失,阅读框从274位开始移位,使终止子提前到287位点[13]。皮尔蒙特牛的MSTN基因的第三外显子区的nt938 bp发生了G→A突变,致使氨基酸序列中313位的半胱氨酸突变为酪氨酸(C313Y),该突变发生于TGF-β超家族极度保守的9个半胱氨酸的第5个半胱氨酸。对发生于美国多家牛场的皮尔蒙特双肌牛检测发现,发生突变的牛均为nt938 bp的G→A突变,并且均为纯合子突变[13](图2)。夏洛莱牛的MSTN第二外显子的nt238 bp由C突变为T,导致氨基酸序列第204位Q(谷氨酰胺)突变为X(终止密码子),产生终止子[14]。利木赞牛MSTN的第一外显子nt282 bp处发生了C→A的突变,导致氨基酸序列第94位由F(苯丙氨酸)突变为L(亮氨酸)[15]。阿奎坦牛的MSTN基因第二内含子的nt1234 bp处发生了T→G的突变,导致第三外显子前多出了41 bp,氨基酸序列移码突变并终止,缺失第三外显子编码的氨基酸[16]。德国黄牛在MSTN第一外显子的nt191 bp由T突变为C,导致氨基酸序列第64位由L(亮氨酸)突变为P(脯氨酸),使蛋白结构发生改变[17]。
这些发生于不同品种牛的MSTN基因突变,均改变了分泌蛋白的结构,使MSTN蛋白失去活性,解除了MSTN基因对肌肉发育的抑制作用,由此导致肌肉发达的双肌表型。
分析牛MSTN基因核苷酸多态性可以发现,该基因除上述具有功能的突变外,还发现了多个无义突变。如图3所示,在第一和第二外显子、第一和第二内含子中均存在无义突变,说明MSTN基因是一个易发突变的基因。也说明该基因虽然在物种之间存在较强的保守性,但在具体物种(如牛)不同个体中发生突变的可能性极高。比较特别的是第三外显子中没有无义突变的报道,说明第三外显子的保守性较强,突变后对机体的影响更明显。如果发生了有义突变,则改变了肌肉发育表型;如果发生了无义突变,对生长发育没有影响。

图2 牛MSTN基因的有义突变位点示意图Fig.2 The diagram of the sense mutation in bovine MSTN gene.
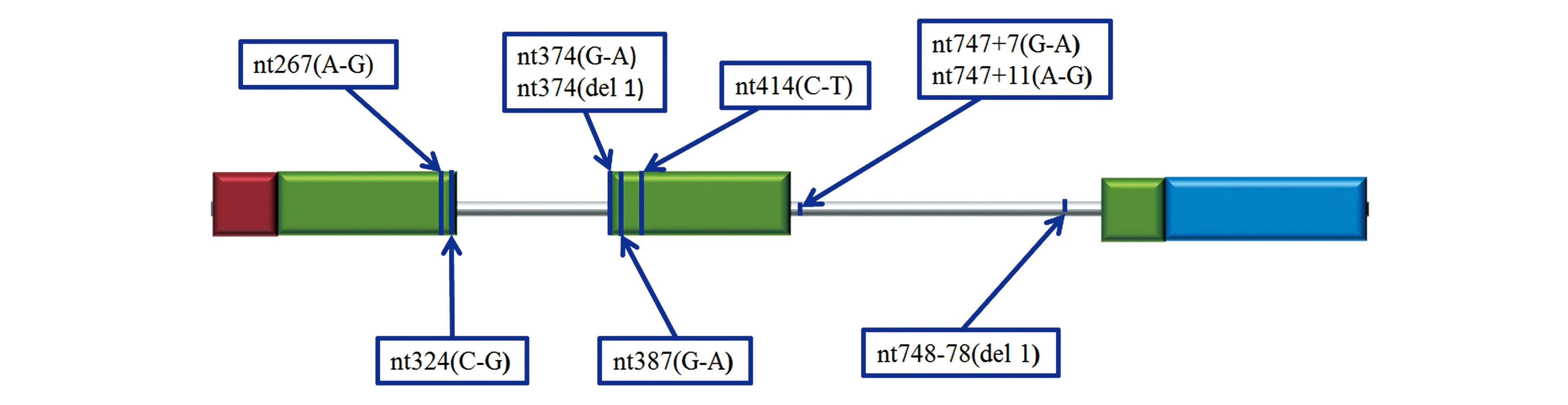
图3 牛MSTN基因的无义突变位点示意图[18]Fig.3 The diagram of the nonsense mutation in bovine MSTN gene[18].
3 中国地方品种牛MSTN基因突变情况分析
近些年来,我国学者对中国地方品种牛的MSTN基因突变情况做了一些研究。由于长期以来我国地方品种牛主要用于役用而非肉用,历史上没有形成典型的肉用牛品种。近年来,随着国家对地方品种肉牛培育和改良的支持,逐渐引进了国外肉牛的突变型MSTN基因,形成了具有地方特色的优秀肉牛品系。
3.1 秦川牛、南阳牛和渤海黑牛MSTN基因多态性
史明艳等[19,20]采用PCR-SSCP法对秦川牛与南阳牛进行检测,发现南阳牛中存在双肌个体,随后又对秦川牛和南阳牛的MSTN基因第三外显子进行了多态性分析,在45头南阳牛中发现1头牛的nt938 bp处发生G→A单核苷酸突变,但在秦川牛中没有发现突变现象。在这1例发生突变的南阳牛中,其突变位点与皮尔蒙特牛的自然突变位点一致,推测该例南阳牛可能含有皮尔蒙特牛的血统。在对渤海黑牛的研究中,2009年,刘桂芬等[21]发现MSTN基因第一外显子的nt111 bp处存在一个突变,在第二和第三外显子中没有发现突变。然而,该结果与刘桂芬等在2011年的报道相矛盾,在578头渤海黑牛的MSTN基因第一和第二外显子中均未发现多态位点;在第三外显子中发现两个多态性位点,即nt330 bp处存在1个G→A转换、nt336 bp处存在1个C→T转换[22]。在所研究的渤海黑牛群体中,并没有发现明显的双肌性状个体,而且MSTN基因的突变个体在体尺性状上并没有优势。因而,在秦川牛和渤海黑牛中是否存在MSTN有义突变,尚需进一步证实。
3.2 草原红牛和皖东/南牛MSTN基因多态性
郭丹等[23]对草原红牛和利草杂交牛(利木赞与草原红牛杂交)MSTN基因进行单核苷酸多态性分析,发现草原红牛在第一外显子的nt282 bp处发生了C→A的碱基突变,该突变导致编码的氨基酸由苯丙氨酸变为亮氨酸。由于该突变位点与利木赞牛MSTN基因第一外显子的突变位点一致[18],推测发生在草原红牛的该位点突变应来自利木赞牛。拥有该突变的利草杂交牛的日增重、屠宰率、净肉率和肉骨比等均显著高于普通草原红牛[23]。另外,张胜等[24]对40头草原红牛的MSTN基因第一内含子进行多态性分析,发现在nt1452 bp处存在C→T突变,该位点突变对草原红牛的净肉率有显著影响(P<0.05)。
刘洪瑜等[25]分析了皖东牛、皖南牛、和牛和西门塔尔牛4个群体的MSTN基因的第一外显子多态性,发现MSTN基因第一外显子1的nt267 bp发生A→G的同义突变,在所检测牛群中存在3种基因型(AA、GG、AG),A等位基因为优势基因。该位点在4个牛群体中均处于中度多态。
3.3 云岭牛和辽育白牛MSTN基因多态性
云岭牛是我国第一个三元杂交培育的肉用品种,和占星等[26]对该牛MSTN基因第二外显子进行多态性分析,发现在nt39 bp、nt46 bp、nt84 bp与nt266 bp等位点存在多态性,前3个位点均为同义突变,第266位点为错义突变。王娇娇等[27]在辽育白牛MSTN基因5′调控区发现了4个突变位点,分别是nt805 bp位点的G→C突变、nt163 bp处的T缺失突变、nt156 bp位点的A插入突变和nt130 bp位点的A插入突变;在编码区nt571 bp处发生A→G突变,3′-UTR nt5387 bp处发生C→T突变。辽育白牛是由夏洛莱牛与本地黄牛杂交选育而成,其中夏洛莱牛遗传成分占比高达93.75%[28],推测辽育白牛的MSTN突变及其突变类型来自夏洛莱牛。利用双肌皮尔蒙特牛与荷斯坦奶牛杂交,在皮荷杂种牛中发现了来自皮尔蒙特牛的MSTN突变位点,所有杂交牛均为杂合突变[29]。
3.4 牦牛MSTN基因多态性
在牦牛中也存在MSTN基因的自然突变。梁春年等[30]对牦牛MSTN基因第二内含子分析发现,在其扩增片段的nt192 bp处存在A→G突变。此变异对成年牦牛胸围、体质量、胸围指数、体长指数和肉用指数等均有显著影响(P<0.05)。刘应祥等[31]对牦牛MSTN基因的遗传变异做了分析,发现了4个多态位点,有2处位于第二外显子,2处位于第一内含子。张丽等[32]对天祝白牦牛和甘南牦牛MSTN基因序列比对发现,两个牦牛亚种间相差不大,仅在第二外显子nt417 bp处存在C→T突变,属同义突变。
以分别代表普通牛、瘤牛、牦牛和大额牛的蒙古牛、雷琼牛、巴州牦牛与独龙牛为对象,常春芳等[33]对这几种牛的MSTN基因第二外显子进行了多态性分析。在4个牛品种66个样本中,第二外显子出现了3个SNPs位点,即nt414 bp(C→T)、nt639 bp(A→G)和nt704 bp(A→G)。其中,nt414 bp和nt639 bp位点属于同义突变,nt704 bp位点变异为非同义突变,编码氨基酸由组氨酸突变为精氨酸。在对中国瘤牛、普通牛、牦牛和大额牛4个牛属MSTN基因外显子区核苷酸序列对比研究中,发现了7个SNPs位点,只有1个位点是有义突变,由(aa235)组氨酸突变为精氨酸[34]。由于组氨酸与精氨酸均属碱性氨基酸,并且具有相似的功能基团,对蛋白质功能影响不大。
由上可知,虽然在某些品种牛中发现了MSTN有义突变,但由于无法证实所使用的牛群样本没有受到引进品种如利木赞牛、夏洛莱牛、皮尔蒙特牛的杂交行为,因而推测,中国本土牛存在可形成双肌表型的MSTN基因自然突变的可能性不大(图4,彩图见图版一)。

图4 中国黄牛MSTN基因突变位点示意图Fig.4 The diagram of the mutation in Chinese cattle MSTN gene.注:红色代表有义突变,蓝色代表无义突变。(彩图见图版一)
4 牛MSTN基因突变引起的遗传效应
MSTN基因突变引起了肌肉发育的变化,肌纤维数量和体积增大,增加了肌肉中糖分解型肌纤维的比例,改变了肌肉的代谢活动。但是MSTN基因的效应不仅仅体现在肌肉方面,个体的体重、各器官重等均发生了显著变化。
4.1 MSTN基因突变对骨骼肌发育的影响
牛MSTN基因突变引起的双肌现象,使产肉量显著提高。所谓“双肌”,并不是出现了双倍的肌肉,而主要是由于肌纤维数量的增多(hyperplasia)和一定程度的肌纤维增大(hypertrophy)所致,动物在表观上呈现肌肉发达、块肌显著。在MSTN突变个体中,肌纤维总数[35~37]和糖分解型快肌纤维(fast glycolytic fibers)的比例[37,38]显著提高,这是由于解除了MSTN对成肌细胞增殖和分化的抑制作用所致。
MSTN突变的双肌牛的总体肌肉量提高,而且躯体不同位置的肌肉情况有差别。躯体前半部分的变化范围为8%~51%,后半部分为9%~34%[8]。而且伴有糖分解型快肌纤维增多、糖原含量减少,肌红蛋白、脂肪、胶原蛋白、线粒体数量和毛细血管密度等均减少[39]。在肌纤维肥大的同时,骨骼质量发生了变化。相对提高的肌肉重量意味着突变牛骨肉比低于非突变牛的骨肉比,骨重量变化了2.9%~9.6%。肌纤维肥大与相对的骨重量减轻,其结果是胴体质量的提高,屠宰率和净肉率提高[40]。
4.2 MSTN基因突变对出生重和成体内脏器官的影响
突变比利时蓝牛的初产牛的出生重与成牛体重的比率为9.0%,经产牛的犊牛出生重占比为8.3%;荷斯坦奶牛初产牛和经产牛的犊牛出生重与成牛体重的占比分别为7.5%和6.5%。因而,在大多数情况下,突变型比利时蓝牛的生产需要剖腹。剖腹的副作用是延迟了繁殖周期,剖腹产牛的世代间隔为435 d,而自然产牛为393 d[41]。
某些双肌型牛成体内脏器官重量相对减轻。在一些双肌型比利时蓝牛中,以器官重占总体重的比率为指标,消化系统减少了18%、肝脏减少了16%、心脏减少了14%、肺脏减少19%、脾脏减少37%、肾上腺减少了10%[8,42]。肺脏重量的减少,对突变动物呼吸功能造成了负面影响[43]。在突变牛中易发生呼吸管道水肿,可能是类胆碱的支气管收缩与β-肾上腺支气管扩张对自主神经系统的综合作用所致,这可能就是突变牛易感呼吸系统疾病的原因[43]。与荷斯坦牛相比,Clinquart等[44]发现突变比利时蓝牛的干物质消化能力显著下降(-4.6%,P<0.01),消化能力也显著下降(-2.7%);但也有报道认为突变蓝牛的干物质消化能力要高于(1.1%)非突变的比利时蓝牛[45]。
综上所述,MSTN基因突变在促进肌肉生长的同时,也引起了内脏器官减轻和免疫器官减小,突变牛的呼吸与免疫等方面的发病率升高。这些异常表现主要集中在纯合突变的比利时蓝牛群体中,在其他品种MSTN突变牛群体中的表现并不显著。
5 MSTN基因突变牛的杂交应用
MSTN基因纯合突变牛(比利时蓝牛)存在耐力较差、呼吸与免疫疾病发病率高与难产率高等问题,但作为父本与其他品种牛杂交生产F1代商品牛则具有极显著的经济意义,产肉性能显著提高,肉品质也得到改善。
5.1 杂交牛的产肉性能显著提高
与非突变牛相比,MSTN突变牛的生长速度与肌肉产量显著提高,牛肉的脂肪含量显著下降,瘦肉率显著高于普通牛。以同样600 kg重的双肌比利时蓝牛与普通牛相比,屠宰率分别为70%和64%,冷胴体重量分别为420 kg和384 kg,屠宰率和净肉率显著提高[46]。Casas等[47,48]对536头比利时蓝牛杂合后代牛进行生产性能分析,屠宰重显著高于普通牛(P<0.05)、后腿与后臀重显著高于普通牛(P<0.001);里脊肉显著增重(P<0.001)、眼肌面积显著增大(P<0.05)。这些结果说明,比利时蓝牛的杂合子后代的产肉量与肉质品质显著好于普通肉牛。Short等[49]对皮尔蒙特、利木赞和海福特3种公牛的F2代的生长、育肥和屠宰进行研究表明,双肌型皮尔蒙特牛的后代的初生重显著高于海福特牛后代,产肉性能显著提高,脂肪含量明显降低;利木赞牛的后代出生体重小于皮尔蒙特牛后代,高于海福特牛后代,断奶重高,生长快速,肌肉多、脂肪少,骨盆大,饲料转化率高。Sellick等[50]发现拥有F94L突变位点的利木赞牛及其杂交后代的肌肉生长能力显著增强,与对照相比,腿肌增加了5.5%,眼肌面积增加了2.3%。
5.2 杂交牛的肉品质显著提高
基因型与等位基因数目对于肌肉等级、脂肪厚度、生产难易度有显著影响。无论是比利时蓝牛突变型,还是皮尔蒙特牛突变型,杂合后代牛的表型都是瘦肉率高,胴体重高。因而,在生产型配种时,可以最大限度的获得杂合型牛,以提高胴体产出。Wheeler等[51]对皮尔蒙特双肌牛后代的背最长肌(longissimus thoracis,LD)、臀中肌(gluteus medius,GM)、半膜肌(semimembranosus,SM)和股二头肌(biceps femoris,BF)4种肌肉组织的嫩度进行比较分析。结果表明,在4种肌组织中,杂合突变与纯合突变型牛肉的嫩度、易碎性和结缔组织量显著高于野生型。纯合突变型的所有肌肉类型的多汁性要低于杂合型和野生型;纯合型几种肌肉的风味要低于杂合与野生型。野生型、杂合型和纯合型不同部位肉的嫩度排序分别为LD>GM>SM>BF、LD>GM>SM>BF、LD>GM>BF>SM。Wiener等[52]研究了双肌比利时蓝公牛与南德温牛(south devon)杂交后代的生长、体况和产肉性能。杂合突变牛的产肉率显著提高,减少了脂肪厚度,也提高了肌肉等级。
Allais等[53]研究了法国的2种MSTN基因中具有Q204X和nt821突变的夏洛莱牛、利木赞牛和阿奎坦牛,发现带有Q204X突变的公牛胴体的脂肪含量、肌间脂肪含量和胶原成分比普通牛显著减少;而嫩度比普通牛提高,他们还利用芯片技术分别分析了3种公牛及其后代公牛的肌内脂肪含量、肉质光度、剪切力和嫩度等肉质性状,显示剪切力和嫩度指数高度遗传相关,夏洛莱牛和利木赞牛是-0.91,阿奎坦牛是-0.86,3个品种之间并无统计学差异。Ramayo-Caldas等[54]利用系统生物学方法分析夏洛莱牛、利木赞牛和阿奎坦牛的嫩度及其他肉质性状相关基因的互作关系,共检测到206个与剪切力相关的共同基因,这些基因中的SNPs可以解释28%~30%之间的不同品种剪切力的表型差异。
6 展望
我国牛种资源丰富,地方品种约有53个,是世界上牛品种最多的国家。历史上,我国的黄牛品种如鲁西牛、秦川牛、南阳牛、延边牛、晋南牛等均经过服从耕田拉车的役用选择,以速度和耐力为选育标准,所形成的黄牛基本为前驱壮硕,臀部流线型,躯干与四肢肌肉结实但欠发达。与安格斯、西门塔尔、海福特、利木赞、夏洛莱等国外优良肉牛品种相比,国内黄牛品种的产肉性能与生产性能劣势显著,养殖效益远不如国外品种。
前已述及,在我国黄牛个别品种中也检测到了MSTN基因突变的现象,但现有研究数据仍无法确证这些突变会产生肌肉发达的双肌表型。为了快速提高本土牛的生长与产肉性能,国内的科研人员也进行了一些尝试。Luo等[55]利用锌指核酸酶技术对鲁西牛的MSTN基因进行编辑,筛选出基因缺失突变的成纤维细胞,再制备转基因克隆胚胎,经过胚胎移植后,获得了MSTN基因编辑牛。所获得的基因编辑牛呈现与自然双肌牛类似的肌肉表型。本实验室以鲁西黄牛和蒙古牛为对象,利用CRISPR/Cas9对其MSTN基因进行定点编辑,初步培育出表型良好的MSTN编辑基因牛。利用基因编辑公牛的精液与鲁西牛、安格斯牛、蒙古牛和西门塔尔牛进行杂交,所生产的F1代牛均表现出肌肉发达的表型(未发表数据)。另外,我国学者对猪的MSTN基因进行编辑,获得了表型突出的基因编辑猪,其产肉量和瘦肉率显著高于对照组猪[56~58]。上述试验结果表明,利用MSTN基因,可以改变牛和猪的体型体况,提高其生长发育和产肉量,可以培育出肉用家畜育种新材料或新品种[59]。
随着对MSTN基因突变引起一系列生理效应机制的研究,研究者们进一步了解了MSTN基因突变与表型之间的关联关系,可以设想通过位点选择、调控因子介入与条件性编辑等技术,对我国本土牛的MSTN基因实施编辑改造,从而使MSTN基因突变效应发挥到适当水平,使所培育的基因编辑牛的生长速度与产肉率适中,同时不会引起器官变化、免疫变化以及难产率升高等问题。
参 考 文 献
[1] Lee S J, McPherron A C. Regulation of myostatin activity and muscle growth[J]. Proc. Natl. Acad. Sci. USA, 2001,98:9306-9311.
[2] Fernandez C, Barroso A, Canon J,etal.. Myostatin dominant negative allele products interact positively with wild type monomers[J]. Anim. Biotechnol., 2004,15:133-143.
[3] Bellinge R H, Liberles D A, Iaschi S P,etal.. Myostatin and its implications on animal breeding: A review[J]. Anim. Genet., 2005, 36:1-6.
[4] 刘 博, 韩志国, 高腾云. 牛双肌基因遗传机制及研究进展[J]. 中国农学通报,2011,27:333-336.
[5] McPherron A C, Lee S J. Double muscling in cattle due to mutations in the myostatin gene[J]. Proc. Natl. Acad. Sci. USA, 1997,94:12457-12461.
[6] Charlier C, Coppieters W, Farnir F,etal.. The mh gene causing double-muscling in cattle maps to bovine Chromosome 2[J]. Mamm. Genome, 1995,6:788-792.
[7] Grobet L, Martin L J, Poncelet D,etal.. A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle[J]. Nat. Genet., 1997,17:71-74.
[8] Fiems L O. Double muscling in cattle: Genes, husbandry, carcasses and meat[J]. Animals (Basel), 2012,2:472-506.
[9] Szabo G, Dallmann G, Muller G,etal.. A deletion in the myostatin gene causes the compact (Cmpt) hypermuscular mutation in mice[J]. Mamm. Genome, 1998, 9:671-672.
[10] Clop A, Marcq F, Takeda H,etal.. A mutation creating a potential illegitimate microRNA target site in the myostatin gene affects muscularity in sheep[J]. Nat. Genet., 2006, 38:813-818.
[11] Mosher D S, Quignon P, Bustamante C D,etal.. A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs[J]. PLoS Genet., 2007,3:e79.
[12] Schuelke M, Wagner K R, Stolz L E,etal.. Myostatin mutation associated with gross muscle hypertrophy in a child[J]. N. Engl. J. Med., 2004,350:2682-2688.
[13] Kambadur R, Sharma M, Smith T P,etal.. Mutations in myostatin (GDF8) in double-muscled Belgian blue and Piedmontese cattle[J]. Genome Res., 1997,7:910-916.
[14] Phocas F. Genetic analysis of breeding traits in a Charolais cattle population segregating an inactive myostatin allele[J]. J. Anim. Sci., 2009,87:1865-1871.
[15] Esmailizadeh A K, Bottema C D, Sellick G S,etal.. Effects of the myostatin F94L substitution on beef traits[J]. J. Anim. Sci., 2008,86:1038-1046.
[16] Bouyer C, Forestier L, Renand G,etal.. Deep intronic mutation and pseudo exon activation as a novel muscular hypertrophy modifier in cattle[J]. PLoS ONE, 2014,9:e97399.
[17] Dierks C, Eder J, Glatzer S,etal.. A novel myostatin mutation in double-muscled German Gelbvieh[J]. Anim. Genet., 2015,46:91-92.
[18] Grobet L, Poncelet D, Royo L J,etal.. Molecular definition of an allelic series of mutations disrupting the myostatin function and causing double-muscling in cattle[J]. Mamm. Genome,1998,9:210-213.
[19] 史明艳, 昝林森, 王勇强. 秦川牛、南阳牛双肌基因的PCR-SSCP检测[J]. 西北农业学报, 2003, 12:21-23.
[20] 史明艳, 昝林森, 李保兰, 等. 牛Myostatin基因单核苷酸多态性分析[J]. 中国农学通报,2005, 21:24-25.
[21] 刘桂芬, 万发春, 宋恩亮, 等.渤海黑牛和日本和牛MSTN基因的比较分析[J]. 家畜生态学报, 2009,30:7-9.
[22] 刘桂芬, 万发春, 刘晓牧, 等. 渤海黑牛MSTN基因多态性位点与体尺性状的关联性分析[J]. 华北农学报,2011,26:17-21.
[23] 郭 丹, 曹 阳, 张嘉保, 等.草原红牛MSTN基因第一外显子SNPs多态性分析[J]. 现代畜牧兽医, 2007,11: 12-14.
[24] 张 胜, 张永宏, 高 妍, 等. 草原红牛肌生成抑制素基因内含子1多态性及部分屠宰性状的相关性分析[J]. 中国兽医学报, 2010, 30:1557-1560.
[25] 刘洪瑜, 杨漫漫, 姬云涛, 等. 4个牛群体MSTN基因第1外显子单核苷酸多态性分析[J]. 安徽农业大学学报,2014 41:380-384.
[26] 和占星, 亐开兴, 张继才,等. BMY牛MSTN基因exon 2克隆及序列分析[J]. 中国牛业科学, 2013, 39:1-5.
[27] 王娇娇, 张世伟, 张丽君, 等.辽育白牛MSTN基因分子克隆及序列分析[J]. 现代畜牧兽医, 2016(10): 21-27.
[28] 张 沅. 中国畜禽遗传资源志:猪志[M].北京: 中国农业出版社,2011.
[29] 孙少华, 李雪梅, 魏学蕊, 等. 牛肌肉生长抑制素(MSTN)基因的检测、分型研究[J]. 中国农业科技导报,2001,3:66-67.
[30] 梁春年, 丁学智, 包鹏甲,等. 牦牛MSTN基因分子克隆及序列分析[J]. 华北农学报, 2013, 28:76-81.
[31] 刘应祥, 王海芳, 闫永红, 等.牦牛MSTN基因第2外显子的遗传变异分析[J]. 甘肃农业大学学报,2015(5):15-19.
[32] 张 丽, 刘丽霞, 李强子, 等. 天祝白牦牛MSTN基因编码区克隆及生物信息学分析[J]. 浙江农业学报, 2017,29:618-624.
[33] 常春芳, 冀德君, 常 洪, 等. 中国4个牛种MSTN基因外显子2多态性分析与其系统发生关系研究[J]. 安徽农业科学, 2008,36:5790-5791.
[34] 冀德君, 常 洪, 常春芳, 等.中国牛属4个物种MSTN基因的遗传变异研究[J]. 畜牧兽医学报, 2008,39:701-704.
[35] Wegner J, Albrecht E, Fiedler I,etal.. Growth- and breed-related changes of muscle fiber characteristics in cattle[J]. J. Anim. Sci., 2000,78:1485-1496.
[36] Albrecht E, Teuscher F, Ender K,etal.. Growth- and breed-related changes of muscle bundle structure in cattle[J]. J. Anim. Sci., 2006,84:2959-2964.
[37] Albrecht E, Lembcke C, Wegner J,etal.. Prenatal muscle fiber development and bundle structure in beef and dairy cattle[J]. J. Anim. Sci.,2013,91:3666-3673.
[38] Girgenrath S, Song K, Whittemore L A. Loss of myostatin expression alters fiber-type distribution and expression of myosin heavy chain isoforms in slow- and fast-type skeletal muscle[J]. Muscle Nerve, 2005, 31:34-40.
[39] Picard B, Lefaucheur L, Berri C,etal.. Muscle fibre ontogenesis in farm animal species[J]. Reprod. Nutr. Dev., 2002,42:415-431.
[40] Arthur P F, Makarechian M, Price M A,etal.. Heterosis, maternal and direct effects in double-muscled and normal cattle: I. Reproduction and growth traits[J]. J. Anim. Sci., 1989,67:902-910.
[41] Pilarczyk R, Wojcik J. Comparison of body weight and reproduction performance in cows of various beef breeds managed under equal conditions in West Pomerania[J]. Archiv. Fur. Tierzucht., 2008,51:318-328.
[42] Piedrafita J, Quintanilla R, Saudo C,etal.. Carcass quality of 10 beef cattle breeds of the Southwest of Europe in their typical production systems[J]. Livestock Prod. Sci., 2003,82:1-13.
[43] Cambier C, Clerbaux T, Detry B,etal.. Blood oxygen binding in double-muscled calves and dairy calves with conventional muscle conformation[J]. Am. J. Veter. Res., 2000, 61:299.
[44] Clinquart A, Van Eenaeme C, Mayombo A P,etal.. Plasma hormones and metabolites in cattle in relation to breed (Belgian Blue vs Holstein) and conformation (double-muscled vs dual-purpose type) [J]. Vet. Res. Commun., 1995,19:185-194.
[45] Fiems L O, Cottyn B G, Boucqué C V,etal.. Effect of beef type, body weight and dietary protein content on voluntary feed intake, digestibility, blood and urine metabolites and nitrogen retention[J]. J. Anim. Physiol. Anim. Nutr., 1997,77:1-9.
[46] Arthur P F. Double muscling in cattle: A review[J]. Austr. J. Agric. Res., 1995,46:1493-1515.
[47] Casas E, Keele J W, Shackelford S D,etal.. Association of the muscle hypertrophy locus with carcass traits in beef cattle[J]. J. Anim. Sci., 1998, 76:468-473.
[48] Casas E, Keele J W, Fahrenkrug S C,etal.. Quantitative analysis of birth, weaning, and yearling weights and calving difficulty inPiedmontesecrossbredssegregating an inactive myostatin allele[J]. J. Anim. Sci., 1999,77:1686.
[49] Short R E, Macneil M D, Grosz M D,etal.. Pleiotropic effects in Hereford, Limousin, and Piedmontese F2crossbred calves of genes controlling muscularity including the Piedmontese myostatin allele[J]. J. Anim. Sci., 2002, 80:1-11.
[50] Sellick G S, Pitchford W S, Morris C A,etal.. Effect of myostatin F94L on carcass yield in cattle[J]. Anim. Genet., 2007, 38:440-446.
[51] Wheeler T L, Cundiff L V, Shackelford S D,etal.. Characterization of biological types of cattle (Cycle V): Carcass traits and longissimus palatability[J]. J. Anim. Sci., 2001, 79:1209-1222.
[52] Wiener P, Smith J A, Lewis A M,etal.. Muscle-related traits in cattle: The role of the myostatin gene in the South Devon breed[J]. Genet. Select. Evol. Gse, 2002,34:1-12.
[53] Allais S, Leveziel H, Hocquette J F,etal.. Fine mapping of quantitative trait loci underlying sensory meat quality traits in three French beef cattle breeds[J]. J. Anim. Sci. ,2014,92:4329-4341.
[54] Ramayo-Caldas Y, Renand G, Ballester M,etal.. Multi-breed and multi-trait co-association analysis of meat tenderness and other meat quality traits in three French beef cattle breeds[J]. Genet. Sel. Evol., 2016,48:37.
[55] Luo J, Song Z, Yu S,etal.. Efficient generation of Myostatin (MSTN) biallelic mutations in cattle using Zinc finger nucleases[J]. PLoS ONE, 2014,9:e95225.
[56] Cai C, Qian L, Jiang S,etal.. Loss-of-function myostatin mutation increases insulin sensitivity and browning of white fat in Meishan pigs[J]. Oncotarget, 2017,8:34911-34922.
[57] Jiang Y L, Li N, Du L X,etal.. Relationship of T→A mutation in the promoter region of myostatin gene with growth traits in swine[J]. J. Genet. Genom., 2002,29:413-416.
[58] Qian L, Tang M, Yang J,etal.. Targeted mutations in myostatin by zinc-finger nucleases result in double-muscled phenotype in Meishan pigs[J]. Sci. Rep., 2015,5:14435.
[59] Dunner S, Miranda M E, Amigues Y,etal.. Haplotype diversity of the myostatin gene among beef cattle breeds[J]. Genet. Sel. Evol., 2003,35:103-118.
