功能化石墨烯用于盐酸倍他洛尔的检测与识别
2018-05-23卢晨娜于凯利
张 强,刘 巍,卢晨娜,岳 悦,于凯利
(新乡医学院药学院药物分析教研室,河南 新乡 453003)
氧化石墨烯(graphene oxide,GO)是2004年以来备受关注的一种新型明星碳系材料,由于其特殊的二维结构所带来的优越物理、化学性质,被广泛地应用于化学能源、环境污染治理、分析化学等领域。GO通过π-π共轭堆积作用吸附具有芳香结构的荧光物质,由于荧光能量共振转移而产生荧光猝灭现象[1-3]。利用荧光分子或荧光修饰化探针被GO吸附、解吸附产生的荧光“开-关”现象,实现了DNA[4-5]、RNA[6-8]、蛋白质[9-11]等的识别和检测。此方法的原理在于分析物通过竞争吸附或分子识别将荧光分子从GO表面释放至溶液中,对于无π-π堆积作用或合适适配体的小分子物质,此方法显得无能为力。
近年来,关于环糊精(cyclodextrin,CD)-GO复合物的制备已有相关报道。KONKENA等[12]利用GO表面的羧基将6-氨基-β-环糊精(β-cyclodextrin,β-CD)键合到GO表面,发现被CD包合后的荧光基团依然可以被GO高效猝灭。GUO等[13]利用氢键将β-CD修饰到GO表面。MONDAL等[14]利用此法实现了无π-π堆积作用的胆固醇检测。衍生化CD用于分子识别和检测的研究较多,而衍生化CD修饰GO用于分子识别的研究尚不多见。
本研究制备β-CD及其衍生物羟丙基-β-CD(hydroxypropyl-β-CD,HP-β-CD)修饰的功能化石墨烯(functionalized-reduced graphene oxide,rGO)复合物(β-CD@rGO和HP-β-CD@rGO),利用CD及其衍生物与罗丹明6G(rhodamine 6G,R6G)和分析物间的主客体竞争性反应,实现了对盐酸倍他洛尔的识别和检测,现报道如下。
1 材料与方法
1.1主要试剂与仪器GO粉(>99%)购于中科纳米时代技术有限公司,R6G(分析纯)购于成都西亚试剂有限公司,β-CD、HP-β-CD购于山东滨州智源科技生物有限公司,盐酸倍他洛尔由郑州大学新药研发中心提供,其他试剂均为分析纯,实验所用水均为去离子水;RF-5301 PC荧光分光光度计、UV-2700紫外分光光度计购于日本岛津公司,NEXUS 傅里叶变换红外光谱仪(fourier transform infrared specturm,FT-IR)购于美国尼高力仪器公司,热重分析/差示扫描量热法 (thermogravimetric analysis/differential scanning calorimetry,TGA/DSC) 分析仪器购于瑞士METTLER TOLEDO 公司。
1.2β-CD@rGO及HP-β-CD@rGO的制备分别配制1.00 g·L-1的GO分散液和40.00 g·L-1的β-CD、HP-β-CD溶液。将100 mL GO分散液与200 mL β-CD溶液混合后,加入3 mL氨水、200 μL水合肼,剧烈震荡5 min,置于磁力搅拌器在60 ℃下油浴3.5 h得到β-CD@rGO原液,透析后作为工作液(浓度为 0.333 g·L-1)使用。采用FT-IR、TGA对β-CD@rGO进行表征。HP-β-CD@rGO的制备步骤同β-CD@rGO。
1.3盐酸倍他洛尔检测R6G/β-CD@rGO体系的制备与测试:分别取0.15 mL β-CD@rGO工作液加去离子水9.60 mL置于10 mL容量瓶中,再加入0.2 mL R6G(1×10-4mol·L-1)混合摇匀,在室温下静置30 min,加入0.05 mL不同浓度的分析物溶液使其至10 mL,使其分析物的终浓度分别为0.005、0.025、0.050、0.250、0.750、1.000、2.000、3.000、4.000、5.000、6.000、7.000、8.000、9.000、10.000 μmol·L-1,之后在室温下静置5 min,用RF-5301 PC荧光分光光度计测其荧光强度值。荧光强度测试所用的激发波长为480 nm,发射波长为551 nm。R6G/β-CD@rGO体系和R6G/HP-β-CD@rGO体系分别代表2种溶液体系,I0分别为2种体系的荧光强度,I则是2种体系分别加入分析物后的荧光强度,(I-I0)/I0代表加入分析物后2种体系的荧光恢复率。通过专业作图软件可得出荧光恢复率与分析物浓度之间的线性关系图谱。R6G/HP-β-CD@rGO体系的配制和实验步骤同R6G/β-CD@rGO体系的制备与测试。实验进行3次取均值作为研究结果。
1.4方法专属性检测在优化实验条件下,2种荧光传感器对15种分析物进行了方法专属性检测。15种分析物分别为:L-亮氨酸(1)、L-苏氨酸(2)、L-甲硫氨酸(3)、L-苯丙氨酸(4)、L-缬氨酸(5)、L-酪氨酸(6)、L-色氨酸(7)、Cr(Ⅵ)(8)、葡萄糖(9)、蔗糖(10)、KCl(11)、NaCl(12)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(13)、R-扁桃酸(14)和盐酸倍他洛尔(15),其他14种物质的浓度与盐酸倍他洛尔的浓度比为1001。
2 结果
2.1β-CD@rGO和HP-β-CD@rGO的表征图谱β-CD@rGO (红线)包含β-CD (黑线)的典型吸收峰:1 026 cm-1是C-O/C-C伸缩/O-H的弯曲振动峰,1 156 cm-1是C-O-C伸缩/O-H的弯曲振动峰,1 413 cm-1是C-H/O-H的弯曲振动峰,2 925 cm-1是CH2的C-H伸缩振动峰,3 414 cm-1是O-H的伸缩振动峰(图1A)。在 300 ℃,β-CD(黑线)由于高温分解质量有明显下降,而rGO几乎无质量改变。由于β-CD在高温下会分解,可以看到β-CD@rGO (红线)的TGA曲线在298 ℃处有明显的质量损失。根据β-CD@rGO(红线)的TGA曲线计算可得,修饰到石墨烯上的环糊精约占34.1%(质量分数)(图1B)。HP-β-CD@rGO(红线)包含HP-β-CD(黑线)的典型吸收峰,对于HP-β-CD,2 966 cm-1和 2 920 cm-1分别为甲基和亚甲基的C-H对称伸缩振动峰和不对称振动峰,1 370 cm-1是甲基面内弯曲振动峰,1 030 cm-1是C-O-C伸缩/O-H的弯曲振动峰(图1C)。
HP-β-CD(黑线)的热分解温度区间为300~400 ℃,尤其在353 ℃质量有明显的下降。HP-β-CD@rGO失重曲线(红线)在250~360 ℃,同时HP-β-CD在高温下会分解,并且受rGO影响,HP-β-CD@rGO失重温度降低,尤其在330 ℃处有明显的质量损失(图1D)。R6G溶液的紫外吸收峰在 526 nm,当R6G加入到rGO分散液后,紫外吸收峰的位置没有发生改变,而当R6G分别加入到β-CD@rGO分散液及HP-β-CD@rGO分散液后,R6G的吸收峰均有25 nm的红移,则表明R6G进入β-CD或HP-β-CD的疏水性空腔,使R6G的吸收峰发生了变化(图1E)。
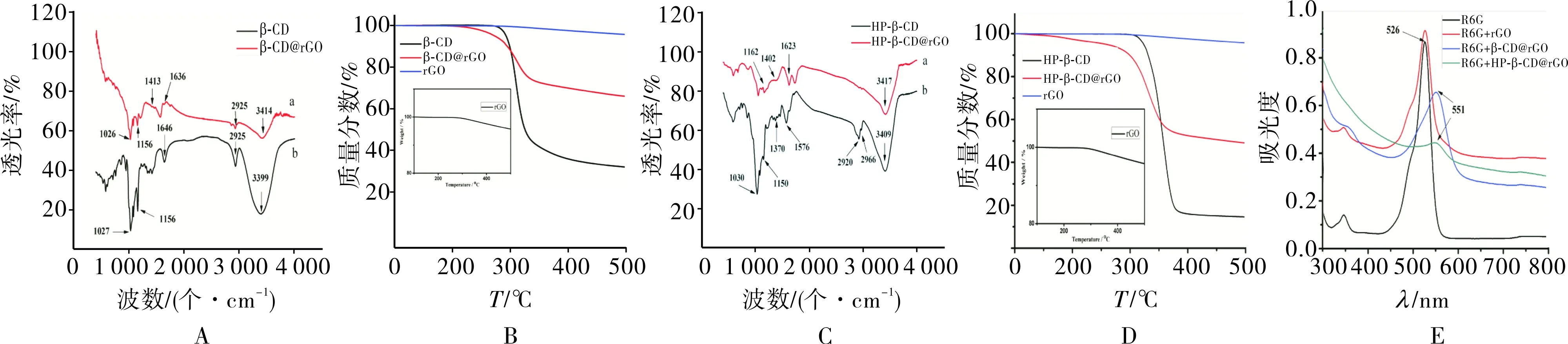
A:β-CD与β-CD@rGO的红外光谱图;B:β-CD,rGO与β-CD@rGO的TGA谱图;C:HP-β-CD与HP-β-CD@rGO的红外谱图;D:HP-β-CD与HP-β-CD@rGO的TGA谱图;E:R6G分别加入到β-CD@rGO分散液及HP-β-CD@rGO分散液中的紫外吸收谱图。
图1β-CD@rGO和HP-β-CD@rGO的表征图谱
Fig.1Characterizationspectraofβ-CD@rGOandHP-β-CD@rGO
2.2实验条件优化固定β-CD@rGO分散液浓度,随着R6G浓度的增大,加入的盐酸倍他洛尔与R6G间存在竞争包合,被盐酸倍他洛尔从β-CD空腔中置换出来,游离的R6G逐渐增多,当R6G浓度在0.3 μmol·L-1时,该体系的荧光恢复率达到最大值(图2A)。R6G浓度进一步增加时,体系中游离的R6G增加,荧光强度(I0)增加,同时盐酸倍他洛尔难以将R6G置换出来,因此荧光恢复率下降。当R6G浓度为2.0 μmol·L-1时,R6G/HP-β-CD@rGO体系的荧光恢复率达到最大值(图2B)。因此,本研究选择0.3 μmol·L-1R6G的R6G/β-CD@rGO体系和在2.0 μmol·L-1R6G的R6G/HP-β-CD@rGO体系检测盐酸倍他洛尔。
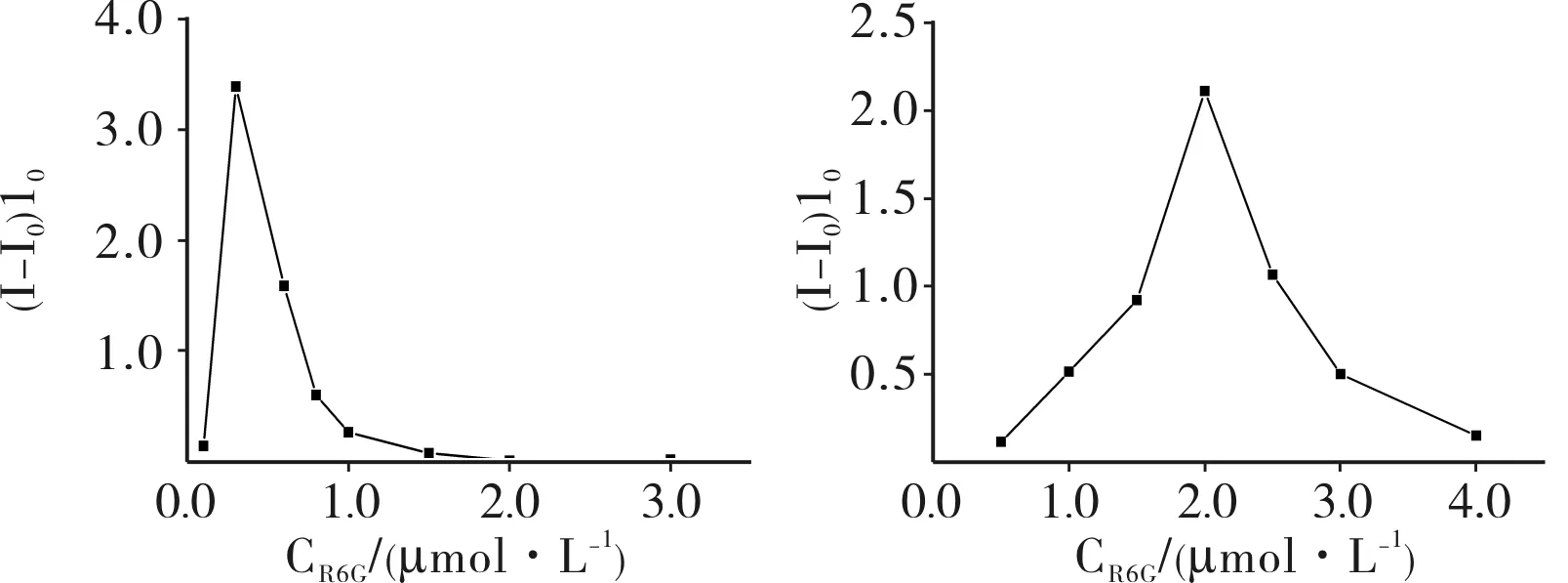
A:β-CD@rGO检测结果;B:HP-β-CD@rGO检测结果。
图2加入不同浓度R6G时的盐酸倍他洛尔(2.0μmol·L-1)的荧光恢复率
Fig.2Fluorescencerecoveryratioofbetaxololhydrochloride(2.0μmol·L-1)incorporatedwithdifferentconcentrationofR6G
2.3盐酸倍他洛尔检测R6G在0.3 μmol·L-1最适浓度下,R6G/β-CD@rGO荧光传感器对盐酸倍他洛尔的荧光恢复率为6.15,L-色氨酸(7)和R-扁桃酸(14)对盐酸倍他洛尔的检测干扰较大,其他物质干扰较小,荧光恢复率均低于0.5(图3)。R6G在 2.0 μmol·L-1最适浓度下,R6G/HP-β-CD@rGO荧光传感器对盐酸倍他洛尔的荧光恢复率达到9.29(图4),较R6G/β-CD@rGO荧光传感器的检测灵敏度要高。L-色氨酸(7)和R-扁桃酸(14)也有一定的荧光恢复率,但与R6G/β-CD@rGO体系比较其荧光恢复率并未增加,其他12种物质的荧光恢复率则明显下降(图4)。为降低R6G/HP-β-CD@rGO检测盐酸倍他洛尔时R-扁桃酸(14)的干扰,作者尝试改变体系中R6G的浓度。如图5所示,在R6G浓度为0.30、1.00、1.50、2.00、3.00 μmol·L-1时,R-扁桃酸(14)的荧光恢复率分别为 0.003 8、0.355 0、0.537 0、1.360 0、0.609 0。
当R6G浓度为0.3 μmol·L-1,R6G/HP-β-CD@rGO荧光传感器检测盐酸倍他洛尔的荧光恢复率为 3.95,而对其他14种物质几乎无响应(图6)。在牺牲部分灵敏度的情况下,可以提升盐酸倍他洛尔的检测专属性。
2种传感器检测不同浓度盐酸倍他洛尔的荧光光谱图见图7、图8。R6G浓度为 2.0 μmol·L-1时,R6G/HP-β-CD@rGO传感器的荧光恢复率与盐酸倍他洛尔浓度在1.0~10.0 μmol·L-1之间具有良好的线性关系,其线性回归方程为y=6.327x-7.585(R2=0.999),R6G浓度为0.3 μmol·L-1时,R6G/β-CD@rGO传感器荧光恢复率与盐酸倍他洛尔浓度在0.25~10.00 μmol·L-1之间具有良好的线性关系,其线性回归方程为y=0.244x+0.315(R2=0.870),其中y表示荧光恢复率(I-I0)/I0,x表示盐酸倍他洛尔的浓度(μmol·L-1)。
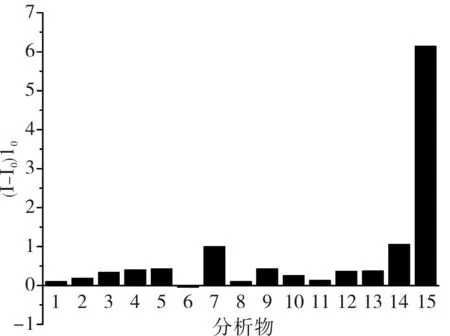
图3R6G/β-CD@rGO体系对15种分析物的荧光恢复率谱图
Fig.3FluorescencerecoveryratiospectraofR6G/β-CD@rGOsystemforfifteenkindsofanalytes
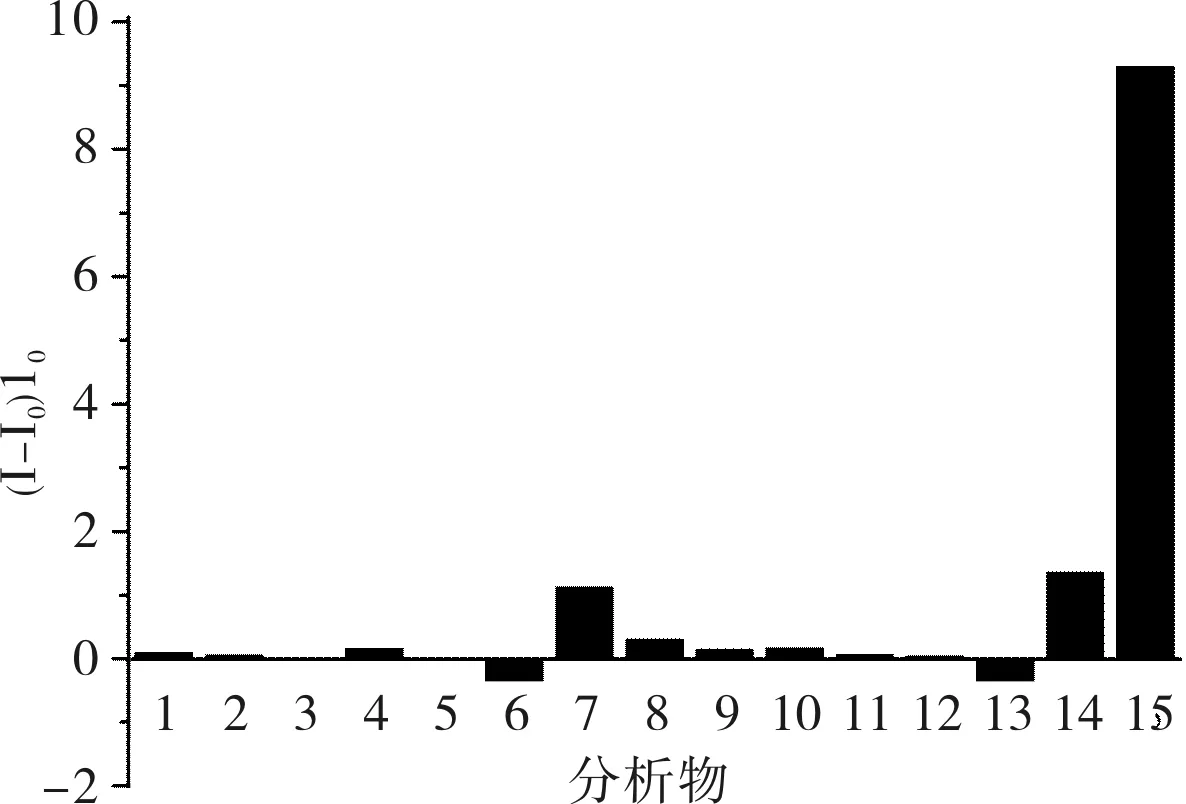
图4R6G/HP-β-CD@rGO体系对15种分析物的荧光恢复率谱图(R6G浓度为2.0μmol·L-1)
Fig.4ThefluorescencerecoveryratiospectraofR6G/HP-β-CD@rGOsystemforfifteenkindsofanalytes(R6Gconcentrationwas2.0μmol·L-1)
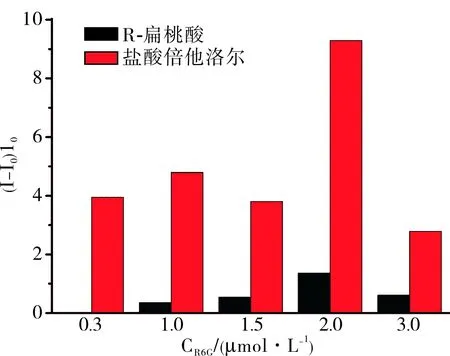
图5在R6G浓度分别为0.3、1.0、1.5、2.0和3.0μmol·L-1下,R6G/HP-β-CD@rGO体系对R-扁桃酸和盐酸倍他洛尔检测的荧光恢复率谱图
Fig.5FluorescencerecoveryratiospectraofR6G/HP-β-CD@rGOsystemforR-mandelicacidandbetaxololhydrochloride(R6Gconcentrationwas0.3,1.0,1.5,2.0,3.0μmol·L-1respectively)
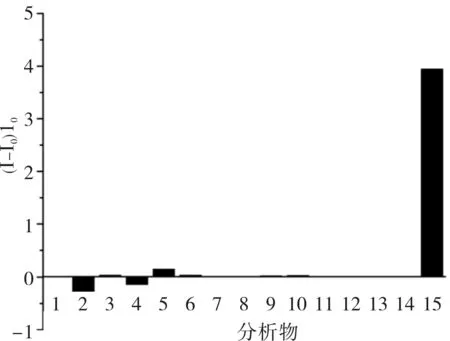
图6R6G/HP-β-CD@rGO体系对15种分析物的荧光恢复率谱图(R6G浓度为0.3μmol·L-1)
Fig.6ThefluorescencerecoveryratiospectraofR6G/HP-β-CD@rGOsystemforfifteenkindsofanalytes(R6Gconcentrationwas0.3μmol·L-1)
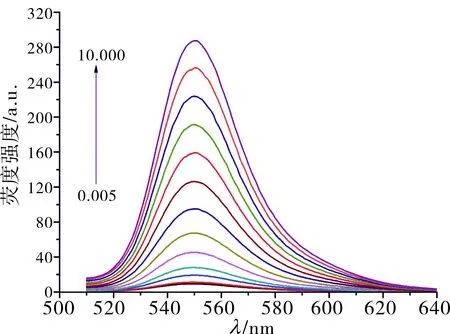
图7R6G/HP-β-CD@rGO荧光传感器对不同浓度盐酸倍他洛尔的荧光光谱图
Fig.7FluorescencespectraofR6G/HP-β-CD@rGOfluorescencesensorfordifferentconcentrationsofbetahlopinehydrochloride
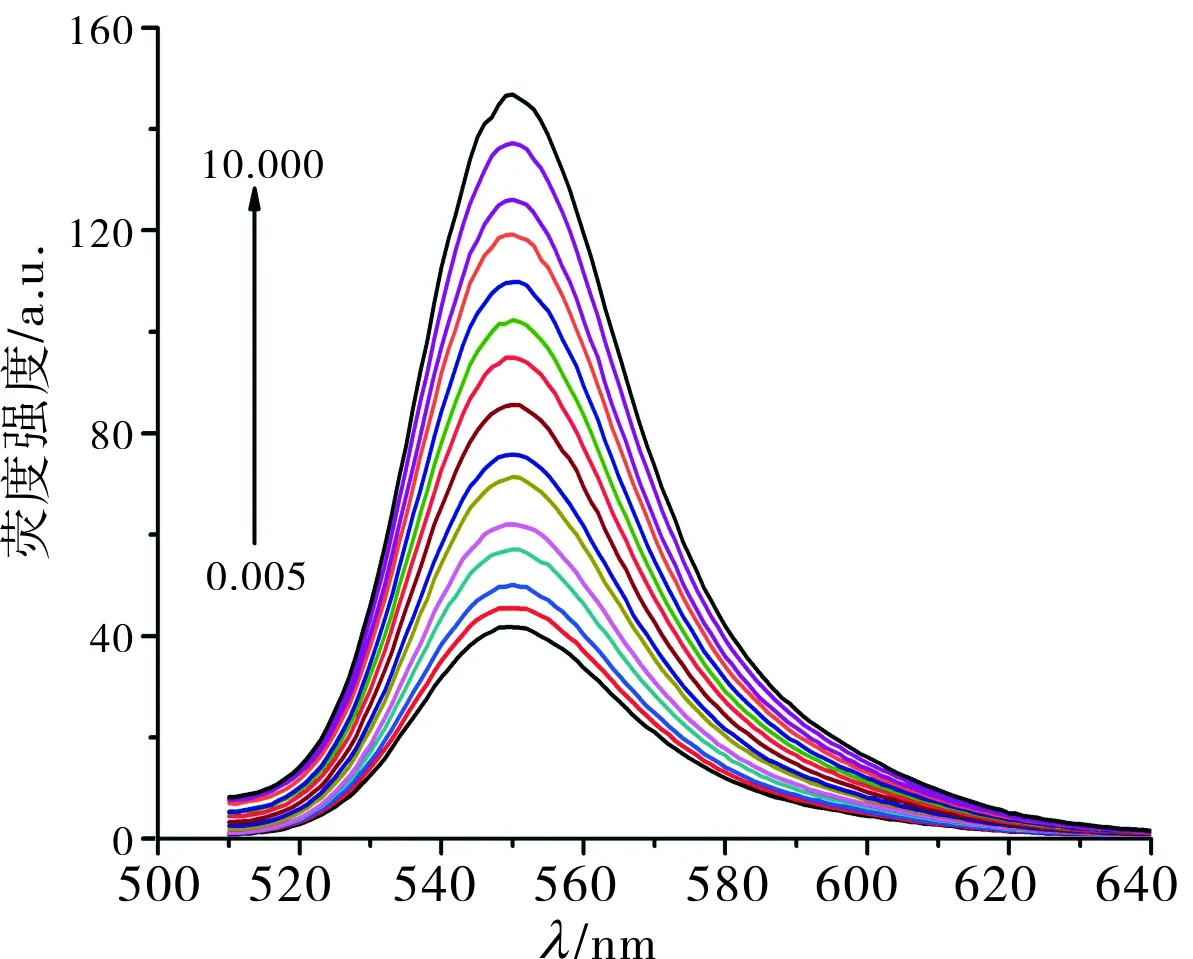
图8R6G/β-CD-@rGO荧光传感器对不同浓度盐酸倍他洛尔的荧光光谱图
Fig.8FluorescencespectraofR6G/β-CD@rGOfluorescencesensorfordifferentconcentrationsofbetahlopinehydrochloride
3 讨论
本研究建立了R6G/β-CD@rGO和R6G/HP-β-CD@rGO 2种荧光传感器,实现了对盐酸倍他洛尔的识别和检测(图9)。通过改变R6G浓度,在牺牲部分灵敏度的情况下,可以提升盐酸倍他洛尔的检测专属性,而其他14种物质几乎无干扰。在各自优化的实验条件下,二者均可以快速和灵敏地识别和检测盐酸倍他洛尔,均具有一定的抗干扰能力。R6G/HP-β-CD@rGO的检测灵敏度优于R6G/β-CD@rGO,通过实验条件的调整,可以实现对盐酸倍他洛尔的高专属性识别和检测。R6G/HP-β-CD@rGO荧光传感器对盐酸倍他洛尔的检测线性范围为1.0~10.0 μmol·L-1,R6G/β-CD-@r-GO荧光传感器对盐酸倍他洛尔的检测线性范围为0.25~10.00 μmol·L-1,通过对比2种传感器对盐酸倍他洛尔检测的线性范围可发现,虽然R6G/β-CD@rGO对盐酸倍他洛尔的检测线性范围较宽,但R6G/HP-β-CD@rGO对盐酸倍他洛尔检测限更低,且荧光恢复率较高,灵敏度较好。
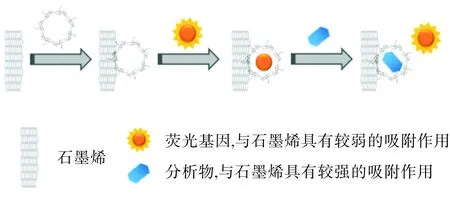
图9检测原理图
Fig.9Detectionschematicdiagram
参考文献:
[1] WANG Y,LI Z,WANG J,etal.Graphene and graphene oxide:biofunctionalization and applications in biotechnology[J].TrendsBiotechnol,2011,29(5):205-212.
[2] TANG Z,WU H,CORT J R,etal.Constraint of DNA on functionalized graphene improves its biostability and specificity[J].Small,2010,6(11):1205-1209.
[3] CHEN D,TANG L,LI J.Graphene-based materials in electroche-mistry[J].ChemSocRev,2010,39(8):3157-3180.
[4] ZHAO X H,MA Q J,WU X X,etal.Graphene oxide-based biosensor for sensitive fluorescence detection of DNA based on exonuclease III-aided signal amplification[J].AnalChimActa,2012,727:67-70.
[5] ZHANG Y,LIU Y,ZHEN S J,etal.Graphene oxide as an efficient signal-to-background enhancer for DNA detection with a long range resonance energy transfer strategy[J].ChemCommun,2011,47(42):11718-11720.
[6] LU C H,LI J,LIU J J,etal.Increasing the sensitivity and single-base mismatch selectivity of the molecular beacon using graphene oxide as the "nanoquencher"[J].Chem-EurJ,2010,16(16):4889-4894.
[7] LI J,LU C H,YAO Q H,etal.A graphene oxide platform for energy transfer-based detection of protease activity[J].BiosensBioelectron,2011,26(9):3894-3899.
[8] ZHANG C,YUAN Y,ZHANG S,etal.Biosensing platform based on fluorescence resonance energy transfer from upconverting nanocrystals to graphene oxide[J].AngewChemIntEd,2011,50(30):6851-6854.
[9] CHANG H,TANG L,WANG Y,etal.Graphene fluorescence resonance energy transfer aptasensor for the thrombin detection[J].AnalChem,2010,82(6):2341-2346.
[10] HE Y,LIN Y,TANG H,etal.A graphene oxide-based fluorescent aptasensor for the turn-on detection of epithelial tumor marker mucin 1[J].Nanoscale,2012,4(6):2054-2059.
[11] HUANG S T,SHI Y,LI N B,etal.Fast and sensitive dye-sensor based on fluorescein/reduced graphene oxide complex[J].Analyst,2012,137(11):2593-2599.
[12] KONKENA B,VASUDEVAN S.Covalently linked,water-dispersible,cyclodextr-in:reduced-graphene oxide sheets[J].Langmuir,2012,28(34):12432.
[13] GUO Y,GUO S,LI J,etal.Cyclodextrin-graphene hybrid nano-sheets as enhanced sensing platform for ultrasensitive determination of carbendazim[J].Talanta,2011,84(1):60-64.
[14] MONDAL A,JANA N R.Fluorescent detection of cholesterol using β-cyclodextrin functionalized graphene[J].ChemCommun,2012,48(58):7316-7318.
