掺杂硅的羟基磷灰石负载骨形态发生蛋白-2活性多肽在大鼠颅骨缺损修复中的作用
2018-05-23仇志学单中书李国栋刘立民
仇志学 单中书 李国栋 刘立民
(青海省人民医院骨科,青海 西宁 810007)
骨缺损主要病因有创伤、感染、肿瘤及各种先天性疾病等。骨缺损较小时一般可自行愈合,但当骨缺损较大时则需要手术治疗〔1~3〕。组织工程骨技术即利用组织工程手段,使得缺损部位具有成骨能力的细胞进行生长,引导骨组织再生,构建培育新生骨组织以填补骨缺损实现骨性愈合与良好修复。骨形态发生蛋白(BMP)-2是诱导骨细胞生成的重要因子〔4,5〕。但是由于BMP-2含量甚微,生产工艺复杂,所以无法大量提纯,另外,BMP-2仅能作为一种诱导刺激物,使未分化间充质细胞向骨系细胞转化成骨,却无支架和充填缺损作用,因而使其临床应用受到限制。羟基磷灰石(HAP)是一种磷酸钙类天然骨矿,相容性良好,是骨组织的主要成分,但其脆性较大,不利于骨缺损修复,为此可掺杂其他天然衍生物或高分子成分以提高其强度。研究者〔6〕通过钛掺杂合成了具有良好烧结稳定性的HAP纳米粉,钛掺杂对HAP的烧结稳定性、晶粒尺寸和形貌有显著影响。有研究〔7〕采用钛掺杂HAP/氧化锆复合材料,抑制了HAP与氧化锆之间的热反应,把钛离子掺入HAP的晶格,使其表现出良好的相稳定性。而硅(Si)是人体骨骼必需的材料,在早期可促进骨的矿化,能有效促进骨的修复。近年来采用冻干法制备含Si的HAP支架得到临床的广泛重视。本研究采用Si代HAP(Si-HAP)负载BMP-2活性多肽P28修复大鼠颅骨缺损,探究其有效性。
1 资料与方法
1.1合成P28 P28从BMP-2的肽73~92关节位表中提取后利用FMOC/TBU固相肽合成法合成,并将初始合成得到粗肽多次通过凝胶过滤层析得到进一步纯化,最后高效液相色谱法(HPLC)测定P28 纯度≈96.8%。
1.2制备及观察Si-HAP 共同沉淀法合成法:先将270 ml硝酸钙与正硅酸乙烯溶液相混合而成,后再将300 ml 0.06 mol/L(NH4)H2PO4溶液加入到混合物中。钙与磷的比例保持在1∶1.65,且Si与钙的比例会因加入不同正硅酸乙烯在1%~10%间变化。所有的反应需保持温度在80℃且pH值在9~10之间可用的铵溶液。3 h后,所有已获得的沉淀通过过滤和蒸馏水的洗涤从这些溶液中分离。然后将Si-HAP纳米粒子放在80℃的烤箱中过夜以干燥。使用电子扫描显微(SEM) 观察Si-HAP形态,为了使得制备得到Si-HAP具有更好的导电性,所有的样品都用10 nm厚的Au薄膜覆盖后使用扫描电子显微镜来检查涂层的形态,锌与钙的比例使用能量色散光谱仪来测定。
1.3制备复合材料 分别将100 mg HAP和Si-HAP预湿后加入纯乙醇放入搅拌机内轻搅200 r/min×2 h,然后使用轨道振动筛使其和10 mg P28复合,静置合成后的物料,待其干燥前用去离子水清除乙醇。所有材料完全去除乙醇后于-20℃下冷存备用。
1.4实验动物 选取6~8 w SD雄性大鼠30只(华中科技大学同济医学院动物中心提供,动物许可证编号HB20140014),体重200~250 g,二级清洁,健康,饲养于清洁级环境下。采用随机数字表法分为A、B、C组各10只,A组为空白对照组、B组HAP+P28修复、C组Si-HAP+P28修复。
1.5外科处理 B组、C组采用10%水合氯醛腹腔注射进行麻醉,手术区被毛,消毒铺巾,于大鼠颅骨正中纵向行1.5 cm切口,暴露颅骨,钻孔形成一直径5 mm的圆形缺损,将HAP+P28植入B组缺损处和将Si-HAP+P28植入C组缺损处,A组不做处理。用生理盐水冲洗后逐层缝合伤口。分别观察记录3组术后第6、12周的一般情况、影像学检查及组织学检查结果。
1.6CT图像评价 术后6~12 w,每组取5只大鼠注射过量戊巴比妥钠处死后将颅骨摘除,使用三维CT重建术扫描大鼠颅骨观察是否形成新骨,仪器采用德国西门子SOMATOM sensation 64排螺旋CT,通过图像辅助处理软件对CT图像进行颅骨缺损修复比例的判断。
1.7解剖组织学观察 将获取颅骨浸泡于10%甲醛溶液中,加入10%乙二胺四乙酸(EDTA)并调整pH值为7.0,于4℃下保存3 w进行完全脱钙,取出脱水和后,石蜡包裹颅骨,使用自动切片机取厚度约5 mm切片,后使用苏木素-伊红(HE)染色后使用光学显微镜观察并拍片,使用计算机图像分析系统测量片内骨形成量。图像系统为HPIAS21000 高清晰度图像处理系统,购自武汉千屏影像技术有限责任公司。
1.8统计学方法 采用SPSS17.0统计软件进行t、χ2检验。
2 结 果
2.1一般情况比较 实验前各组周龄和体重差异无统计学意义(P>0.05)。大鼠经手术后,生命体征均正常,没有发生实验过程中死亡。植入部位没有发生感染,无化脓、溃破等情况。
2.2影像学指标比较 术后6 w,A组CT影像显示缺损处新骨生成情况较差,修复比例为12.7%,B组颅骨缺损处新骨生成情况明显,修复比例为66.5%,C组缺损处基本被新骨覆盖,修复比例为95.8%,3组组间差异有统计学意义(P<0.05);12 w后,A组修复比例为37.2%,B组97.8%,C组100%,B组和C组修复效果相似,显著优于A组(P<0.05),见图1。
2.3组织学观察比较 术后6 w,C组颅骨缺损处生成大量的成纤维细胞和肉芽组织,软组织恢复情况良好。B组存在生物材料退化和分散的骨样组织。而A组则更为明显,软组织坏死面积较大呈现黑色;术后12 w,C组颅骨骨小梁形成紧凑骨组织,且肉芽组织转化为纤维组织将修复植入物完全包裹,缺损处肌肉组织和正常肌肉组织同样平滑细腻。B组颅骨恢复仅剩下带状缺损及软组织坏死,恢复效果较好。A组仍残留较大坏死软组织,缺损处无明显骨形成,见图2。

图1 3组6、12 w颅骨缺损修复CT扫描图
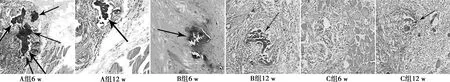
图2 3组术后6、12 w缺损处形态学(HE,×400)
3 讨 论
近年来,骨缺损的修复逐渐成为骨组织工程领域的热点〔8〕。自体骨由于一方面具有天然骨的正常生理结构,另一方面含有促进骨组织修复再生的细胞与生长因子,因而被认为是进行骨缺损修复最理想的材料〔9〕。但由于存在自体骨与缺损骨形态不一致、取骨量受到限制及骨吸收过程的不确定性等原因,使其尚未能广泛应用于临床〔4〕。而组织工程骨则可突破上述限制,通过人体组织工程制备出具有良好的骨诱导活性、骨传导性、骨降解性及免疫排斥性较低的人工骨材料〔2〕。
在骨组织工程中,BMP、碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)等均具有诱导骨细胞及软骨细胞生成的作用,由于BMPs是骨形成过程中的三种促进因子之一,它们在生物体的生长过程中起着重要的调控作用。BMP-2的骨诱导活性最强〔10〕。BMP-2是一种多功能生长因子,属于转化生长因子超家族成员,是最重要的骨形成调控因子〔11〕。BMP-2可通过刺激骨髓基质未分化的间充质细胞,促进其黏附、体外增殖及定向分化为成骨前体细胞,形成软骨内成骨,从而诱导新生骨组织形成〔12〕。但是BMP-2在体内半衰期一般小于16 min,降解速度极快〔13〕。则临床应用中需选择性能优良的缓释载体负载BMP-2,使BMP-2在体内缓慢释放,从而能长时间发挥骨缺损的修复作用,提高机体对BMP-2的利用率〔14〕。性能优良的缓释载体不仅需要具备强大的缓释能力,还需要具有诱导成骨细胞黏附增值的能力〔15〕,单一的生物材料难以满足上述条件,为此复合材料成为骨组织工程技术优先考虑的材料。
研究显示,HAP是天然骨组织矿物质成分,具有较高的组织相容性,对某些化学分子及蛋白质具有较高亲和力,具有较强的诱导骨生成的能力〔16〕。但由于HAP与骨组织的整合速率及反应性较低,从而延长了骨缺损修复时间〔17〕。为了优化HAP的临床性能,研究人员发现在HAP中掺杂某些微量元素,如Si〔18〕。Si离子的掺入可改变HAP的表面晶型,增强HAP的骨活性,可显著提高HAP诱导骨细胞和软骨细胞增殖生成的能力和速度,并且可提升骨组织的抗菌能力〔19〕。研究〔20〕表明,与适宜的载体复合来修复骨缺损比单用BMPs或单用其载体本身诱导成骨的效果更好。该生长因子能诱导植入区周围未分化的间充质细胞形成软骨和新生骨,促进成骨细胞分化成熟,参与骨和软骨生长发育及其重建过程,进而加速骨缺损修复。通过该工艺控制制备出的P28经过发酵、分离、纯化后得到的样品可保持很高的纯度,消除了潜在的病源传播危险,展示出美好的应用前景。在人重组BMP-2化学结构基础上自行设计合成的相关活性多肽P28能够发挥与其相同的特异性与骨结合促进成骨的作用。研究发现〔20〕,P28的生物效应是通过其分子的抗原决定族与细胞膜上的受体形成异聚复合物来实现的,而P28短链多肽可以通过多肽合成仪大规模制备,降低了成本,提高材料的安全性。同时,短链多肽上与细胞表面受体结合的活性位点能够充分暴露,具有更强的生物活性,其可以增强材料的骨诱导性和生物相容性,为P28活性多肽复合物的开发及应用创造了条件。有学者〔21〕证实了P28活性多肽具有体外定向诱导大鼠骨髓间充质干细胞(BMSC)向成骨方向定向分化的作用,且这种诱导作用具有剂量依赖性,高分子聚合材料复合该多肽后具有骨诱导活性,增强成骨能力。
Si的加入的确可以改变复合材料的临床性能。可能与Si的强化作用大大提高了力学性能、显著促进成骨细胞的增殖和分化有关〔19〕。P28可促进骨骼生产及生长原因可能包括如下:①P28中包含有BMP序列内能够诱导成骨分化关键基因片段,能够促使骨骼祖细胞分化;2P28分子量更小,且由于是人工合成,其机构更加稳定,有效克服BMP-2因其复杂结构而导致部分活性位点难以暴露的劣势;③P28氨基酸序列内含有多种脯氨酸,且其是生物体皮肤、牙齿、骨骼、关节内胶原蛋白的重要组成部分。本研究显示p28结合Si-HAP细胞信号可明显加快颅骨成骨能力。
综上所述,掺杂Si的HAP负载BMP-2活性多肽修复材料是一种理想的生物支架、缓释载体和修复材料〔22〕。但本研究尚为小样本动物实验,其结果外推到人体尚存在一定的不确定性,并且对于Si是如何提高HAP性能等机制尚未阐明。
4 参考文献
1Costa JJ,Passos MJ,Leitão CC,etal.Levels of mRNA for bone morphogenetic proteins,their receptors and SMADs in goat ovarian follicles grown in vivo and in vitro〔J〕.Reprod Fertil Dev,2012;24(5):723-32.
2Saito A,Suzuki Y,Kitamura M,etal.Repair of 20 film long rabbit radial bone defects using BMP-derived peptide combined with an alpha-tricalcium phosphate scaffold〔J〕.J Biomed Mater Res A,2006;77(4):700-6.
3Kirker-Head C,Karageorgiou V,Hofmann S,etal.BMP-silk composite matrices heal critirally sized femoral defects〔J〕.Bone,2007;41(6):247-55.
4Saito A,Suzuki Y,Ogata S,etal.Activation of osteo-progenitor cells by a novel synthetic peptide derived from the bone morphogenetic protein-2 knuckle epitope〔J〕.Biochim Biophys Acta,2003;1651(1-2):60-7.
5Tsumaki N,Yoshikawa H.The role of bone morphogenetic proteins in endochondral bone formation〔J〕.Cytok Growth Factor Rev,2005;16(3):279-85.
6Kim IS,Song YM,Cho TH,etal.In vitro response of primary human bone marrow stromal cells to recombinant human bone morphogenic protein-2 in the early and late stages of osteoblast differentiation〔J〕.Dev Growth Differ,2008;50(7):553-64.
7王莉丽, 王秀峰, 江红涛, 等. 钛掺杂对羟基磷灰石烧结稳定性和晶粒尺寸的影响〔J〕.功能材料,2015;19(46):19052-5.
8Xu L,Lv KG,Zhang WJ,etal.The healing of critical-size calvarial bone defects in rat with rhPDGF.BB,BMSCs,and 13-TCP scaffolds〔J〕.J Mater Sci Mater Med,2012;23(4):1073-84.
9Shen JY,Chart Park MB,He B,etal.Three-dimensional microchannels in biodegradable polymeric films for control orientation and phenotype of vascular smooth muscle cells〔J〕.Tissue Eng,2006;12(8):2229-40.
10Rose FR,Oreffo RO.Bone tissue engineering:hope vs hype〔J〕.Biochem Biophys Res Commun,2002;292(1):1-7.
11LeGeros RZ.Properties of osteoconductive biomaterials:calcium phosphates〔J〕.Clin Orthop Relat Res,2002;39(5):81-98.
12Yuan Q,Lu HW,Tang S,etal.Ectopic bone formation in vivo induced by a novel synthetic peptide derived from BMP-2 using porous collagen scaffolds〔J〕.J Wuhan Univ Technol,2007;32(3):701-5.
13Urist MR.Bone:formation by autoinduction〔J〕.Science,1965;150(698):893-9.
14Han DK,Kim CS,Jung UW,etal.Effect of a fibrin fibronectin sealing system as a carrier for recombinant human bone morphogenetic protein-4 on bone formation in rat calvarial defects〔J〕.J Periodontol,2005;76(12):2216-22.
15Urist MR,Mikulski A,Lietze A.Solubilized and insolubilized bone morphogenetic protein〔J〕.Proc Natl Acad Sci U S A,1979;76(4):1828-32.
16Li JF,Lin ZY,Zheng QX,etal.Bone formation in ectopic and osteogenic tissue induced by a novel BMP-2-related peptide combined with rat tail collagen〔J〕.Biotechnol Bioprocess Engineer,2010;15(2):725-32.
17Lin ZY,Duan ZX,Guo XD,etal.Bone induction by biomimetic PLGA-(PEG-ASP)n copolymer loaded with a novel synthetic BMP-2-related peptide in vitro and in vivo〔J〕.J Control Release,2010;144(2):190-5.
18Li JF,Liu ZY,Zheng QX,etal.Repair of rabbit radial bone defects using true bone ceramics combined with BMP-2-related peptide and type I collagen〔J〕.Mater Sci Engineer C,2010;30(2):1272-9.
19Li JF,Liu ZY,Zheng QX,etal.Repair of rat cranial bone defects with nHAC/PLLA and BMP-2-related peptide or rhBMP-2〔J〕.J Orthop Res,2011;23(6):1745-52.
20徐靖宏.rhBMP-2复合载体骨骼肌异位成骨修复下颌骨缺损探讨〔D〕.上海:上海第二医科大学,2003.
21段智霞,郑启新,郭晓东,等.BMP-2活性多肽体外定向诱导大鼠BMSCs向成骨方向分化的实验研究〔J〕.中国矫形外科杂志, 2007;15(21):1647-50.
22Tang S,Zhao J,Xu S,etal.Bone induction through controlled release of novel BMP-2-related peptide from PTMC11-F127-PTMC11hydrogels〔J〕.Biomed Mater,2012;7(1):015008.
