缺氧诱导因子-1α、同型半胱氨酸、胱抑素C与2型糖尿病性眼肌麻痹的相关性研究
2018-05-22张彬彬薛天宇
于 敏,张彬彬,薛天宇
(大连市第三人民医院 神经内科, 辽宁 大连 116033)
糖尿病周围神经病变作为糖尿病最常见的慢性并发症之一,发病率较高,影响着多达 50%的糖尿病患者,是糖尿病致残率甚至死亡率增加的一个主要原因[1],而糖尿病性眼肌麻痹为糖尿病神经病变并发症之一。目前研究认为,缺氧诱导因子1α(HIF-1α)、同型半胱氨酸(Hcy)、胱抑素C(CysC)参与了糖尿病眼肌麻痹的发生、发展。本文通过观察糖尿病性眼肌麻痹患者HIF-1α、Hcy、CysC水平的关系,旨在探讨三者在糖尿病眼肌麻痹发病机制中的作用及意义。
1 资料与方法
1.1 一般资料
选择大连市第三人民医院2015年1月至2016年12月神经内科、内分泌科住院的2型糖尿病患者120例,采用病例-对照方法研究,根据是否合并糖尿病眼肌麻痹,将120例2型糖尿病患者分为两组,其中2型糖尿病性眼肌麻痹组(A组,60例,其中男28例,女32例)、2型糖尿病组(B组,60例,男30例,女30例)。另选同期健康体检者为对照组(NC组,60例,男30例,女30例)。病例入选标准:(1)糖尿病性眼肌麻痹:排除感染、中毒、动脉瘤、重症肌无力、颅内占位、脑卒中及眼科检查等其他病因所致眼肌麻痹,而确诊为糖尿病性眼肌麻痹。(2)2型糖尿病诊断标准采用1999年世界卫生组织(WHO)糖尿病诊断标准:糖尿病症状加任意时间血浆葡萄糖≥11.1 mmol/L,或FBG≥7.0 mmol/L,或OGTT 2 h PG≥11.1 mmol/L。告知本研究的内容及目的并签署知情同意书。
1.2 方 法
记录性别、年龄、病程、测量身高、体重、血压,并计算体重指数(BMI)=体重(kg) /身高(m2)。素食,避免茶、咖啡等有色饮料,避免剧烈运动3 d,试验前1天禁食12~14 h后,于第2天清晨空腹静息状态下抽取静脉血,采用日立7600-020全自动生化分析仪测定糖化血红蛋白(HbAlc)、空腹血糖(FBG )、总胆固醇(CHO)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c),采用酶联免疫法测定HIF-1α浓度、高效液相色谱法测定血清Hcy浓度、免疫比浊法测定血清胱抑素C指标(CysC)。
1.3 统计学方法
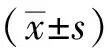
2 结 果
2.1 组间临床资料比较
A、B组的血清HIF-1α、Hcy、CysC 浓度高于NC组,其中A 组的血清HIF-1α低于B组, A 组的血清Hcy、CysC高于B组,均具有统计学差异,P均<0.05,各组一般资料比较除空腹血糖(FBG)和糖尿病史外,其他指标差别均无统计学意义 (P>0.05)。见表1。

表1 各组间一般资料及 HIF-1α、Hcy、CysC 浓度的比较
1) 与 NC组比较,P<0.05;2)与B组比较,P<0.05。BMI: 体重指数;CHO:胆固醇;TG:甘油三酯;LDL:低密度脂蛋白胆固醇;HDL:高密度脂蛋白胆固醇;FBG:空腹血糖;HbA1c:糖化血红蛋白;HIF-1α:α缺氧诱导因子-1α;Hcy:同型半胱氨酸;CysC:胱抑素C
2.2 多元回归分析
HIF-1α与病程、HbA1c、FBG呈显著负相关,Hcy与病程、HbAlc、FBG、CysC呈正相关,CysC 与病程、Hcy 呈正相关,P均<0.05,差异有统计学意义。见表2~4。
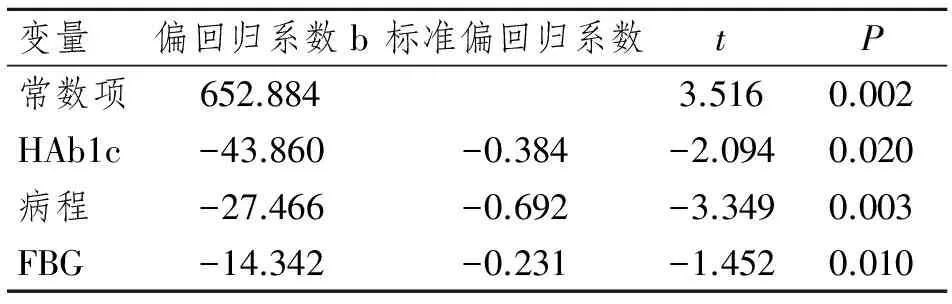
表2 影响 HIF-1α 的多元逐步回归分析

表3 影响Hcy的多元逐步回归分析

表4 影响CysC的多元逐步回归分析
2.3 危险因素分析
糖尿病病程≥5年,HbA1c≥7%,Hcy≥10 μmol/L,CysC≥1 mg/L是糖尿病眼肌麻痹的危险因素。OR值分别为1.341(95%CI=1.166-1.647),1.254(95%CI=1.219-1.458),1.589(95%CI=1.478-1.612),1.474(95%CI=1.291-1.552),P均<0.05。见表5。
3 讨 论
糖尿病发病早期即存在组织缺血缺氧[2-5],而缺血缺氧在糖尿病眼肌麻痹、糖尿病周围神经病变及糖尿病其它慢性并发症中发挥着重要的作用。HIF-1α是调节细胞内氧代谢的关键因子之一,也是迄今为止发现的唯一能在特异性缺氧状态下发挥自变量赋值为糖尿病病程≥5年=1,<5年=0;HbA1c≥7%=1,<7%=0;Hcy≥10 μmol/L=1,<10 μmol/L=0;CysC≥1 mg/L=1,<1 mg/L=0
活性的转录因子,能对细胞的缺氧起稳定作用[6-7]。有研究表明,HIF-1α在糖尿病周围神经病变的发展过程中具有一定作用[8-9],而糖尿病性眼肌麻痹是糖尿病神经病变并发症之一,HIF-1α可能也参与了糖尿病眼肌麻痹的发展。研究发现,缺血/缺氧的程度可以诱导不同的效应,轻、中度缺氧时,HIF-1α的复合物稳定,引起VEGF、EPO等具有神经保护作用的靶基因表达[10-11],增强神经细胞对缺氧的适应力。但在严重缺氧时,HIF-1α使细胞内的p53、BNIP3等水平增高,导致神经毒性[12]。故推测,在糖尿病眼肌麻痹早期HIF-1α可以增强神经细胞对缺氧的适应力,对疾病的发展起一定保护作用,而随着糖尿病病程的延长、缺氧的加重,HIF-1α可诱导p53及BNIP3等凋亡基因造成神经细胞损伤以及神经功能受损表现细胞毒性。在本研究中糖尿病各组(A 组、B 组)的血清HIF-1α浓度高于健康对照组(NC组),也不除外随着缺氧的加重,HIF-1α已对神经细胞产生了毒性作用,进而使糖尿病眼肌麻痹加重。但目前对于缺氧程度及持续时间所致HIF-1α介导的神经细胞保护抑或毒性的分界尚缺乏进一步研究。另有研究表明,糖尿病病程、高血糖对 HIF-1α具有短期升高,逐渐抑制的作用。本研究中,糖尿病眼肌麻痹组(A 组)的血清HIF-1α低于单纯糖尿病组(B组),且通过多元回归分析表明与病程、HbA1c、FBG呈负相关,与研究报道相符。提示血清HIF-1α参与了糖尿病眼肌麻痹的发生、发展中的病理生理过程,其作用机制相似。

表5 Logistic 回归分析各危险因素与糖尿病性眼肌麻痹的关系
Hcy与动脉粥样硬化密切相关,是引起大血管病变的独立危险因素。最近有研究表明,Hcy与糖尿病周围神经病相关,高水平Hcy能引起氧化应激,损伤血管内皮细胞,影响神经髓鞘蛋白代谢,加重神经病变。给予叶酸和B族维生素降低Hcy水平,可以缓解临床症状[13-14]。CysC通过抑制Hcy分解过程中酶的活性,从而升高Hcy浓度,并与Hcy、组织蛋白酶等相互作用,参与糖尿病血管病变、神经病变的病理过程[15]。本文中糖尿病各组(A 组、B 组)的血清Hcy、CysC 浓度高于健康对照组(NC组),且糖尿病眼肌麻痹组(A 组)血清Hcy、CysC高于单纯糖尿病组(B组),提示血清Hcy与CysC可能通过相互作用共同参与了糖尿病眼肌麻痹的病理变化过程。
综上所述,本研究通过检测HIF-1α、Hcy、CysC水平,及其影响因素,分析糖尿病眼肌麻痹的危险因素,探讨HIF-1α、Hcy及CysC与糖尿病眼肌麻痹的关系和作用机制,为糖尿病眼肌麻痹的防治提供新的切入点。另外,本临床研究提示早期适量的HIF-1α对2型糖尿病及糖尿病性眼肌麻痹有保护作用,而长期、过量的 HIF-1α会加重疾病的发生、发展,目前本研究未作出HIF-1α对神经细胞保护抑或毒性分界的定量研究,尚有待于更大样本的分层队列试验和多因素回归分析。
参考文献:
[1] Tesfaye S, Selvarajah D. Advances in the epidemiology, pathogenesis and management of diabetic peripheral neuropathy[J]. Diabetes Metab Res Rev,2012,28:8-14.
[2] Wang JJ, Zhang SX, Mott R, et al. Anti-inflammatory effects of pigment epithelium-derived factor in diabetic nephropathy[J]. Am J Physiol Renal Physiol, 2008, 294(5): F1166-F1173.
[3] 郑全林, 徐向进. 缺氧诱导因子-1α与糖尿病慢性血管并发症[J]. 实用医学杂志, 2009, 25(4): 671-672.
[4] Yamada N, Horikawa Y, Oda N, et al. Genetic variation in the hypoxia-inducible factor-1alpha gene is associated with type 2 diabetes in Japanese[J]. J Clin Endocrinol Metab, 2005, 90(10): 5841-5847.
[5] Leiherer A, Geiger K, Muendlein A, et al. Hypoxia induces a HIF-1α dependent signaling cascade to make a complex metabolic switch in SGBS-adipocytes[J]. Mol Cell Endocrinol, 2014, 383(1-2):21-31.
[6] Ortega A, Fernández A, Arenas MI, et al. Outcome of acute renal injury in diabetic mice with experimental endotoxemia: role of hypoxia-inducible factor-1 α[J]. J Diabetes Res, 2013, 2013: 254529.
[7] Zepeda AB, Pessoa A Jr, Castillo RL, et al. Cellular and molecular mechanisms in the hypoxic tissue: role of HIF-1 and ROS[J]. Cell Biochem Funct, 2013, 31(6):451-459.
[8] Bento C F, Pereira P. Regulation of hypoxia-inducible factor 1 and the loss of the cellular response to hypoxia in diabetes[J]. Diabetologia, 2011, 54(8): 1946-1956.
[9] Xie L, Johnson RS, Freeman RS. Inhibition of NGF deprivation-induced death by low oxygen involves suppression of BIMEL and activation of HIF-1[J]. J Cell Biol, 2005, 168(6): 911-920.
[10] Mu D, Chang YS, Vexler ZS, et al. Hypoxia-inducible factor 1alpha and erythropoietin upregulation with deferoxamine salvage after neonatal stroke[J]. Exp Neurol, 2005, 195(2): 407-415.
[11] Yang P, Reece EA. Role of HIF-1α in maternal hyperglycemia-induced embryonic vasculopathy[J]. Am J Obstet Gynecol, 2011, 204(4): 332-331.
[12] Greijer AE, van der Wall E. The role of hypoxia inducible factor 1 (HIF-1) in hypoxia induced apoptosis[J]. J Clin Pathol, 2004, 57(10): 1009-1014.
[13]Bruce SG, Young TK. Prevalence and risk factors for neuropathy in a Canadian First Nation community[J]. Diabetes Care, 2008, 31(9): 1837-1841.
[14]李剑波,成玉泽,石敏,等.血浆同型半胱氨酸水平和糖尿病周围神经病变之间的关系[J].中华内科杂志,2011,50(1):14-17.
[15]Varga E, Seres I, Harangi M, et al. Serum cystatin C is a determinant of paraoxonase activity in hemodialyzed and renal transplanted patients[J]. Dis Markers, 2009, 26(3): 141-148.
