核酸适配体及其亲和力的表征方法*
2018-05-22曾家豫廖世奇
汪 靖 王 进 曾家豫 廖世奇
(西北师范大学生命科学学院 甘肃兰州 730070)
1 核酸适配体
核酸适配体(aptamer)是从人工构建的随机寡核苷酸文库中筛选出的与目标靶分子高亲和力、高特异性结合的SSDNA 或者RNA,一般由几十个核苷酸(20~60 nt)组成。其制备简单、稳定性好、靶分子范围广、易于修饰,且无免疫原性,被称为“化学抗体”。1990年Tuerk 等[1]首次在体外人工构建的随机寡核苷酸文库中筛选出和噬菌体T4DNA 聚合酶(gp43)特异性结合的RNA 配体,此后,核酸适配体已成熟发展为新一代靶分子特异性识别结合体,核酸通过自身形成的空间结构可以识别不同的分子靶标,包括碳水化合物、蛋白质、细胞、细菌、小分子与病毒等。筛选的适配体与靶标复合物的解离常数从低等微摩尔级到高等兆摩尔级[2],亲和力逐渐增强。适配体的应用也逐渐广泛,在生物医药、农用食品、环境等检测方面具有重要的实用意义。第1 个基于RNA 适配体的药物哌加他尼钠,在2004年12月已被美国FDA通过,目前正应用于老年黄斑变性患者[3]。
2 SELEX 技术
筛选核酸适配体主要采用体外指数富集的配基系统进化技术(SELEX),首先建立一个1012~1014库容量的随机寡核苷酸文库,将靶目标与该文库进行孵育,待靶标与核酸充分结合后,洗脱掉没有结合的核酸序列,并将结合靶标的核酸序列进行PCR 扩增,用于下一轮筛选。通过不断地结合、分离、洗脱与扩增,一些与靶标不结合或亲和力较弱的核酸相继被淘汰。而具有高亲和力的核酸适配体逐渐被富集起来。最后富集的文库通过测序获得特异性识别靶标的核酸适配体,并对适配体进行亲和力的检测。
3 核酸适配体亲和力的表征方法
3.1 细胞靶标核酸适配体亲和力的表征方法细胞适配体亲和力表征方法最常用的为流式细胞术,其优点是可以计算出靶细胞与适配体结合的平衡解离常数。流式细胞术是一种在液流系统中,能快速测定单个细胞或细胞器的生物学性质,并将特定的细胞或细胞器从群体中加以分类收集的技术,细胞的分选是通过分离含有单细胞的液滴而实现的。在流动室的喷口上配有一个超高频电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测定细胞就分散在这些液滴之中。将这些液滴充以正、负不同的电荷,当液滴流经带有几千伏特的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,不予充电的液滴落入中间的废液容器,从而实现细胞的分离。Ababneh 等[4]在体外筛选出CD44 肿瘤干细胞标志物的RNA 适配体Apt1,利用流式细胞术和荧光显微镜检查术的方法分析了适配体与肿瘤干细胞的结合特异性,荧光的不同强度反映CD44 在这些细胞表面的表达水平。Aptaker 等[5]将细胞重悬在PBS 溶液中利用流式细胞术定量分析了适配体与靶标神经胶质瘤相比较于和非癌或非胶质类型细胞的结合情况。通过共聚焦显微镜可以观察aptamers 的细胞摄入和定位分析。为了探讨胶质瘤细胞对aptamers 的选择性吸收是否为一个积极的过程,通过流式细胞仪测定了温度对细胞结合的影响。由于细胞与适配体结合之后,流式细胞仪收集细胞可能受到胰蛋白酶的威胁,会潜在地降低适配体结合在细胞表面受体的机率,所以温度在4℃为宜,并通过以下公式计算Kd值:

其中,Bmax=最大限度结合位点;Captamer=适配体的浓度。但是多数流式细胞仪只能测量一个细胞的总核酸量,总蛋白量等指标,而不能鉴别和测出某一特定部位的核酸或蛋白的多少,即它的细节分辨率为零。
3.2 小分子靶标核酸适配体亲和力表征方法小分子靶标包括一些不同基团组成的分子、含相同基团的同类分子和基团相同空间结构不同的手性分子。由于传统的核酸适配体Kd值测定需要固定靶标或核酸适配体,而对于小分子靶标,固定核酸适配体,面临着灵敏度的考验,因为小分子结合到核酸适配体引起的质量比较小;而固定小分子靶标,要通过化学修饰会影响亲和力的问题。小分子靶标核酸适配体的亲和力表征方法主要有以下几种方法。
3.2.1 超滤法(ultrafiltration) 超滤技术由于其成本低,速度快、灵敏度高而被普遍应用。应用孔径为1~20 nm 的超滤膜过滤含有大分子或微细粒子的溶液,使大分子或微细粒子从溶液中分离的过程。超滤膜一般选用硝酸纤维素膜,其使用形式以斑点杂交最多,主要是因为样品的消耗量少。硝酸纤维素膜上的孔径只允许游离的核酸适配体通过,而利用吸附作用将分子靶标截留。对截留下来的分子与滤液中的核酸适配体进行定量分析,利用平衡状态下各组分的平衡分布评估计算核酸适 配体的Kd值。Javed 等[6]筛选四环素的核酸适配体,通过平衡透析膜,滤液中只有游离SSDNA,而游离四环素和四环素-SSDNA 复合物会被截留在膜上。然而,超滤法的不足之处在于,硝酸纤维素膜不能完全保留核酸适配体-靶标复合物,从而导致过高估算Kd值,不完整的保留可能是由于核酸适配体与膜竞争靶分子的同一个结合位点。另外一个潜在的制约因素是,硝酸纤维素膜对核酸具有非特异性吸附,针对非特异性吸附的问题可以做没有靶分子的控制实验,并在计算结合分数时扣除吸附量。
3.2.2 荧光偏振法/荧光各向异性(fluorescence anisotropy/polarization;FA) 荧光各向异性是使用光谱多模制板阅读器与偏振光学测量的。在FA中,当高分子量成分被滴定到系统中时,分子量较低的成分通常被标记为荧光分子使各向异性最大化改变[7]。溶液中的荧光分子受偏振光激发,激发时如果分子保持静止,则发射的荧光仍有偏振性,如分子旋转或者翻转,发射荧光的偏振平面会不同于激发光偏振平面。所以荧光分子的各向异性和偏振性可以由以下方程表示:
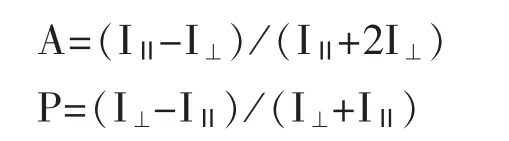
IⅡ表示与入射偏振光平行的发射光强度,I⊥表示与入射偏振光垂直的发射光强度。荧光各向异性和荧光偏振在物理数学上相似并可以互换。在实验过程中最重要的是选择一个荧光寿命与其旋转速度相匹配的荧光染料,荧光染料和核酸适配体之间的链接臂不宜太长,否则会使荧光染料的自由活动度增加,从而降低荧光标记分子偏振性的敏感度。
3.2.3 紫外光谱法与圆二色谱法(UV-Vis absorption/Circular Dichroism) 紫外光谱法可以根据核酸适配体与靶分子的最大吸收波长的强度变化计算结合常数,是一种简单、成本低廉、较准确检测技术。一般需要在筛选出的Aptamer 的5′端进行FAM 荧光标记,然后再进行荧光强度的检测[8]。根据核酸适配体或其靶分子的最大吸收波长的强度变化计算结合常数。圆二色谱法(circular dichroism,CD)是利用平面偏振光研究溶液中DNA、靶分子的二级和三级结构的一种方法。由于光学活性物质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数(ε)是不相等的,εL≠εR,即具有圆二色性。如果以不同波长的平面偏振光的波长λ为横坐标,以吸收系数之差Δε=εL-εR 为纵坐标作图,得到的图谱即是圆二色光谱,简称CD。如果某手性化合物在紫外可见区域有吸收,就可以得到具有特征的圆二色光谱。在紫外可见光区域测定圆二色谱与旋光谱,可以推断分子的构型和构象。DNA 的圆二色谱是由其骨架结构中的不对称糖分子和由这些糖分子的构型决定的螺旋结构产生的。根据靶分子对原有的DNA 圆二色谱信号的影响,以及诱导产生的圆二色谱新信号的不同特点,不仅可以得知靶分子与DNA 具有相互作用,还可以推断靶分子与DNA 结合的不同模式。这2 种方法被广泛用于研究核酸适配体-靶标的相互作用。利用这2 种方法测定出的适配体解离常数一般都在(100±30)nmol/L。
3.3 细菌靶标核酸适配体亲和力表征方法 细菌靶标适配体的筛选,一般需要先将靶标灭活,再分离纯化菌体表面的蛋白质、多糖分子,并以这些大分子作为靶标进行筛选,或者直接以全细胞菌体为靶标筛选适配体。所以细菌靶标筛选的方法类似于小分子,全细胞靶标的筛选,而筛选出的适配体进行亲和力表征方法也类似于上述细胞,以及小分子靶标的亲和力表征方法,主要有:①紫外光谱法[9]:将适配体与靶标的孵育混合物通过离心等方法分离后,使用荧光光谱仪测定核酸靶标复合物的荧光强度;②流式细胞仪法[10]:将孵育之后的复合物通过流式细胞仪,测定带有荧光标记的适配体-靶标复合物的数量;③表面等离子体共振法[11]:可以直接检测适配体与靶标的结合状态,并能利用同种不同来源的菌株,或者不同种属的其他细菌来检测适配体的特异性。一般与靶标的亲和力越强,表明其特异性越强,与其他细菌的结合力很弱。适配体用于细菌检测时的灵敏度还有很大的提升空间,使用荧光、同位素等手段标记适配体,与其他传感器、分析系统联合使用可以降低检测限。
3.4 其他 核酸适配体的亲和力表征方法还可以通过高通量亲和定量PCR 结合分析[12],用核酸适配体双链与靶标孵育,通过实时定量PCR 对孵育过程中释放的核酸适配体进行定量分析。等温滴定量热法(ITC)[13]理论基于aptamer-靶标复合物的形成是一个放热过程,可以同时测定Kd值,化学计量比和热力学性质,摄取的热必须与细胞样品的结合部分和一定温度下反应的摩尔焓相关。根据大分子靶标和适配体结合时构象的改变,可以通过足迹分析法[14]测定其亲和力,因为与靶标结合的核酸适配体不会被核酸酶降解。
4 总结与展望
近年来,针对核酸适配体的报道已有很多,其优势与应用也广泛展现于各种研究项目中。用于检测靶标-核酸适配体结合状态的方法也越来越多,但没有一种方法是堪称完美的。细菌表面结构复杂,同一个细菌可能筛选出蛋白质、多糖、鞭毛等的不同适配体,其亲和力和特异性识别也较难检测。而细胞筛选的适配体一般用于活体检测,但是筛选是在体外进行,细胞适配体能否在体内很好的识别和结合靶标,也是正在探索的问题。随着检测技术的快速发展,需要的样品量越来越少,Kd值的测定速度也越来越快,但许多检测方法仍然受到限制,例如荧光偏振法和紫外光谱法需要对适配体进行荧光标记或者其他修饰,可能会影响适配体的空间结构,从而影响与靶标的结合,而表面等离子体共振技术无需标记,并且检测速度较快,但是它的缺点在于难以区分非特异性吸附,并对温度和样品组成等干扰因素比较敏感。固定基质的亲和力检测方法可能会引起非特异性结合,所以建议Kd值的测定最好在核酸适配体与靶标溶液结合的情况下进行。未来也可以联合多种互补的检测技术进行Kd值的相互印证,并了解核酸适配体与靶标之间相互作用的机制,可以帮助对适配体的二级结构进行合理的设计,了解适配体与靶标相互作用中诱导构象的改变,测量结合化学计量学和平衡常数,使核酸适配体-靶标结合的亲和力检测速度更快、样品消耗量更低、灵敏度更高。
