半胱氨酸合成酶复合体形成机制的研究进展*
2018-05-22黄德均高立芳向白菊
蒋 安 杨 卫 黄德均 高立芳 张 健 向白菊**
(1 重庆市畜牧科学院 重庆 400015 2 重庆市璧山区河边畜牧兽医站 重庆 402760)
细胞生成过程取决于2 种或多种蛋白质与大分子复合物的可逆和特异性结合。这种蛋白质复合物的形成可以是暂时的,也有形成后长期处于稳定状态的,其功能主要是参与细胞中DNA 复制、转录、信号传导和代谢等过程[1]。目前信号传导途径中蛋白质-蛋白质相互作用已经得到广泛深入的研究,但对于初级或次级代谢途径中多酶复合物形成的分子机制的研究还相对较少。在初级代谢中,蛋白质-蛋白质相互作用可通过特定途径形成最佳数量的多蛋白复合物。复合物中反应底物的代谢通道位于不同酶活性位点之间,在大分子组装形成时具有较大优势,不仅如此,复合物中各种酶的相互作用也都具有重要的调节功能,例如在植物和细菌的半胱氨酸(cystaine Cys)生物合成途径中发生的多酶复合体现象即如此[2]。
存在于微生物和植物细胞中的半胱氨酸合成酶(cystaine synthase EC 4.2.99.8),大小约为60~70 kda,是一个同源二聚体[3]。它也被称为O-乙酰丝氨酸硫解酶[O-acetylserine (thiol) lyase OASTL]。OASTL 的功能是以2 分子的5′-磷酸吡哆醛(pyridoxal phosphate PLP)作为辅助因子,催化O-乙酰丝氨酸(O-acetylserine OAS)和硫化氢合成半胱氨酸(Cys),这个反应过程如图1所示。这是自然界中的无机硫掺入到Cys 的最后一步反应,通过这个反应无机硫可以转化为有机硫。但生物对无机硫的吸收利用远非如此简单,例如植物根系利用土壤中硫酸盐需要历经吸收、转运、同化、分配等过程。这些代谢过程由半胱氨酸合成酶(OASTL)等一系列酶和蛋白质参与和调节。在细菌中,无机硫也是通过此反应掺入半胱氨酸,再由半胱氨酸转化成其他含硫化合物,例如蛋氨酸和谷胱甘肽。而动物体内因为不存在OASTL,没有这些代谢过程,更没有将其转化成有机硫的各种调节机制,所以动物只能依靠吸收植物或微生物中的有机硫,才能满足体内对硫元素的需要,因此该反应处于自然界硫循环过程的关键环节,被认为是关键反应。

此外,由于从碳和氮的同化途径中得到的OAS,是合成半胱氨酸的前体物质,生成OAS 的反应由丝氨酸乙酰转移酶(SAT,EC 2.3.1.30)催化,所以OASTL 和SAT 不但是自然界中硫循环的关键酶,对于硫在其同化途径中的流通来说,OASTL 和SAT 的活性还具有更为特殊的意义,因为通过OAS 合成这个中间环节,OASTL 和SAT 将硫的同化途径和氮、碳的同化途径相联系,并且能对这些途径的平衡产生影响[5]。
1 OASTL 和SAT 复合体
植物和细菌中的OASTL 主要存在于细胞的胞质、质体和线粒体中,并有多种异形体。SAT 主要催化半胱氨酸的前体物质OAS 的合成,它同样也出现在细胞的胞质、质体和线粒体中。SAT 和OASTL 能通过相互作用形成CSC[6],目前已查明,二者的相互作用在Cys 的合成调节中处于核心地位。Kredich[3]在研究鼠伤寒沙门氏菌时,发现细胞中SAT 的浓度远低于OASTL,后者大约是前者的300 倍,说明细胞中仅仅只有一小部分的OASTL和SAT 存在相互作用,形成了CSC。Wirtz 等[7]曾对CSC进行过缺失作图和双杂交实验,以便更好地描述SAT-OASTL 复合体中结构域的特性,但到目前为止,这个复合体的晶体结构图还没有人能够制作出来。另一方面,尽管OASTL 二聚体的三维结构图已经被Nakako 等[8]绘制完成,但由于这个复合体的表面相互作用极其复杂,目前仍不清楚OASTL结构域中与SAT 产生相互作用的是哪部分序列,也就很难对其与SAT 产生相互作用的各个氨基酸残基进行分析作图[8]。迄今为止对这个复合体生物化学研究还仅能展现CSC 组装形成过程中的局部视图。
2 半胱氨酸合成酶复合体的组装形成
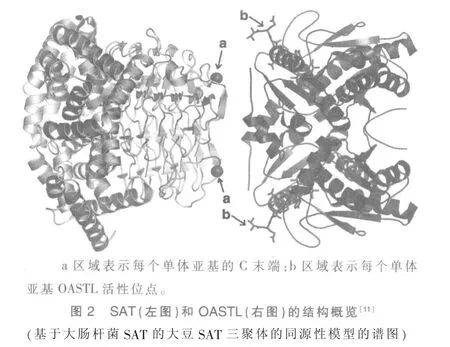
之前的多个研究已经表明植物和细菌的OASTL和SAT 之间存在相互作用,但关于来自植物或细菌的CSC 的组装结构的信息还很少,目前尚不清楚CSC 组装形成的详细分子基础。Kredich等[3]使用超速离心机确定了从鼠伤寒沙门氏菌纯化的CSC 的组合分子量为310,并提出它含有1个SAT 六聚体和2 个OASTL 二聚体。后来,体积排除色谱法研究揭示了植物CSC 具有相似的分子量,但提出了一个替代模型,其中同源四聚体SAT 和2 个OASTL 二聚体缔合形成大分子组合。随后,分别测定了来自细菌的SAT 和来自细菌和植物的OASTL[9]的X 射线晶体结构。细菌SAT 似乎可以看作同源六聚体(单体Mr≈30-33),其中2 个三聚体头对头排列,每个三聚体的C 末端尾部在六聚体的相对端(图2a区域)。在植物和细菌中,OASTL被组装为同型二聚体蛋白(单体Mr≈35-38),每个单体活性位点带有含吡哆醛磷酸盐分子的席夫碱,其中的赖氨酸残基具有催化作用(图2b区域)。尝试鉴别SAT-OASTL 相互作用位点的研究表明,SAT 的C 末端对于复合物形成是至关重要的,且SAT 的C 端区域也是活性位点的位置。通过研究细菌和植物OASTL 对应于其同源SAT 的C 末端区域的肽复合位置的X 射线晶体结构,结果显示OASTL 活性位点就是其与SAT 结合的位置[10](图2)。
在这一相互作用的过程中SAT 最大限度地结合2 个分子的OASTL,这被认为涉及将C 末端从SAT 三聚体中的原体对接到OASTL 活性位点。这种相互作用使OASTL 催化失活,并防止其进一步结合SAT 三聚体;因此,该系统显示了接触诱导可以导致每个生物大分子的一半失活。为了更好地了解CSC 形成的动力学和能量学,Ting Wang(2012)等[12]在平衡和预稳态下研究了OASTL 和SAT与大肠杆菌的相互作用。使用在CSC 形成反应的不同点引发CSC 解离的实验策略,鉴定出3种稳定形式的复合物,确定了2 个瞬时存在的中间体,其中一个来自嗜血杆菌流感的CSC[13]。将SAT 与其C 末端肽的结合进行动力学和能量学比较,结果支持了SAT 的C 端通过将CSC 蛋白质复合物栓系在一起的非别构相互作用附着于OASTL的机制。松散耦合的复合物接下来参与了至少2次在能量上更有优势的异构化,产生处于最佳稳定状态的CSC 复合物并导致OASTL 的失活。
Julie A.Francois 等[14]更进一步确定了拟南芥OASTL(At-OASTL)的结晶结构,发现拟南芥OASTL与对应的SAT(C10 肽)的C 末端10 个残基的肽结合。具体方式是与关键活性位点残基(Thr-74,Ser-75 和Gln-147)的氢键相互作用,将C10 肽锁定在结合位点。这种与C10 肽结合可以通过阻断的方式获得OASTL 催化残留物,这说明了复合物的形成是如何下调OASTL 活性的。将拟南芥OASTL 与细菌OASTL 比较表明,活性位点的结构可塑性允许SAT C 末端与结构相似的OASTL 活性位点的不同序列结合。活性位点突变 (T74S,S75A,S75T 和Q147A)影响的量热分析表明,这些残基对于C10肽结合是重要的,并且在这些位置的变化破坏同源二聚体酶中活性位点之间的通信。
3 半胱氨酸合成酶复合体的调控机制
CSC的形成在调控这2 个酶的活性中起着重要的作用。由CSC 调节的硫同化和半胱氨酸生物合成之间的相互作用具有非常重要的意义,由于最终产物半胱氨酸是植物中所有含硫醇化合物的硫代谢来源,其合成代谢在硫醇代谢中具有中枢作用,并且可以影响多种细胞过程。Hell 等[15]提出了一个假说,阐明了复合体形成的重要意义,其要点在于:1)当细胞中有足够的硫时,由于硫化物能使复合体稳定,所以OASTL 和SAT 结合。2)由于结合状态下的OASTL 对OAS 的亲和性很低,OAS 合成后就离开复合体。3)OAS 被游离的OASTL 消耗生成半胱氨酸,大约5%的OASTL 形成复合体,而95%处于游离状态。在硫缺乏时硫化物的量下降,OAS 累积到足以有效解离SAT 和OASTL 复合体的浓度。4)结果SAT 活性降低(降解或被修饰),同时,OAS 诱导负责硫的吸收和同化的基因解除被抑制的状态。5)这是个可逆的系统,因为进入细胞的硫酸盐被还原后,硫化物被掺合进半胱氨酸,这步反应由游离的OASTL 催化,并利用了累积的OAS作为底物,这样就降低了OAS 的水平,从而促进了复合体的形成。6)同时也可看到SAT(至少其胞质形式)的活性受到L-半胱氨酸反馈抑制。
这个假说对于阐明复合体形成及其对硫吸收途径调节的影响有很大帮助。具有活性的OASTL并不在复合体当中,而是处于游离状态,当其与SAT 形成复合体后,则通过变构效应而失去活性。有趣的是,SAT 只有在复合体当中才具有活性,而处于游离状态时则没有活性[16]。当细胞中的硫充足时,游离的OASTL 将OAS 转化为半胱氨酸,并使半胱氨酸过量存在。大约有5%的OASTL 参与形成复合体,其他95%的OASTL 则处于游离状态。最近获得的动力学数据,为CSC 作为细胞中硫在初级代谢中流通调节开关的作用提供了证据[17],同时也表明硫化物能诱导CSC 的形成,而OSA 则促使复合体解离。所以,在硫缺乏时,硫化物的量下降,OAS 就会累积到足以有效解离SAT 和OASTL 复合体的浓度,结果SAT 降解或被修饰,其活性就会降低。不但如此,OAS 诱导负责硫的吸收和同化的基因同时会解除被抑制的状态。这个系统是可逆的,进入细胞的硫酸盐被还原后,硫化物就进入了半胱氨酸,无机硫转化成有机硫,游离的OASTL 在反应中以累积的OAS 作为底物进行催化反应,利用并消耗了OAS,使其水平降低,这又促进了OASTL 和SAT 的结合。同时,也可看到L-半胱氨酸对SAT(至少其胞质形式)的活性进行反馈抑制。
Sangaralingam 等[11]使用生物和物理方法的组合,研究了植物CSC 的组成,并提出了一种监管大分子装配体系结构的新模型。稳态动力学分析表明,CSC 形成增强SAT 活性,并通过生物合成途径的最终产物半胱氨酸从底物抑制和反馈抑制中释放SAT。半胱氨酸分别抑制SAT 和CSC,表明OASTL 和SAT 的相互作用是负合作的,并且2 种酶的结合减轻了SAT 活性对半胱氨酸生成的反馈抑制。该研究小组根据以前的报告和他们的分析数据,建议将OASTL 看作SAT 的酶伴侣。
3.1 重组植物CSC 的调控作用 多酶复合物在包括翻译、转录、基因表达和信号转导等多种细胞过程中起核心作用。重组植物SAT 和OASTL 的生物化学分析表明,CSC 中蛋白质的可逆结合控制细胞硫稳态。SAT 和OASTLs 的转录本丰度,蛋白质水平和可提取活性未被硫同化途径的硫限制或遗传操作显著改变。然而,接触有毒化合物或苛刻胁迫处理可以诱导拟南芥中特定SAT 和OASTL同种型的显著转录。这就提供了基于对自由存在的SAT 的动力学研究方法,其中SAT 活性主要通过SAT 的半胱氨酸反馈抑制在代谢水平上进行调节。随后,Wirtz 等[18]提出了基于SAT 和OASTL在异寡聚半胱氨酸合成酶复合物中的可逆相互作用的SAT 活性的调节模型。
3.2 CSC 在亚细胞中的分布及线粒体CSC(mCSC)的调控 CSC 虽然同时存在于植物细胞的细胞溶质、质体和线粒体中,但SAT 和OASTL 的活性和量在这些亚细胞间隔之间有显著的差异。在拟南芥叶中,OASTL 活性的90%由OASTLA 在胞质溶胶中提供,OASTLB 在叶绿体中提供,其余活性来自线粒体OASTL C[19]。相比之下,发现总SAT 活性的80%来源于线粒体同工型SAT3(serat2;2)。残留SAT 活性由质体局部化的SAT1(serat2;1)和3 个胞质SAT,其中SAT5(serat1;1)是最丰富的。每个SAT 基因的T-DNA 插入突变体是可行的,证明在细胞溶质、质体或线粒体中单独的OAS 合成不是必需的。线粒体SAT3 的敲除引起显著的生长迟缓,这表明线粒体在供应OAS 用于半胱氨酸合成中的主要作用。mCSC 在调节SAT3 活性和细胞半胱氨酸中的突出作用也由oastl-C 的生长迟缓表型展现出来,而oastl-A 和oastl-B 突变体则不受影响。然而,体外CSC 形成对丝氨酸和乙酰辅酶A 的SAT3 亲和力影响不大,但与游离SAT3 相比,CSC 结合的SAT3 对半胱氨酸的反馈抑制敏感性较低。
3.3 CSC 对细胞内代谢调节的影响 在代谢方面,OASTL 以多种方式作为SAT 的酶伴侣。不仅CSC 的形成增加了OAS 合成速率,SAT 和OASTL的关联将半胱氨酸生物合成的限制步骤从反馈抑制中释放出来。植物中的生理半胱氨酸水平范围为10~20 μm。CSC 的快速和稳定的形成将允许在高需求条件例如环境氧化应激下产生OAS 以维持细胞内半胱氨酸水平。在低硫状态条件下,复合物的解离通过反馈调节恢复SAT 的调节。有趣的是,CSC 的形成也可能增加SAT 的物理稳定性。在大肠杆菌中,与OASTL 的结合可防止SAT 的冷灭活。不清楚这是否也发生在诸如大豆之类的植物中,其中硫同化和半胱氨酸生产在低温冷却时需求会增加[20]。最终,植物中的半胱氨酸生物合成和硫醇代谢在蛋白质水平上通过多种分子机制(包括复合物形成,氧化还原调节和磷酸化)被高度调节,以整合调节酶活性的多种细胞信号以满足代谢物供应的各种需求。
