3种AM真菌对紫花苜蓿生长和养分吸收的影响
2018-05-22郭艳娥李应德段廷玉兰州大学草地农业科技学院甘肃兰州730020北京大学深圳研究生院广东深圳58055
蒙 程,郭艳娥,李应德,段廷玉(.兰州大学 草地农业科技学院,甘肃 兰州 730020; 2.北京大学 深圳研究生院,广东 深圳 58055)
紫花苜蓿(Medicagosativa)是奶牛等草食动物的重要优质饲草,被誉为“牧草之王”。发展苜蓿产业,对于调整种植业结构,推进农牧结合,提升草产品和畜产品市场竞争力具有重要意义。2015年,全国苜蓿年末保留面积471.13万hm2,产量3 217万t,其中优质苜蓿种植面积21.33万hm2,平均单产37.47 kg/hm2,产量180万t,粗蛋白平均含量18.1%。但是这些尚且满足不了需求,每年我国仍需大量进口苜蓿。我国土壤普遍缺磷,施用磷肥能够显著提高紫花苜蓿产量[1],因此,如何在减少化肥使用的农业发展策略下,提高苜蓿生产,是亟需解决的问题。
丛枝菌根(arbuscular mycorrhizae,AM)真菌是陆地生态系统的重要组成部分,AM真菌侵染植物根系后形成菌根,可增加宿主植物对磷、锌、铜等营养元素的吸收,促进植物生长,提高植物耐旱[2]、耐盐碱[3-4]、耐重金属污染[5]等的能力,减少黄瓜(Cucumissativus)枯萎病(Fusariumoxysporumsp.cucumerinum)、立枯病(Rhizoctoniasolani)和菌核病(Sclerotiniasclerotiorum)等土传病害[6],加快矿区废弃地的复垦。宿主植物和AM真菌共生关系的建立具有一定选择性,同种植物对不同真菌形成的菌根依赖性也存在差异。其间的相互作用决定着菌根与宿主植物二者之间的亲和力、共生体的建立及菌根发育速度和功能的发挥[7]。迪丽努尔等[8]对新疆伊犁地区8种野生植物的AM真菌进行分离鉴定,并对其生态分布进行研究,发现同一菌种在不同宿主上的种群频度存在差异,表现出较强的AM真菌与宿主植物之间的选择性。对构树(Broussonetiapapyrifera)的研究也发现,宿主植物对不同AM真菌处理下侵染响应不一致[9]。同种植物接种不同菌种或不同植物接种同一菌种,形成丛枝菌根的能力不同[10],对植物生长的影响也有所不同[11-14]。我国土壤普遍缺磷,筛选出宿主植物-AM真菌的良好共生组合体,在缺磷土壤中推广应用,可获得巨大的生态效益和经济效益。紫花苜蓿多栽培于土壤贫瘠地区,为此,试验拟通过在温室条件下接种不同AM真菌,探究其对紫花苜蓿生长和养分吸收的影响,筛选出紫花苜蓿的高效菌种,以期为生物菌肥的研制提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 供试植物与AM真菌 供试植物为紫花苜蓿,种子由甘肃出入境检验检疫局提供。
细凹无梗囊霉(Acaulosporascrobiculata,简写为A.s)、脆无梗囊霉(Acaulosporadelicata,简写为A.d)和副冠球囊霉(Glomuscoronatum,简写为G.c),由中国农业科学院提供,以三叶草扩繁所得的孢子、菌根根段、根外菌丝及培养基质作为接种物。
1.1.2 供试土壤 试验主要基质为沙土。采用高压蒸汽灭菌法将草炭土在121℃下灭菌1 h,隔天再灭菌1 h;将河沙过2 mm筛,180℃下干热灭菌6 h,然后与草炭土2∶5混匀,风干备用。
尽量避免宝宝接触过敏原和污染空气,以减少喘息性疾病发生。家中尽量不要养猫、狗、兔、鸽子等宠物,室内不要养花。给孩子买玩具时,应尽量选择木、布、金属制作的。
1.2 试验方法
1.2.1 试验设计 盆栽试验于2016年9~11月在兰州大学草地农业科技学院智能温室中进行,所用塑料盆规格为17 cm×11 cm×15 cm。试验设8个处理,分别为单接种细凹无梗囊霉,单接种脆无梗囊霉,单接种副冠球囊霉,同时接种细凹无梗囊霉和脆无梗囊霉(简写A.s+A.d),同时接种细凹无梗囊霉和副冠球囊霉(简写A.s+G.c),再接种脆无梗囊霉和副冠球囊霉(简写A.d+G.c),同时接种细凹无梗囊霉、脆无梗囊霉和副冠球囊霉(简写为A.s+A.d+G.c),每个处理5个重复,共40盆随机摆放。
例2:Eight years ago they(a black woman and a white man)were married.They have survived their families’shock and disapproval and the stares and unwelcome comments of strangers.
通常情况下,可以利用浅层钻探技术在特定的环境地域中进行地质勘查工作,在一定程度上可以降低自然环境的破坏程度。比如说地表层植被较少但是土壤层较薄弱的地区或者是和沼泽地域自然环境较为接近或类似的区域。浅层钻探技术可以应用于地表浅层这一点,就可以很好地满足地质勘查工程相关的勘探条件。
播种前用10% H2O2对紫花苜蓿种子进行表面消毒10 min,而后用无菌水(蒸馏水置于高压蒸汽灭菌锅121 ℃灭菌20 min)清洗干净,置于25 ℃恒温培养箱中培养,至种子露白即可播种。每盆播种5粒,生长7 d后每盆留4 株长势一致的健康幼苗。
1.2.2 指标测定 生物量采用文献[14]烘干法测定:菌根侵染率的测定采用根段法,将称好的0.1 g的根剪成约0.1 cm的小段,放入15 mL离心管中,加入适量10% KOH溶液,在80℃水浴条件下水浴20 min;取出后倒掉KOH,用1% HCl洗涤后用水冲洗干净;再用0.065%苯胺蓝染液在80℃水浴中染色10 min,洗净后保存于甘油中,并在解剖镜下镜检[14]。
接种处理增加了紫花苜蓿地上和地下的含磷量。除混合接种细凹无梗囊霉和副冠球囊霉的处理外,其余接种处理的地上、地下部含磷量均与对照组差异显著(P<0.05)。混合接种细凹无梗囊霉和副冠球囊霉的处理虽与对照差异不显著,但是其地上、地下部含磷量较对照组的平均增长为1 854%、638%(图8,9)。
地上磷含量,单接种处理,以副冠球囊霉的效果最显著,混合接种处理,以副冠球囊霉和脆无梗囊霉效果最好。不同AM真菌接种处理间差异不显著(P>0.05)。地下磷含量,单接种处理以细凹无梗囊霉效果最显著。混合接种处理,以脆无梗囊霉和副冠球囊霉效果最好。同样,不同接种处理间差异不显著。与对照组相比,单接种细凹无梗囊霉、脆无梗囊霉和副冠球囊霉的地下部含磷量分别提高,1 288%,1 050%和1 033%。
总氮N(%)=(C×0.001×0.1)/w×100
式中:C为FLAstar获得的被测液浓度,w为样品质量。
总磷P(%)=(C×0.001×0.1)/w×100
式中:C为FLAstar获得的被测液浓度,w为样品质量。
1.3 数据分析
使用SPSS 22.0统计软件对试验数据进行统计分析,采用JMP IN 4对各指标进行交互效应以及方差分析,使用Excel 2013进行作图。
科研经费管理制度不健全,岗位职责分工不合理,科研项目经费使用不规范,可能导致科研经费违规使用或舞弊风险。例如,缺乏规范的监督机制,或者说监督制度不完整,经办人员权力过大,不受约束;缺乏预算调整制度;采购流程不够规范,存在虚假采购甚至舞弊的风险。
2 结果与分析
2.1 菌根侵染率
单接种处理下,植物菌根侵染率以副冠球囊霉最高,细凹无梗囊霉最低,单接种副冠球囊霉和脆无梗囊霉的侵染率间差异不显著(P>0.05),但均显著高于细凹无梗囊霉(P<0.05);混合接种处理,以细凹无梗囊霉和脆无梗囊霉组合的菌根侵染率最高,脆无梗囊霉和副冠球囊霉最低(图1)。而不接种AM真菌的处理未观察到菌根侵染,说明本试验AM真菌接种是成功的。
2.2 生物量
2.2.1 地上生物量 接种AM真菌显著提高了紫花苜蓿的地上生物量(除A.s+G.c外)。其中,接种细凹无梗囊霉、脆无梗囊霉和副冠球囊霉的生物量分别是对照的9倍,11.6倍和12.3倍;混合接种脆无梗囊霉和副冠球囊霉的紫花苜蓿生物量是对照组生物量的14.7倍。不同AM真菌接种处理间,除混合接种脆无梗囊霉和副冠球囊霉外,其余差异不显著。但是混合接种细凹无梗囊霉和副冠球囊霉处理的紫花苜蓿生物量是对照组生物量的6.5倍,较其他的处理低(图2)。
试验将AM真菌接种物50 g/盆平铺于1.8 kg灭菌的土壤上,然后再覆盖土200 g,对照组(CK)则加等量灭菌接种物和接种物滤液,以保持微生物区系一致。接种方法为层播,接种量为每盆50 g菌剂,菌剂为含有孢子、菌丝和根段混合物的土壤,未接种的处理加入50 g灭菌的沙子作为对照。
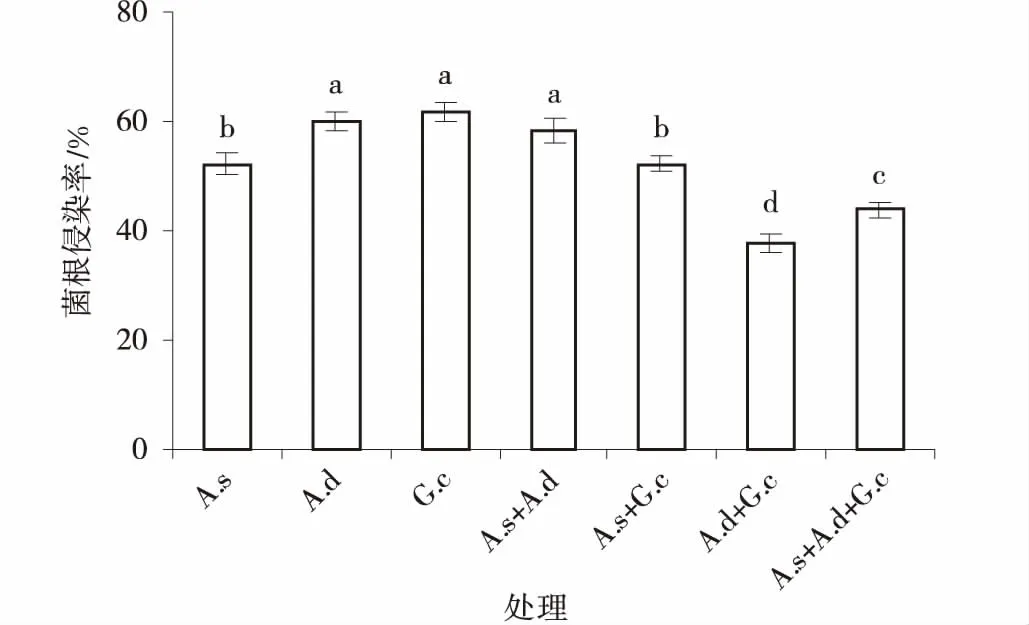
图1 3种AM真菌组合处理下紫花苜蓿菌根侵染率Fig.1 The AM colonization of alfalfa colonized by three AM fungi and their combinations注:图中数据为平均值±标准误差(n=4),不同小写字母表示不同处理间差异显著(P<0.05),下同

图2 3种AM真菌组合处理下紫花苜蓿地上生物量Fig.2 The aboveground biomass of alfalfa colonized by three AM fungi and their combinations
植物地上、地下组织氮含量,均以单接种副冠球囊霉的效果最好,脆无梗囊霉次之,细凹无梗囊霉的效果最小,其中,植物地上部分组织N含量较对照分别增加,1285%,1243%和808%,除混合接种细凹无梗囊霉和副冠球囊霉的处理外,其余接种处理均与对照差异显著,植物地上、地下组织各接种处理间差异不显著(P<0.05)。
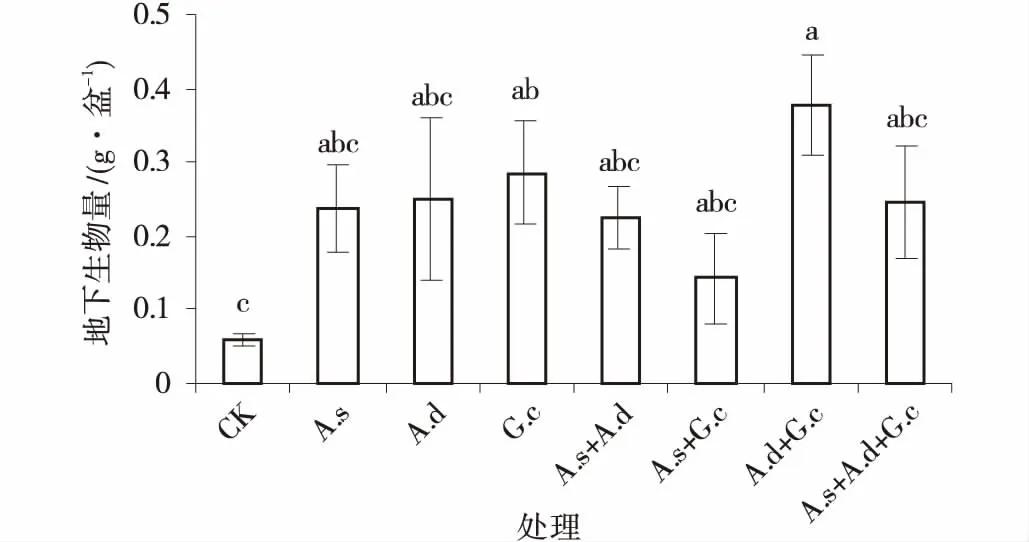
图3 3种AM真菌组合处理下紫花苜蓿地下生物量Fig.3 The belowground biomass of alfalfa colonized by three AM fungi and their combinations
AM真菌只有侵入植物体内并与之建立共生关系才能发挥作用,菌根侵染率是评价AM真菌与植物建立共生关系与否的重要指标。菌根的生长发育及其功能的发挥依赖于AM真菌与宿主植物的根系亲和力以及二者之间的相互选择性[7]。紫花苜蓿接种不同AM真菌后其菌根侵染率差异显著,表明不同AM真菌和紫花苜蓿的亲和性不同,副冠球囊霉的菌根侵染率最高,表明3种AM真菌中副冠球囊霉与紫花苜蓿的亲和性最好。
要想解决碳会计信息披露中存在的问题,就要规范披露内容,建立完善的披露体系,推动其朝着实用性、科学性和客观性方向发展,也需要全体社会成员共同努力。针对目前披露中存在的问题,提出以下几点建议。
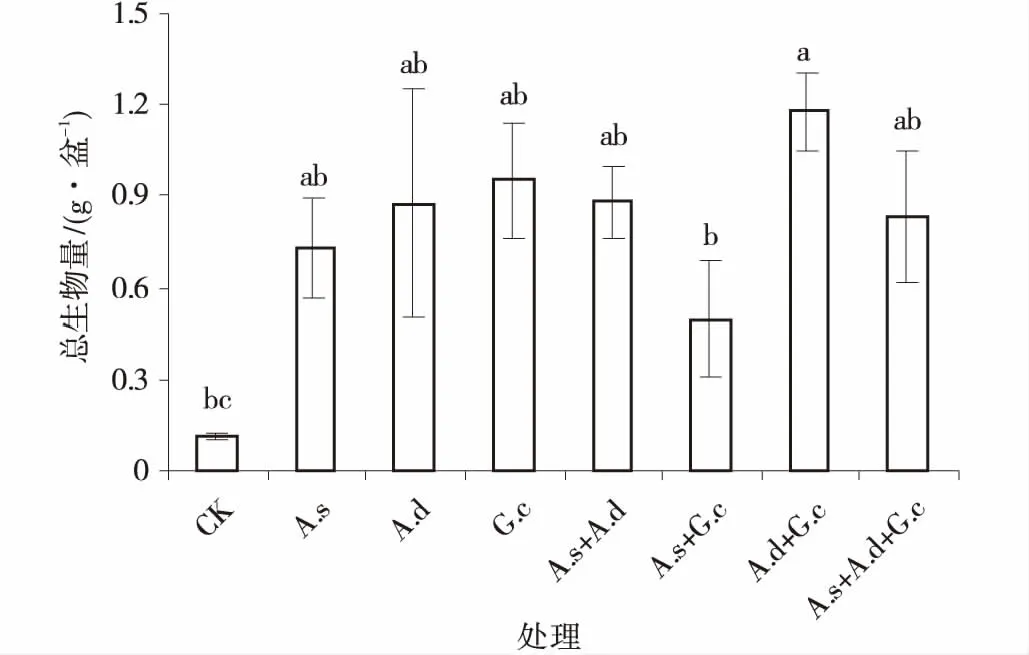
图4 3种AM真菌组合处理下紫花苜蓿总生物量Fig.4 The total biomass of alfalfa colonized by three AM fungi and their combinations
2.3 根冠比
接种AM真菌后紫花苜蓿的根冠比显著降低了(P<0.05),而且,不同AM真菌接种间无显著差异(P>0.05)。对照组的根冠比大于1,说明根系生长占优势,这是由于对照条件下,紫花苜蓿的营养条件受到限制,所以要先满足根部的生长,使得根冠比增大。
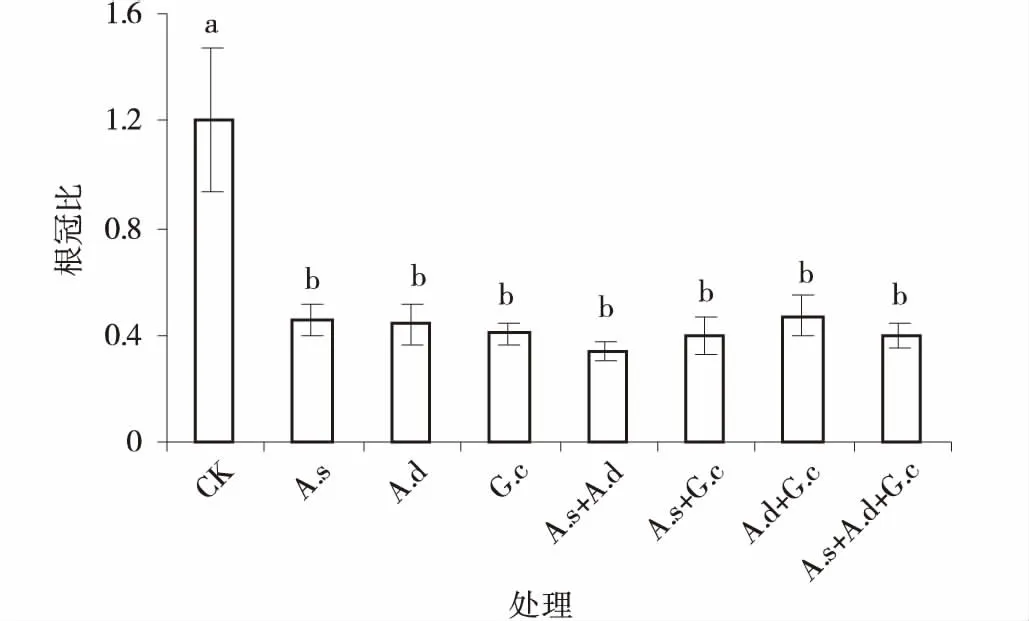
图5 3种AM真菌组合处理下紫花苜蓿根冠比Fig.5 The root/shoot ratio of alfalfa colonized by three AM fungi and their combinations
接种AM真菌后,可能是AM真菌促进紫花苜蓿对养分的吸收,植物营养状况得到改善,地上部分生长优于地下部分生长,导致根冠比降低(图5)。
2.4 氮含量
菌根的功能就是改善植物对矿质元素的吸收,被称为“生物肥料”。不同AM真菌接种处理下紫花苜蓿地上、地下部分氮含量均高于对照组。接种AM真菌后地上部含氮量增长率在688%,地下部增长率在100%(图6,7)。
2.2.2 地下生物量 接种AM真菌处理显著提高了紫花苜蓿地下生物量,较对照提高地下生物量100%。混合接种脆无梗囊霉和副冠球囊霉处理下,植物地下生物量显著高于其他处理,较对照组高543%。接种AM真菌的处理间差异皆不显著(图3)。
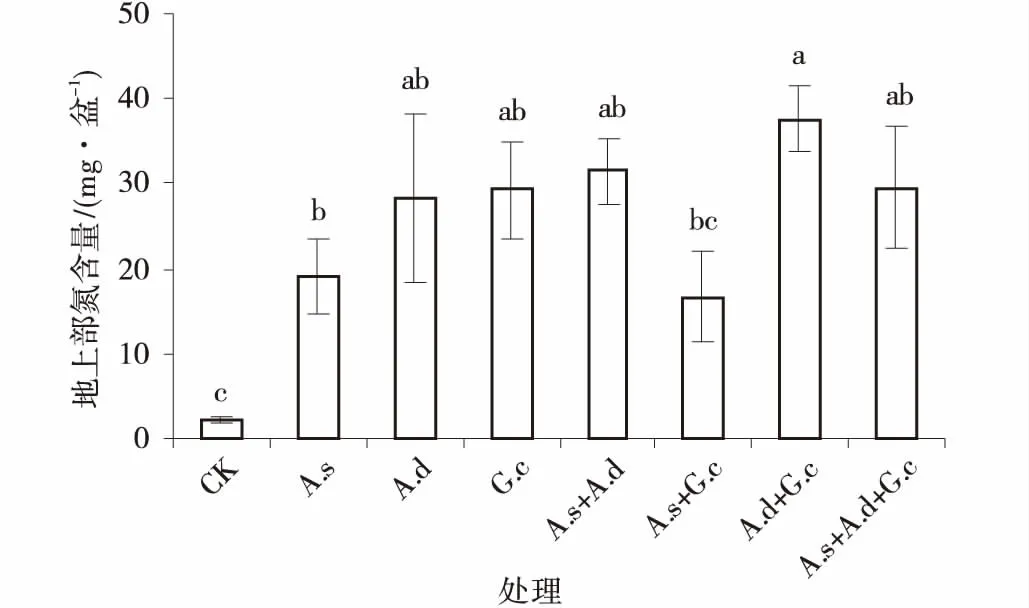
图6 3种AM真菌组合处理下紫花苜蓿地上部氮含量Fig.6 The shoot N content of alfalfa under three AM fungi and their combinations
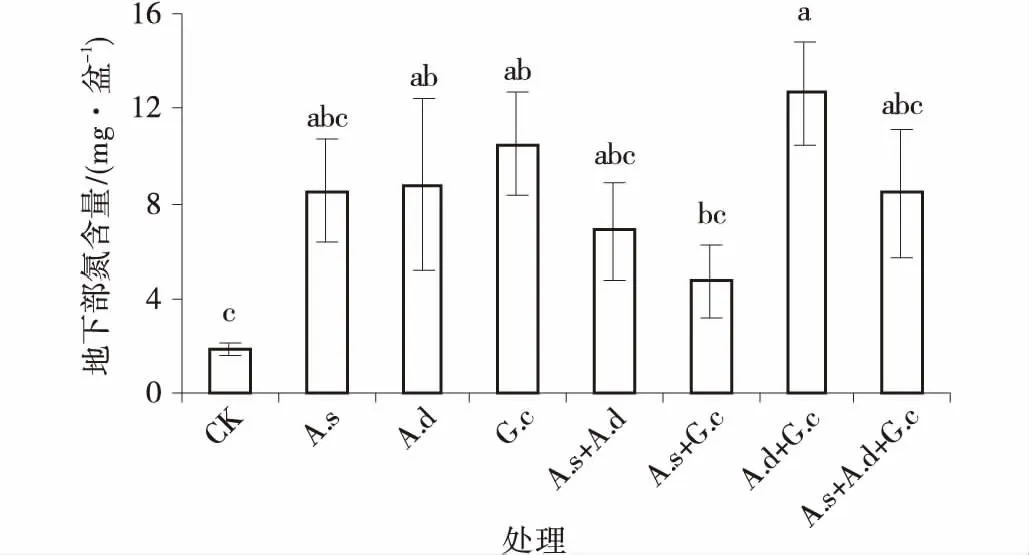
图7 3种AM真菌组合处理下紫花苜蓿地下部氮含量Fig.7 The root N content of alfalfa under three AM fungi and their combinations
2.5 磷含量
当上述两种翻译方法都不能满足翻译的要求时,就需要使用意译翻译法。这与我国传统教学中只可意会,不可言传的方法类似,将句子中潜藏的意思挖掘出来并加以翻译,例如“a wet blanket”是指一个人没有情调,而不是英文词汇表示的原本的湿毛毯的意思。因此在我们学习过程中遇到翻译不通的句子时,可尝试使用意译法。
全N、全P含量:将研磨好的植物干样过2 mm筛,称取0.25 g过筛后的植物样,加入2.0 g催化剂(K2SO4和CuSO4研磨后10∶1混合)和5 mL浓硫酸放置0.5 h进行预消化。消化管放置到预加热至420 ℃的消煮炉上,进行消化至溶液澄清(溶液呈淡蓝绿色),并继续消化30 min。待溶液冷却后,定容至50 mL,采用流动注射仪(FIAstar 5000 Analyzer,FOSS,Sweden)测定。
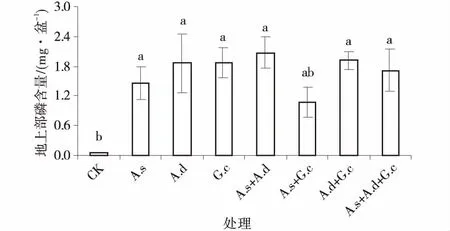
图8 3种AM真菌组合处理下紫花苜蓿地上部磷含量Fig.8 The shoot P content of alfalfa under three AM fungi and their combinations
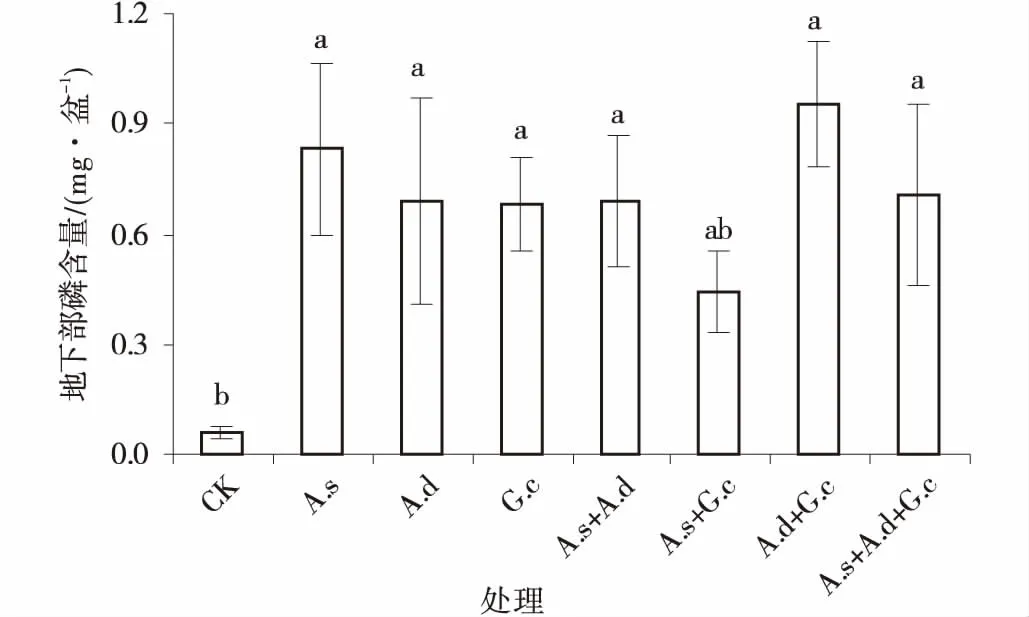
图9 3种AM真菌组合处理下紫花苜蓿地下部磷含量Fig.9 The root P content of alfalfa under three AM fungi and their combinations
3 讨论
3.1 AM真菌对紫花苜蓿菌根侵染率的影响
2.2.3 总生物量 不同AM真菌接种处理均提高紫花苜蓿的总生物量,增长率均在300%。混合接种脆无梗囊霉和副冠球囊霉处理的促进作用最显著,总生物量较对照增加941%,而混合接种效果细凹无梗囊霉和副冠球囊霉的促进作用最小,总生物量较对照增加338%。单接种处理中,副冠球囊霉的促进作用最大,总生物量较对照增加744%,其次是脆无梗囊霉,总生物量较对照增加677%,细凹无梗囊霉促进作用最小,总生物量较对照增加545%,各单接种处理间紫花苜蓿总生物量差异不显著(P>0.05)(图4)。
3.2 AM真菌对紫花苜蓿生长的影响
产量是衡量植物生长状况良好与否的重要指标[17-18]。菌根能够扩大根际范围,提高养分的空间有效性,改善根际环境,增加根系的吸收能力,植株的水分和养分条件得到改善,生长速率加快,株高、分枝数也得到促进,最终导致生物量的增加。接种3种AM真菌使植株的地上部分和根系部分协调发展,地上、地下生物量和总生物量都显著提高,都对紫花苜蓿的生长产生促进作用,与在羊草(Leymuschinensis)[19]、紫花苜蓿[1]、油蒿(Artemisiaordosica)[20]上接种AM真菌提高植物生物量的结果一致。
不同AM真菌的作用存在差异,从总生物量分析,单接种中,副冠球囊霉的促生效果最好,脆无梗囊霉次之,细凹无梗囊霉最差。原因可能是不同菌种与寄主植物的亲和性不同,促进作物生长的作用机制也不同。混合接种中,作用效果依次为,脆无梗囊霉和副冠球囊霉>细凹无梗囊霉和脆无梗囊霉>细凹无梗囊霉、脆无梗囊霉和副冠球囊霉>细凹无梗囊霉和副冠球囊霉,可能原因是不同AM真菌之间的亲和性也不同,侵染植物后菌根之间的相互作用会削弱或增强对植物生长的促进作用,具体原因有待进一步研究。
改进的动态交通诱导启发函数中,设置了路网的加权值,为时间的函数。按照实时接收的交通服务信息来计算路面状况并预测,同时参考过去数据,计算路面在不同时间的行程时间t对应的函数f(t),如公式(6)所示。
接种AM真菌后紫花苜蓿的根冠比显著降低,是由于对照条件下,紫花苜蓿的营养条件受到限制,所以要先满足根部的生长,使得根冠比增大。接种AM真菌后,可能AM真菌促进紫花苜蓿的养分吸收,植物的营养状况得到改善,地上部分的生长优于地下部分的生长,导致根冠比降低。
3.3 AM真菌对紫花苜蓿养分吸收的影响
磷作为大量元素,对植物的生长必不可少,而我国大部分地区土壤有效磷含量低,磷已经成为限制作物产量的重要因素。接种AM真菌显著提高植株地上和地下部分的磷含量,说明AM真菌能够改善紫花苜蓿的磷营养,提高植物紫花苜蓿对磷素的吸收利用[19]。AM真菌侵染植物根系后,促进根系生长,使根系分泌物和脱落物数量增加,土壤微生物活性增强,酸性或碱性磷酸酶的活性增强,将植物难以利用的磷活化成可被植物吸收利用的磷,改善植株的磷营养[20-22]。氮是植物生长的必需元素之一。试验表明AM真菌通过改善植物的磷营养状况提高根瘤菌的固氮活性,促进豆科植物生长,增加固氮量[23],同时试验结果也证明接种AM真菌也能够提高植株的氮含量。
造血干细胞移植(HSCT)是对患者体中的有异常细胞或者肿瘤通过放疗、化疗的方式进行清除,然后给患者的身体中移入自体或者异体的造血干细胞,从而给患者重新构建造血系统和免疫系统。但是,因为这类疾病需要较长的治疗时间,并且在化疗和放疗期间药物的副作用以及手术以后免疫制剂的长期服用,给患者的心理以及患者家属的心理带来了沉重的负担,并且也具有沉重的经济负担[1] 。因此,为了减轻患者及其家属的心理负担,提高治疗效果和恢复效果,要将健康教育应用于造血干细胞移植患者及家属心理护理中。为此,选取我院收治的80例造血干细胞移植患者,对其实施不同护理模式的效果进行比较分析,并做出以下总结。
腕表采用45毫米直径铂金表壳,表冠饰以凸圆形切割红宝石,表耳下方采用宝珀专利性设计的5个隐藏式调校按钮,在调校同时确保了表侧简洁流畅的线条美感。该表集合了宝珀Villeret系列所有的经典标识,如双层表圈、大明火珐琅表盘、镂空柳叶形指针、指示标准日历的蛇形蓝钢指针等。全新中华年历“吉犬”腕表限量发行50枚,每枚皆搭载金质摆陀,上面镌刻献礼2018中华新年的生肖狗图案。
4 结论
不同AM真菌对植物生长的作用不尽相同,其组合对植物生长亦会有差异。因此,试验利用3种不同AM真菌研究其对紫花苜蓿生长和养分吸收的影响。结果表明单接种3种AM真菌,副冠球囊霉对紫花苜蓿的株高促进作用最大;混合接种副冠球囊霉和脆无梗囊霉对紫花苜蓿株高的促进作用最大。3种AM真菌均提高紫花苜蓿植株N、P含量,促进N、P吸收。3种AM真菌均提高紫花苜蓿生物量,单接种副冠球囊霉的促生效果最好,混合接种副冠球囊霉和脆无梗囊霉的促生效果最好,具有应用成为菌肥的潜力。
参考文献:
[1] 任爱天,鲁为华,杨洁晶,等.不同磷水平下AM真菌对紫花苜蓿生长和磷利用的影响[J].中国草地学报,2014,36(6):72-78.
[2] 李少朋,毕银丽,陈拙圳,等.干旱胁迫下AM真菌对矿区土壤改良与玉米生长的影响[J].生态学报,2013,33(13):4181-4188.
[3] 杨海霞,徐萌,刘宁,等.丛枝菌根真菌对两种草坪草耐盐性的影响[J].草业科学,2014,31(7):1261-1268.
[4] 赵琦,包玉英.混合盐碱胁迫下丛枝菌根真菌对紫花苜蓿生长及2种酚酸含量的影响[J].西北植物学报,2015,35(9):1829-1836.
[5] 张旭红,高艳玲,林爱军,等.重金属污染土壤接种丛枝菌根真菌对蚕豆毒性的影响[J].环境工程学报,2008,2(2):274-278.
[6] 吕恒,牛永春,邓晖,等.根际真菌对黄瓜土传病害的抑制作用[J].应用生态学报,2015,26(12):3759-3765.
[7] 王幼珊,张美庆.VA菌根真菌与宿主植物间的相互选择性[J].北京农业科学,1989,6:4-7.
[8] 迪丽努尔,唐明,王亚军.新疆伊犁野生植物VA菌根真菌及其生态分布[J].西北农林科技大学学报(自然科学版),2006,34(6):96-100.
[9] 何跃军,钟章成,刘济明,等.构树幼苗对接种丛枝菌根真菌的生长响应[J].应用生态学报,2007,18(10):2209-2213.
[10] 曹少奇,任爱天,鲁为华.4种牧草接种AM真菌效应分析[J].草原与草坪,2015,35(2):43-46.
[11] 刘文科,冯固,李晓林.三种土壤上六种丛枝菌根真菌生长特征和接种效应[J].植物营养与肥料学报,2006,12(4):530-536.
[12] 何跃军,钟章成,刘济明,等.VA真菌对构树(Broussonetiapapyrifera)幼苗物质代谢的影响[J].生态学报,2007,27(12) :5455-5462.
[13] 盖京苹,冯固,李晓林.接种丛枝菌根真菌对甘薯生长的影响研究[J].中国生态农业学报,2004,12(1):111-113.
[14] 范继红,杨国亭,李佳伶.接种VA菌根对黄檗幼苗生长的影响[J].东北林业大学学报,2006,34(2):18-19.
[15] Phillips J M,Hayman D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970,55(1):158.
[16] Koske R E,Gemma J N.A modified procedure for staining roots to detect VA mycorrhizas[J].Mycological Research,1989,92(4):486-488.
[17] 马文彬,姚拓,王国基,等.根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究[J].草业学报,2014,20(5):241-248.
[18] 荣良燕,姚拓,刘青海,等.复合菌肥代替部分化肥对玉米生长的影响[J].草原与草坪,2012,32(3):65-69.
[19] 刘慧,陈薇,周勇,等.内生真菌和丛枝菌根真菌对羊草生长的影响[J].植物生态学报,2015,39(5):477-485.
[20] 苏友波,林春,王三根.AM菌根磷酸酶对玉米菌根际土壤磷的影响及其细胞化学定位[J].西南农业大学学报,2005,25(2):115-119.
[21] 宋勇春,冯固,李晓林.泡囊丛枝菌根对红三叶草根际土壤磷酸酶活性的影响[J].应用与环境生物学报,2000,6(2):171-175.
[22] 苏友波,林春,张福锁,等.不同AM菌根菌分泌的磷酸酶对根际土壤有机磷的影响[J].土壤,2003,35(4):334-338.
[23] Ibijbijen J,Urquiaga S,Ismaili M,etal.Effect of arbuscular mycorrhizal fungi on growth,mineral nutrition and nitrogen fixation of three varieties of common beans(Phaseolus vulgaris)[J].New Phytologist,1999,134(2):353-360.
