富勒烯的开孔和内嵌反应的研究进展
2018-05-22张涛
张涛
(安徽国星生物化学有限公司,安徽省杂环化学重点实验室,安徽 马鞍山 243000)
1985 年,Kroto、Curl和 Smally等[1]在氦气流中以激光汽化蒸发石墨实验中首次制得由60个碳组成的碳原子簇结构分子C60,并推测了其结构。这一新结构立即引起了科学家们的广泛关注。后来,加州大学洛杉矶分校的霍金斯得到了富勒烯衍生物的第一个晶体结构,从而准确测定了富勒烯的结构。人们通过质谱分析、X射线分析证明,C60的分子结构为球形32面体,它是由60个碳原子通过20个六元环和12个五元环连接而成的具有30个碳碳双键足球状空心对称分子(其立体结构如图1所示)。1990年,Kriischmer等[2]首次报道了大量合成C60的方法,这使得C60的研究工作得以大量展开。为表彰Kroto等三人的工作,1996年授予他们诺贝尔化学奖。
由于富勒烯在大部分溶剂中溶解度很差,仅仅在苯或甲苯等芳香性溶剂和二硫化碳中能溶,这大大限制了对富勒烯性质的研究,所以科学家们期望通过化学手段对富勒烯进行修饰,将不同的官能团引入富勒烯单体中,从而合成出具有特殊结构或者性质的富勒烯衍生物。目前,关于富勒烯的化学修饰已经有大量的文献报道,现就近五年有关富勒烯的 嵌反应进行概述。
对于富勒烯开孔和内嵌反应,Whitener Jr.定义[3]其为先用化学方法将C60的笼状结构上的键打开,然后将要掺杂的杂原子从孔里放进去,最后闭环(图2)。

图1 C60的分子结构模型

图2 富勒烯开孔和内嵌反应
对于富勒烯开孔的反应,2009年,甘良兵等[4]通过对含过氧化基团的富勒烯衍生物进行热解发现会发生O-O键的均裂,得到富勒烯含氧自由基,继而生成环氧化合物,然后在羟胺作用下进一步衍生成含酮和肟的最终产物。同年,他们还利用含过氧基的富勒烯衍生物作为起始原料,在醋酸碘苯、苯胺和CuBr的作用下,经过脱缩酮化反应、SN2′环氧开环反应和常规的3,3-σ重排的串联反应,得到一个含18碳孔的开孔衍生物[5],这个18碳孔可以较容易地让水分子进入笼中。开孔衍生物和包嵌水分子的衍生物均已经XRD验证。
2010年,该小组将叠氮三甲基硅烷与含羰基的开孔富勒烯反应,得到第一例含叠氮基团的富勒烯衍生物,这一衍生物与其他含叠氮基团的物质有着非常不一样的反应特性。将该反应产物加热到100℃,只会发生环氧基的断裂,而叠氮基团依然稳定。当用三苯基膦与该叠氮产物反应时会得到膦亚胺衍生物,而膦亚胺衍生物则可以在酸性或碱性条件下进行水解[6]。
同年,该课题组用含六个叔丁过氧基的富勒烯衍生物(这六个过氧基全部集中在五元环上,有着很高的反应活性)与对苯二酚在碱性条件下反应,同时用铝箔遮住反应器以避免光的进入导致键的断裂,可得到含过氧氢的2H-吡喃环衍生物,在二氯化锡作用下过氧基还原为羟基得到产物,再在碳酸钾作用下生成两种含九碳孔的开孔富勒烯衍生物[7]。
2011年,甘良兵等[8]利用醋酸碘苯来氧化富勒烯二醇衍生物C60(OH)2(O)(OAc)(OOtBu)3得到开孔的十一碳孔衍生物2,C60(O)2(O)(OAc)(OOtBu)3,该开孔衍生物在苯胺的作用下,反应生成一个十四碳孔的开孔衍生物,然后再与另一分子的苯胺反应生成十八碳孔的开孔衍生物,若两个苯胺不同,则得到不对称的开孔化合物,降低十八碳孔衍生物的电位可以通过改变苯胺的结构来进行微调。
2013年,该课题组利用制备的含四个过氧叔丁基和环氧的富勒烯衍生物,用三苯基膦和碘进行处理,可以得到碘代富勒烯衍生物,若将它置于大气环境下,经过几天的时间,该衍生物能够逐渐裂解成两种多取代产物和一种开孔衍生物[9](图3)。

图3 碘代富勒烯衍生物的裂解反应
2009年,Kabe Yoshio等[10]用重氮甲硅烷与C60在室温下反应即可得到富勒烯并邻二氮杂茂中间体,脱氮气分子后生成含硅烷基的开环三元环衍生物,这一含硅烷基开环三元环衍生物在单线态氧的作用下得到一个开孔的二酮,然后再发生1,3-硅烷基迁移,最终得到开孔的烯醇硅醚衍生物(图4)。
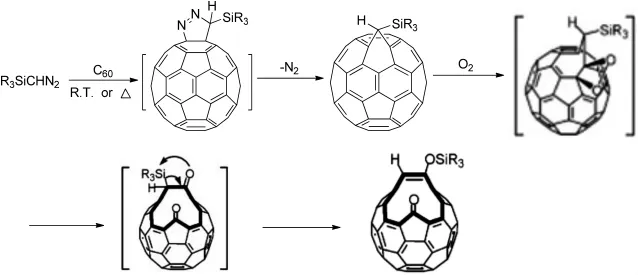
图4 开孔的烯醇硅醚衍生物

图5 富勒烯衍生物络合作用
2011年,Takahiro Tsuchiya等[11]发现内嵌两个镧原子的富勒烯衍生物La2@C80倾向于和供电子的有机分子有络合作用,由于在基态是电子迁移作用使得La2@C80与有机分子形成1∶1络合物,La2@C80/D与 [La2@C80]·-/[D]+在溶液中的平衡是随温度和溶剂的变化而变化的(图 5)。
[1]Kroto,H.W.,Heath,J.H.,O’Brien,S.C.,et al.C60:Buckminsterfullerene[J].Nature,1985,318:162.
[2]Kratchmer,W.,Lamb,L.D.,Huffman,D.R.,et al.Solid C60:a New Form of Carbon[J].Nature,1990,347:354-358.
[3]Keith E.,Whitener,Jr.Theoretical Studies of CH4Inside an Open-Cage Fullerene: Translation-Rotation Coupling and Thermodynamic Effects[J].J.Phys.Chem.A.,2010,114:12075-12082.
[4]Yao,J.-Y.,Yang,D.-Z.,Gan,L.-B.,et al.Synthesis of Fullerene Oxides Containing Both 6,6-Closed Epoxide and 5,6-Open Ether Moieties through Thermolysis of Fullerene Peroxides[J].J.Org.Chem.,2009,74:3528-3531.
[5]Zhang,Q.-Y.,Jia,Z.-S.,Gan,L.-B.,et al.Efficient Cage-Opening Cascade Process for the Preparation of Water-Encapsulated[60]Fullerene Derivatives[J].Org.Lett.,2009,11:2772-2774.
[6]Jiang,Z.-P.,Xiao,Z.,Gan,L.-B.,et a.l.Fullerenyl Azide:Synthesis and Reactivity[J].Tetrahedron Lett,2010,51:415-417.
[7]Yang,D.-Z.Shi,L.-J.,Gan L.-B.,et al.Synthesis and Reactivity of 2H-Pyran Moiety in[60]Fullerene Cage Skeleton[J].J.Org.Chem,2010,75:4567-4573.
[8]Yu,Y.-M.,Xie,X.,Gan,L.-B.,et al.Synthesis of 18-Membered Open-Cage Fullerenes through Controlled Stepwise Fullerene Skeleton Bond Cleavage Processes and Substituent-Mediated Tuning of the Redox Potential of Open-Cage Fullerenes[J].J.Org.Chem,2011,76:10148-10153.
[9]Xin,N.-N.,Yang,X.-B.,Gan,L.-B.,et al.Synthesis of C60(O)3:An Open-Cage Fullerene with a Ketolactone Moiety on the Orifice[J].J.Org.Chem,2013,78:1157-1162.
[10]Kabe,Y.,Hachiya,H.,Ando,W.,et al.Diastereoselective Syntheses and Oxygenation of Silyl Fulleroids [J].Journal of Organometallic Chemistry,2009,694:1988-1997.
[11]Tsuchiya,T.,Wielopolski,M.,Nagase,S.,et al.Stable Radical Anions Inside Fullerene Cages:Formation of Reversible Electron Transfer Systems[J].J.Am.Chem.Soc.,2011,133:13280-13283.□
