两种小鼠颈总动脉内膜增生模型的制备和比较*
2018-05-21魏纯纯任安经章卫平
张 莎 魏纯纯 任安经 章卫平 吴 弘
(海军军医大学,1 附属长海医院心内科; 2 基础医学院病理生理学教研室,上海 200433)
随着介入器械的发展,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)逐年增加,而PCI术后管腔再狭窄是其最常见的并发症之一。虽然药物洗脱支架及药物球囊被广泛应用,但再狭窄率仍接近10%,对于复杂病变,再狭窄率依病变复杂程度及患者的易感性进一步升高[1]。同时,药物非选择性的抗增殖作用抑制血管的再内皮化,导致支架内血栓形成的发生率升高[2]。近些年研发的生物可降解支架理论上可部分解决上述问题,因此,在动物模型上重建血管成型术后内膜增生的病理过程对于探究再狭窄的发生发展机制及治疗策略尤为重要。目前国际上比较公认的小鼠血管内膜增生模型,根据损伤的部位不同,分为股总动脉和颈总动脉;根据损伤方式的不同,可分为结扎和导丝损伤。因此可以衍生出4种不同的术式:股动脉结扎[3]、股动脉导丝损伤[4]、颈总动脉结扎[5]和颈总动脉导丝损伤[6]。以往研究显示:右侧颈总动脉管径更接近于冠状动脉血管结构,且在颈总动脉结扎术后14d,管腔出现明显的新生内膜[5];在颈总动脉导丝损伤术后14d,管腔的再内皮化程度达80%,亦形成明显的新生内膜[7]。因此,本研究选择右侧颈总动脉为手术侧,以血管损伤术后14d为观察终点,探究小鼠颈总动脉结扎及导丝损伤模型的异同及优缺点,进一步指导血管内膜增生模型的应用。
1 材料和方法
1.1 动物喂养与分组
13只10周龄左右,体质量为23~28g,清洁级,雄性C57BL/6小鼠(海军军医大学病理生理教研室动物所提供)。术前饲养于SPF级动物房内,手术于屏障内手术间进行,术后仍饲养于屏障内。将13只小鼠随机分为3组:第1组5只,行颈总动脉结扎术,右侧为手术侧,左侧为阴性对照侧;第2组5只,行颈总动脉导丝损伤术,右侧为手术侧,左侧为阴性对照侧;第3组3只,左右两侧均为正常对照侧。
1.2 主要试剂
苏木素粉剂(BBI Life Sciences);伊红粉剂(上海生工公司); SM22抗体(Bioss公司); Goat-anti-rabbit IgG (Vector Laboratories公司);Fluorescence systems tyramide signal amplification (FITC) (Life Sciences公司);anti-Fluorecein-Alexa Fluor 488 conjugate及DAPI (Molecular Probes公司)。
1.3 颈总动脉结扎模型的制备
按0.4mg/kg的剂量腹腔注射4%水合氯醛麻醉小鼠,5min后,用眼科镊夹尾巴,小鼠反应消失,视为麻醉充分。将小鼠以仰卧位固定于解剖板上,使小鼠躯干垂直于术者,头部位于术者远端。先固定下肢,再固定头部,最后固定上肢,以确保小鼠躯干处于直立位置,有利于手术视野的暴露。用脱毛膏脱去小鼠颈部毛发,常规消毒。取颈部正中切口,长约1cm。沿气管右缘进行钝性分离,暴露右颈总动脉,用弯显微镊尽可能多地向远心端游离颈总动脉,直至暴露颈总动脉分杈,将与之伴行的迷走神经完全分离,在颈总动脉近分杈处用5.0的丝线结扎血管,阻断血流。生理盐水冲洗手术区,缝合切口,消毒皮肤。将小鼠置于37℃暖垫上,待麻醉清醒后置于干净笼内,自由进食、饮水,每天观察小鼠的生命体征。
1.4 颈总动脉导丝损伤模型的制备
麻醉、固定、脱毛过程同结扎模型,颈部正中切口长约1.5cm。分离颈总动脉,在近心端置一根5.0丝线备用。向颈总动脉远端继续钝性分离,可见颈总动脉分杈。首先,尽可能多的游离颈外动脉,近端、远端分别置线;然后,将解剖板顺时针旋转90°,继续游离颈内动脉,游离长度无要求,注意勿损伤与之伴行的迷走神经,在近心端置线。将解剖板继续顺时针旋转90°,先结扎颈外动脉远心端,预结扎近心端;随后,牵拉颈内动脉丝线阻断血流;最后,牵拉颈总动脉丝线阻断血流,从而使颈外动脉处于充盈状态。在颈外动脉结扎处与颈总动脉分杈之间,用显微剪与血管呈45°剪开一V型切口,以切口底边占颈外动脉血管周长的1/3至1/2为宜。用自制钩针勾住V型瓣,向上提拉,用显微镊夹持直径为0.38mm的金属导丝,插入血管腔,导丝进入长度8mm,在10s时间内缓慢来回抽动5次,以造成内膜剥离。在撤出导丝的同时,牵拉颈总动脉丝线阻断血流,防止出血。结扎颈外动脉近心端。余步骤同颈总动脉结扎模型。
1.5 取材
术后14d行颈总动脉超声检查,随后处死,取材。麻醉、固定、切开操作同手术过程。钝性分离双侧颈总动脉,每根血管下各置2根5.0的丝线,供提拉血管用。剪开胸腔,暴露心,剪开右心房,从心尖插入灌注针,后接10ml注射器,1min左右注入约10ml的灌注用PBS,冲洗血管腔内的血流。随后在3min左右的时间缓慢注入约20ml的预冷的4%多聚甲醛,初步固定血管形态。先取损伤侧血管,提拉预留的丝线,用显微剪剪开颈总动脉近心端,此处剪取尽可能长的颈总动脉。用显微镊夹住血管近心端,提拉预留的丝线,在颈总动脉分杈处剪断血管(结扎侧紧贴结扎线结的近心端剪断血管),术者要铭记血管方向,切勿弄反。将取下的血管浸入盛有4%多聚甲醛的60mm的培养皿,在解剖显微镜下,分离血管外膜,对血管近心端进行修剪,预留血管长度约2mm。将血管置于擦镜纸上,并用铅笔画圈标记血管位置,画箭头标记血管方向。用擦镜纸包裹血管于包埋框,置于4%多聚甲醛中,4°摇床固定2h,常规制备蜡块。注意包埋时,颈总动脉近心端朝下直立包埋血管。
1.6 切片与贴片
从切到血管开始,每20片为1组,每片厚度为4μm,按顺序排放在白纸板上,直至血管被切完,共计15~20片组织切片。由于血管较小,可在显微镜下观察以确定蜡片上是否存在血管。从最后1组开始,从后往前(即从颈总动脉分杈处向近心端)在摊片机水槽内进行捞片,每组取1片,共计取10组(即远离分杈处的血管弃用),于同1张玻片上,按顺序从A-J编号,此之为1套,共计取10套,并按顺序从110标号。结扎侧与非结扎侧处理方法相同。在后续实验中,均取相同标号相同编号的组织进行比较,以尽可能的做到比较部位的一致性。
1.7 形态学检测方法
利用上述组织切片,行H-E染色评价颈总动脉组织结构。免疫荧光SM22染色:一抗SM22(1∶300),二抗Goat-anti-rabbit IgG(1∶300),放大液FITC (1∶50),anti-FITC-Alexa Fluor 488(1∶300),阳性表达为绿色荧光,用DAPI染细胞核。在荧光显微镜成像系统(BX53,Olympus)下拍照,用ipwin326软件进行图像分析。
1.8 统计学处理
2 结果
2.1 血流速度分析
正常情况下,双侧颈总动脉血流速度无明显差异。结扎术后14d,结扎侧无明显血流信号,对侧血流代偿性增快。与正常对照的左侧颈总动脉相比,非结扎侧血管最大收缩期流速(systolic velocity peak,SVP)、舒张末期流速(end-diastolic velocity,EDV)均加快,差异均有统计学意义(P<0.01);而阻力指数(resistance index,RI)无明显差异。导丝损伤术后14d,导丝损伤侧SVP均较对侧增快(P<0.05),EDV较对侧降低(P<0.05),RI较对侧升高(P<0.01),差异均有统计学意义。与正常对照的颈总动脉相比,导丝损伤侧及其对侧血流均增快(P<0.01),导丝损伤侧阻力指数升高(P<0.01),差异均有统计学意义。与非结扎侧相比,非导丝损伤侧血管血流速度及阻力指数均无显著差异(表1,图1)。
**P<0.01vsnormal (left) group;△△P<0.01vsnormal (right) group;##P<0.01vsnon-ligation side group;□P<0.05,□□P<0.01vsnon-wire injury side
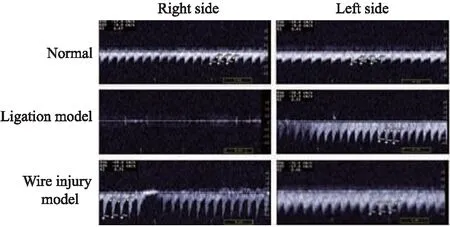
图1 术后14d颈总动脉超声检测血流变化Fig 1 The blood flow velocity of common carotid artery 14d after operation
2.2 新生内膜的形成
对于正常的血管,内膜层由单层扁平上皮及内膜下基质构成,H-E染色下内膜层不可见,面积近似为0μm2。非手术侧血管壁光滑,可见中膜层排列有致的弹性纤维板;而结扎侧及导丝损伤侧中膜层细胞核增大,中膜增厚,伴新生内膜形成。内膜中细胞排列紊乱,细胞核较中膜层小,无弹性纤维板。与导丝损伤侧相比,结扎侧新生内膜面积(P<0.01)、中膜面积(P<0.05)及内中膜比(P<0.01)均明显大于导丝损伤侧,且两组间差异均有统计学意义(表2,图2)。与正常对照的左侧颈总动脉相比,非结扎侧及非导丝损伤侧血管形态无显著差异。
2.3 平滑肌细胞去分化程度
平滑肌细胞特异性标志分子SM22染色结果表明:术后14d,非结扎侧及非导丝损伤侧血管中膜层全层均匀一致高表达SM22;但手术侧中膜层SM22的表达量明显降低,以新生内膜处降低最为显著,且结扎侧血管SM22表达量低于导丝损伤侧,提示与导丝损伤相比,结扎血管使平滑肌细胞由分化型转变为去分化型的程度更加明显(图3)。与正常对照的左侧颈总动脉相比,非结扎侧及非导丝损伤侧血管SM22表达量无显著差异。
表2 术后14d各组的血管形态学指标Tab 2 Morphological analysis 14d after operation (n=5,
*P<0.05 ,**P<0.01vsligation side
3 讨论
3.1 关于两组模型操作的主要体会
本研究结果表明颈总动脉结扎模型操作简单,术者稍加练习即可得到稳定的结果。而导丝损伤模型操作复杂,技术难点较多,如:熟练的分离3根颈总动脉、V形切口深度的把握、导丝的进入、导丝的抽动等等,需花费大量时间一一攻克。最终即使上述步骤均熟练掌握,还会因小鼠血管结构的个体差异而出现内膜增生程度的不稳定。导丝成功进入血管后,术者感受到的阻力,大体上可分为以下3种情况:(1) 导丝进出通畅,不感阻力,可能是由于导丝相对血管细,不能有效损伤血管内皮,模型失败;(2) 导丝进出通畅,全程可感均匀一致的摩擦阻力,提示导丝与血管贴合良好,可导致血管壁的有效损伤;(3) 导丝进出困难,可感明显摩擦阻力,在导丝前端有时可看到白色絮状团块。可能是由于导丝相对血管粗,不仅损伤血管内皮层,甚至触及浅层的平滑肌层,易导致血管夹层,甚至血管破裂。通常将第2种情况的小鼠纳入实验,进而可提高颈总动脉导丝损伤模型结果的稳定性。
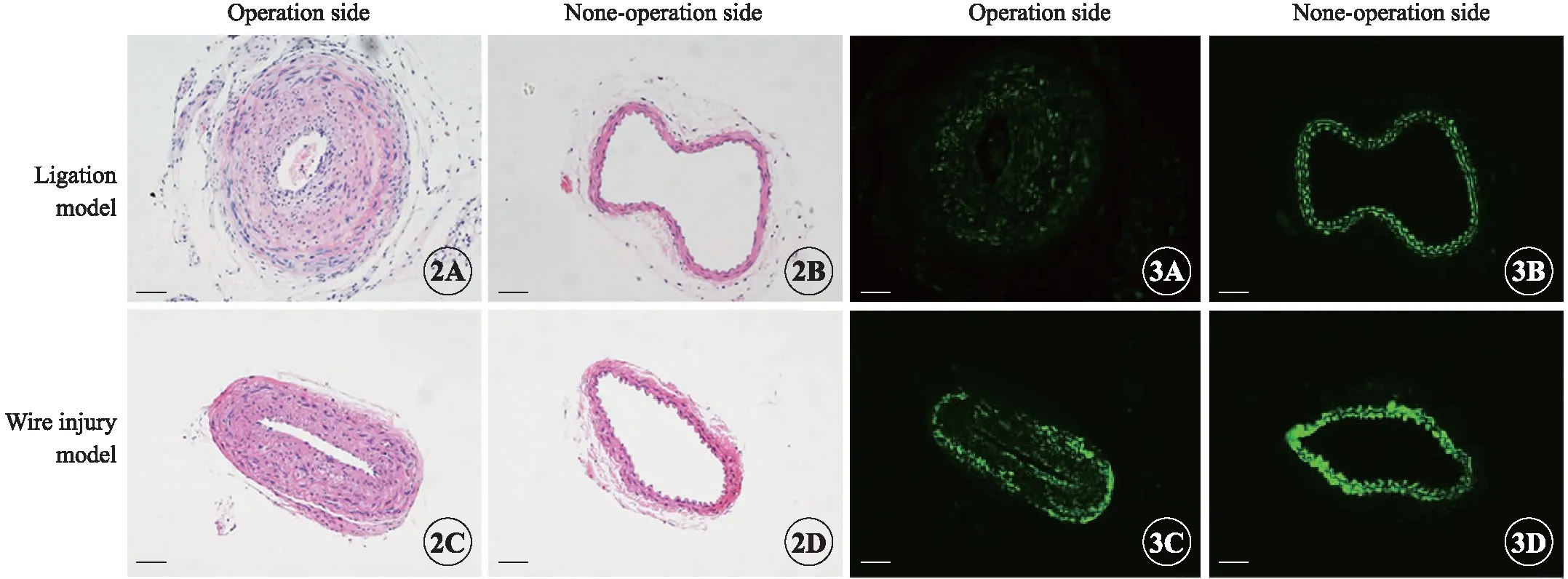
图2 术后14d颈总动脉H-E染色,×200.
图3 术后14d颈总动脉SM22染色,×200.
Fig 2 H-E staining of common carotid artery 14d after operation,×200.
Fig 3 SM22 staining of common carotid artery 14d after operation,×200.
3.2 关于2组模型内膜增生机制的探讨
上述2种内膜增生模型其血管新生内膜形成的机制各不相同,但中膜层的平滑肌细胞均被不同程度的激活,由分化型转变为去分化型,合成并分泌大量细胞外基质,促进其增殖、迁移,进而形成新生内膜。血管结扎模型通过阻断血流引起结扎侧颈总动脉内剪切力改变,血管壁搏动及所受压力增强,触发内皮细胞分泌白细胞黏附分子、趋化因子等,导致炎症微环境,进而激活平滑肌细胞[8]。而导丝损伤模型是通过完全剥脱血管内皮细胞,一方面使邻近的内皮细胞增殖、迁移以修复内皮层;另一方面,中膜层的平滑肌细胞直接暴露于血流中被激活[9],术后28d时血管腔的再内皮化基本完成,此时平滑肌细胞的增殖即终止[7]。与颈总动脉导丝损伤模型相比,颈总动脉结扎后新生内膜、中膜增厚较显著,内中膜比及血管平滑肌细胞的去分化程度更高。
3.3 关于2组模型各自的适应症
就其病理意义而言,导丝损伤模型主要用于探究机械损伤内皮细胞后对平滑肌细胞功能的影响,可用于模拟PCI术后早期管腔再狭窄的病理生理过程[10]。颈总动脉结扎模型主要用于探究血流剪切力的改变对平滑肌细胞功能的影响,可用于模拟PCI术后晚期(管腔再内皮化已完成后)管腔再狭窄的病理生理过程[5]。
3.4 其他
近些年,越来越多的研究者开始关注股动脉的导丝损伤[3,11]。在组织学上,颈总动脉属于大动脉,而股动脉和冠状动脉同属于中动脉,因此,在模拟冠状动脉血管增殖性疾病方面,股动脉比颈总动脉可能更契合相关病理过程。但由于小鼠股动脉管径太细,手术难度进一步增加,对术者及手术器械的要求更高,稳定性更差,而且会不同程度的影响小鼠术肢的功能。目前,尚未得到广泛的使用。
参 考 文 献
[1] Dehmer G J,Smith K J.Drug-eluting coronary artery stents[J].Am Fam Physician,2009,80(11):1245-1251.
[2] Gareri C,Rosa S D,Indolfi C.MicroRNAs for restenosis and thrombosis after vascular injury[J].Circ Res,2016,118(7):1170-1184.
[3] Chen Q S,Yang F,Guo M Q,et al.miRNA-34a reduces neointima formation through inhibiting smooth muscle cell proliferation and migration[J].J Mol Cell Cardiol,2015,89:75-86.
[4] Afzal T A,Luong L A,Chen D,et al.NCK associated protein 1 modulated by miRNA-214 determines vascular smooth muscle cell migration,proliferation,and neointima hyperplasia[J].J Am Heart Assoc,2016,5(12):e004629.
[5] Li P,Zhu N,Yi B,et al.MicroRNA-663 regulates human vascular smooth muscle cell phenotypic switch and vascular neointimal formation[J].Circ Res,2013,113(10):1117-1127.
[6] Iaconetti C,De Rosa S,Polimeni A,et al.Down-regulation of miR-23b induces phenotypic switching of vascular smooth muscle cells in vitro and in vivo[J].Cardiovasc Res,2015,107(4):522-533.
[7] 朱丽华,王朗,陈静.小鼠颈动脉导丝损伤模型建立与特点分析研究[J].岭南心血管病杂志,2012,18(4):431-437.
[8] Kumar A,Lindner V.Remodeling with neointima formation in the mouse carotid artery after cessation of blood flow[J].Arterioscler Thromb Vasc Biol,1997,17(10):2238-2244.
[9] Lindner V,Fingerle J,Reidy M A.Mouse model of arterial injury[J].Circ Res,1993,73(5):792-796.
[10] Kessler T,Zhang L,Liu Z,et al.ADAMTS-7 inhibits re-endothelialization of injured arteries and promotes vascular remodeling through cleavage of thrombospondin-1[J].Circulation,2015,131(13):1129-1201.
[11] Takayama T,Shi X,Wang B,et al.A murine model of arterial restenosis:technical aspects of femoral wire injury[J].J Vis Exp,2015,(97):e52561.