嗜蓝孢孔菌新种Fomitiporia yanbeiensis S.Guo&L.Zhou液体发酵培养条件研究
2018-05-21刘晓钢周林徐莉娜李艳婷周伟郭尚侯雷平山西农业大学园艺学院山西太谷03080山西省农业科学院食用菌研究所山西太原03003
刘晓钢,周林,徐莉娜,李艳婷,周伟,郭尚*,侯雷平*(.山西农业大学 园艺学院,山西 太谷 03080;.山西省农业科学院 食用菌研究所,山西 太原 03003)
1 材料与方法
1.1 材料
试材:FomitiporiayanbeiensisS. Guo & L. Zhou 菌株由山西省农业科学院食用菌研究所提供(SXSYJJZ No.1510)。
培养基:(1)平板培养基:PDA。(2)液体培养基:营养源:葡萄糖(2 %)、蛋白胨(3 %)、KH2PO4(0.05 %)、MgSO4(0.05 %)、VB1(100 μg·L-1)、VB2(500 μg·L-1);培养条件:转速130 r·min-1、温度24 ℃、pH自然;制作方法:将营养成分在水中溶解后放于装有80 mL发酵培养液的250 mL三角培养瓶中经121 ℃,0.15 MPa灭菌0.5 h后备用。
试剂:氢氧化钠(GB/T 601-2002)、可溶性淀粉(Starch soluble CASNO:9005-84-9)尿素和蛋白胨(CASNO:57-13-6)为天津市大茂化学试剂厂生产,葡萄糖(HG/T 3475-1999,天津市永大化学试剂有限公司)、乳糖(HG/T 346-2012,天津市科密欧化学试剂有限公司)、蔗糖(HG/T 3462-2013,天津市恒兴化学试剂制造有限公司)、海藻糖(日本林原)、硫酸铵(GB/T 1396-1993 XK13-201-0015,天津市风船化学试剂科技有限公司)、牛肉膏、豆粕粉和VB1(北京奥博星生物技术有限责任公司)、VB2(天津市光复精细化工研究所)。
仪器与设备:高压灭菌锅、pH分析仪、40目过滤网、打孔器、分析天平、电热鼓风干燥箱、高速离心机、恒温摇床、磁力搅拌器、匀浆器等。高速离心机(Eppedorf)、高压灭菌锅(重庆雅马拓科技有限公司)、PH分析仪(ST2100,奥豪斯仪器(常州)有限公司)、分析天平(ST2100,METTLER TOLEDO Made in Suitzerland)、电热鼓风干燥箱(GR-23,上海博迅实业有限公司医疗设备厂)、恒温摇床(GR-200,上海茸研仪器有限公司)、磁力搅拌器(上海博讯设备有限公司)。
1.2 试验方法
1.2.1 液体发酵液的培养方法
将山西省农业科学院食用菌研究所提供菌株接种到1.1中的无菌平板培养基当中,于24 ℃在恒温培养箱中避光培养,待菌丝长满后用打孔器在平板上取直径为0.2 cm大小菌种,将其接种到装有80 mL发酵培养液的250 mL三角培养瓶中,在转速130 r·min-1、温度24 ℃、pH为7.0的条件下培养7 d,接种时将菌种在磁力搅拌器上搅成匀质后,在超净工作台上用移液枪接种到液体培养瓶中在恒温摇床上震荡培养。
1.2.2 单因素试验
分别对液体培养的碳源、氮源、pH、接种量、培养温度进行试验分析(表1),试验设3次重复。
表1单因素试验和水平
Table1 The experimental conditions of single factor and levels
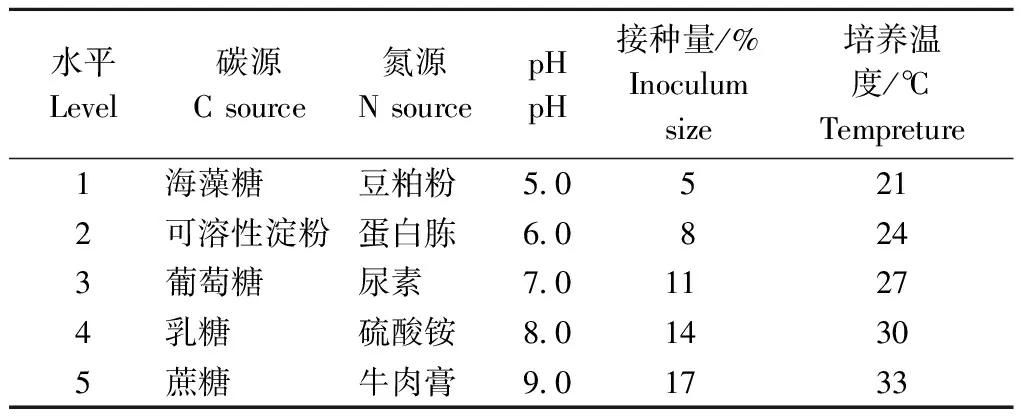
水平Level碳源Csource氮源NsourcepHpH接种量/%Inoculumsize培养温度/℃Tempreture1海藻糖豆粕粉5 05212可溶性淀粉蛋白胨6 08243葡萄糖尿素7 011274乳糖硫酸铵8 014305蔗糖牛肉膏9 01733
1.2.3 正交试验优化高产菌球生物量培养基配方
在以上单因素试验基础上,选择碳源、氮源、磷酸二氢钾和硫酸镁作为四种考察因素,每组试验设三次重复(表2)。以发酵液的菌球生物量作为测定指标,通过正交试验确定培养基最佳配方。
表2正交试验因素和水平
Table2 The experimental conditions of orthogonal factors and levels

水平Level因素FactorA海藻糖/g·L-1TrehaloseB豆粕粉/g·L-1SoybeanmealpowderC硫酸镁/g·L-1MagnesiumsulfateD磷酸二氢钾/g·L-1Monopotassiumphosphate115250 250 25220300 500 50325350 750 75
1.2.4 子实体与液体菌丝球中功能性成分测定
将采集的子实体和液体发酵后的菌球在40 ℃的干燥箱中进行干燥72 h,直至重量不在变化,粉碎处理,测量子实体与液体菌丝球中功能性成分含量,并进行分析比对。
1.3 指标测定
试验中测定的主要指标有菌球生物量、菌球的直径、菌球萌发活力指数。
1.3.1 菌球生物量
将培养完成的发酵液在磁力搅拌器上充分混匀后,取50 mL在高速离心机在6 000 r·min-1下离心15 min,用40目过滤网过滤后,将沉淀置于60 ℃的电热鼓风干燥箱中烘干至恒重测量菌球生物量并记录。
1.3.2 菌丝生长速度
从发酵液中随机挑取肉眼可见的10个菌球,将其放在平板培养基上培养3 d,统计平板上萌发的菌落个数并用精度为0.1 mm的数显卡尺测菌落直径大小,取平均值求得菌丝日生长速度。
1.3.3 菌球萌发活力的测定
A=d × C / T
式中:A为菌球萌发活力指数,d为菌落直径,C萌发个数,T为萌发时间。
1.3.4 功能性成分测定
三萜类化合物:参照DB44/T 496-2008,以齐墩果酸为标准进行测定。
总黄酮:紫外分光光度法[13],以芦丁为标准进行测定。
β-葡聚糖:荧光法进行测定[14]。
1.4 数据分析方法
所有试验均为3次重复,各项指标结果用Excel 2003作图,Minitab l5软件进行分析。
2 结果与分析
2.1 不同的碳源对菌球生物量、菌丝生长速度和菌球萌发活力指数的影响
由表3可见,不同的碳源对菌球的影响较大,从菌球生物量和菌丝生长速度来看,其中C1与其余四种不同的碳源培养基有显著性差异,菌球生物量和菌丝生长速度最高分别为1.94 g·100 mL-1和2.44 mm·d-1,C4的最低分别为0.94 g·100 mL-1和0.26 mm·d-1。从菌球萌发活力指数看,C1的最大为2.43,菌丝萌发活性最好,C3、C5、C2次之,C4萌发活力指数最小为0.54。综合以上分析C1作为碳源较好,菌丝萌发活力强,生长速度快,菌丝生物量高。
表3不同碳源对菌球生长状态的影响
Table3 Effects of different carbon sources on the growth status of the mycelium pellets

编号Number碳源Carbonsource菌球生物量/g·100mL-1Mygelialbiomass菌丝生长速度/mm·d-1Growthrateofmycelium菌球萌发活力指数GerminationvigourindexofthemycelialpelletsC1海藻糖1 94±0 11a2 44±0 41a2 43±0 32aC2可溶性淀粉1 36±0 11bc1 21±0 20b1 48±0 17bC3葡萄糖1 57±0 09b1 24±0 21b2 21±0 16aC4乳糖0 94±0 06c0 26±0 04c0 54±0 18cC5蔗糖1 55±0 05b1 40±0 23b1 56±0 10b
注:表中数据后小写字母代表0.05差异水平(下同)
Note: The lowercase letters after the data in the table represent the 0.05 difference level (the same below)
2.2 不同的氮源源对菌球生物量、菌球密度和菌球活力指数的影响
从表4知,在菌球生物量、菌丝生长速度和菌球萌发活力指数中,N1与N2无显著差异,N1与N3、N4、N5之间存在显著性差异;N1的菌球生物量、菌丝生长速度和菌球萌发活力指数最高分别为1.60 g·100 mL-1、2.43 mm·d-1和2.64,其中N4利用效率较低,N3为氮源时菌球在平板上并不生长,说明其有效成分很难被利用。综合分析来看N1效果最好,N2、N5、N4次之,N3效果最差。
表4不同氮源对菌球生长状态的影响
Table4 Effects of different nitrogen sources on the growth status of the mycelial pellets
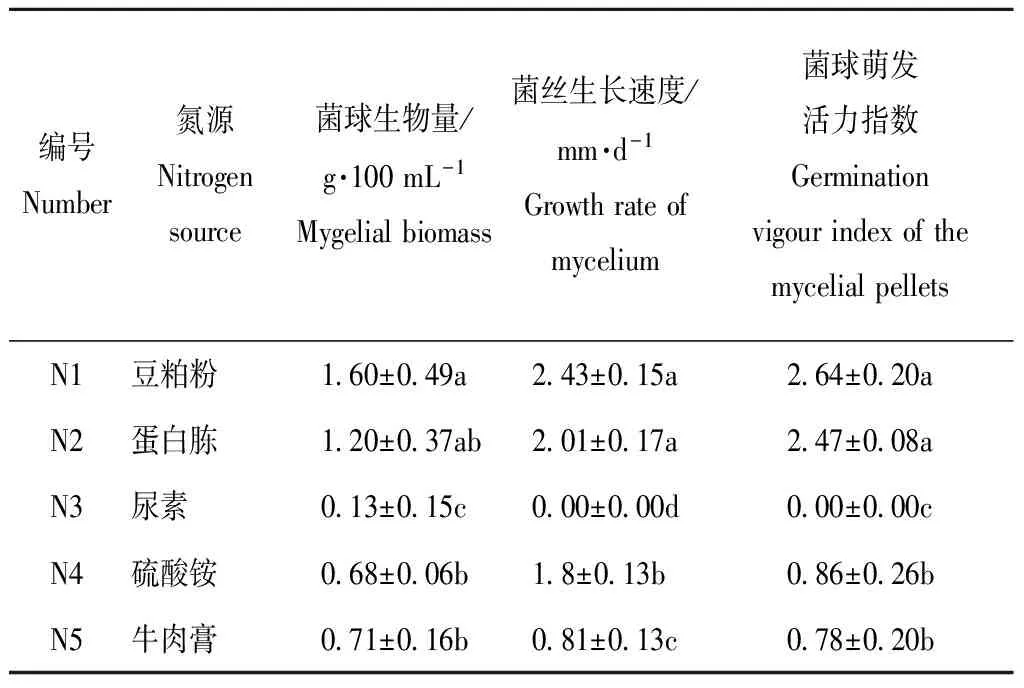
编号Number氮源Nitrogensource菌球生物量/g·100mL-1Mygelialbiomass菌丝生长速度/mm·d-1Growthrateofmycelium菌球萌发活力指数GerminationvigourindexofthemycelialpelletsN1豆粕粉1 60±0 49a2 43±0 15a2 64±0 20aN2蛋白胨1 20±0 37ab2 01±0 17a2 47±0 08aN3尿素0 13±0 15c0 00±0 00d0 00±0 00cN4硫酸铵0 68±0 06b1 8±0 13b0 86±0 26bN5牛肉膏0 71±0 16b0 81±0 13c0 78±0 20b
2.3 不同的pH对菌球生物量、菌球密度和菌球活力指数的影响
在表5中,不同梯度的pH对菌球的影响较大,从菌球生物量看P4最高为1.58 g·100 mL-1,相比较其余4个梯度有显著性差异,P4条件下的菌球生物量分别是P1、P3、P2、P5的2.11、 1.64、1.50、2.17倍;从菌丝生长速度看,P4与P3不存在显著性差异,但与P1、P2、P5之间存在显著性差异;从菌球萌发活力看,P4的活力指数最高为2.72,P1的最低为0.78,P4的萌发活力指数分别是P1、P3、P2、P5的3.48、2.40、1.25及1.40倍。综合分析最适宜的发酵培养液pH是P4,依次是P3、P5、P2和P1。
表5不同pH对菌球生长状态的影响
Table5 Effects of different pH on the growth status of the mycelial pellets
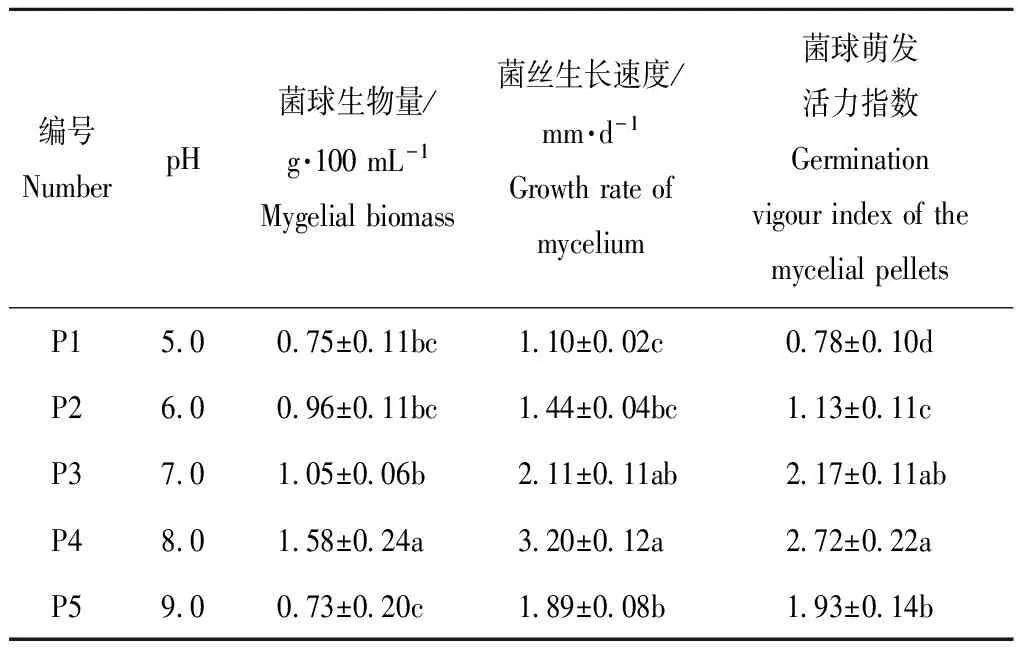
编号NumberpH菌球生物量/g·100mL-1Mygelialbiomass菌丝生长速度/mm·d-1Growthrateofmycelium菌球萌发活力指数GerminationvigourindexofthemycelialpelletsP15 00 75±0 11bc1 10±0 02c0 78±0 10dP26 00 96±0 11bc1 44±0 04bc1 13±0 11cP37 01 05±0 06b2 11±0 11ab2 17±0 11abP48 01 58±0 24a3 20±0 12a2 72±0 22aP59 00 73±0 20c1 89±0 08b1 93±0 14b
2.4 不同的接种量对菌球生物量、菌球密度和菌球活力指数的影响
从表6可以看出,菌种的接种量大小直接影响菌球的生物量、菌丝生长速度和菌球的萌发活力。J2在菌丝生长速度上和菌球萌发活力指数上最好分别为3.82 mm·d-1和2.97,但是菌丝生物量太少为1.46 g·100 mL-1,可能是由于接种量小,发酵液营养液比较丰富导致J2的菌球营养利用空间大,菌球活力较强,菌丝生物量较少。J4在菌球生物量上含量最高为2.28 g·100 mL-1,J4与J2菌丝的萌发活力指数有显著性差异,这说明接种量的太大了可能导致菌球萌发的减弱。
表6不同接种量对菌球生长状态的影响
Table6 Effects of different inoculum concentrations on the growth status of the mycelial pellets

编号Number接种量/%Inoculumconcentrations菌球生物量/g·100mL-1Mygelialbiomass菌丝生长速度/mm·d-1Growthrateofmycelium菌球萌发活力指数GerminationvigourindexofthemycelialpelletsJ15%0 85±0 02b2 13±0 06ab2 63±0 03abJ28%1 46±0 01b3 82±0 12a2 97±0 01aJ311%1 70±0 07ab2 89±0 04ab2 61±0 04abJ414%2 28±0 05a2 27±0 14ab2 26±0 12bJ517%2 05±0 06ab0 81±0 03c1 82±0 08c
2.5 不同的培养温度对菌球生物量、菌球密度和菌球活力指数的影响
从表7可知,不同的培养温度对菌球的各项指标影响不同,菌丝在T1-T5五个梯度之间都可以生长,菌球生物和菌球萌发活力指数在T3时最高分别为1.75 g·100 mL-1和2.79,T3时菌丝生长速度最快为0.31 mm·d-1,T2与T3在菌丝生长速度和菌球生物量上没有显著性差异,表明有利于发酵培养液的温度最适宜的为T3,其余的顺序以此为:T2>T4>T1>T5。
2.6 主要营养因素对菌球生物量影响的正交试验
由表8可知,在4个因素之中,对菌球生物量影响程度的大小排列依次为A(海藻糖)>B(豆粕粉)>D(KH2PO4)>C(MgSO4),碳源的极差为0.47,氮源的极差为0.26,表明其中碳源和氮源的为主要影响因素。最佳培养基配方组合为A2B3C1D2。从正交试验结果来看,高产菌球生物量最高培养基配方为海藻糖20 g·L-1、豆粕粉35 g·L-1、KH2PO40.5 g·L-1和MgSO40.25 g·L-1。
表7不同培养温度对菌球生长状态的影响
Table7 Effects of different incubation temperature on the growth status of the mycelial pellets
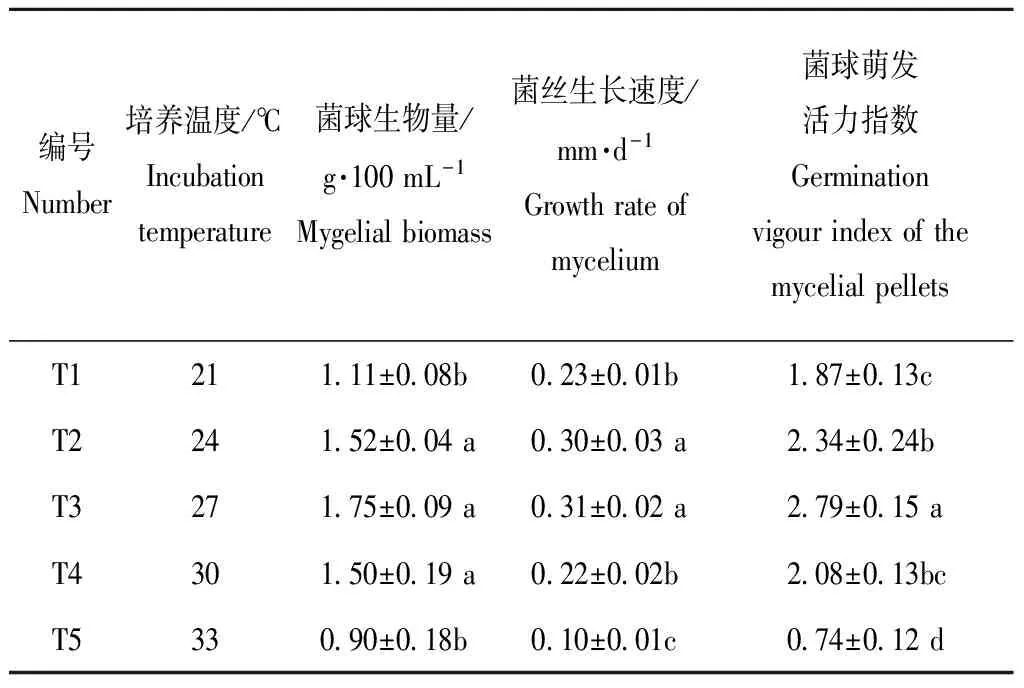
编号Number培养温度/℃Incubationtemperature菌球生物量/g·100mL-1Mygelialbiomass菌丝生长速度/mm·d-1Growthrateofmycelium菌球萌发活力指数GerminationvigourindexofthemycelialpelletsT1211 11±0 08b0 23±0 01b1 87±0 13cT2241 52±0 04a0 30±0 03a2 34±0 24bT3271 75±0 09a0 31±0 02a2 79±0 15aT4301 50±0 19a0 22±0 02b2 08±0 13bcT5330 90±0 18b0 10±0 01c0 74±0 12d

表8 正交试验结果直观分析表Table 8 The result and range analysis of orthogonal testing
2.7 验证试验
试验的培养基配方:海藻糖20 g·L-1、豆粕粉35 g·L-1、KH2PO40.5 g·L-1、MgSO40.25 g·L-1、VB1100 μg·L-1、VB2500 μg·L-1,培养条件温度27 ℃、起始pH为8.0、接种量为11 %为培养基配方,该条件下作为优化后的培养基配方,进行验证试验。结果显示,菌球生物量为2.36 g·100 mL-1与试验值相对误差为2.48 %,说明该正交试验合理可靠。
2.8 子实体与液体菌丝球中功能性成分分析
由表9可知,按照正交设计优化后产出的液体菌丝体与该菌的子实体的功能成分含量相差比较大,发酵菌丝体中三萜类化合物含量是子实体中的4.66倍,黄酮含量是子实体中的25.80 倍,β-葡聚糖含量是子实体中的2.38倍,相对与新鲜子实体,液体菌丝体的有效功能成分含量更高,为该菌的液体发酵技术开发研究奠定了理论基础。
表9子实体中和发酵菌丝体中的功能性成分含量
Table9 The content of functional components in the fruiting body and the fermented mycelium

功能性成分Functionalcomponent子实体Ediblefungus液体菌丝体Liquidmycelium三萜类化合物/mg·100g-1120559黄酮/mg·100g-16 59170β⁃葡聚糖/mg·g-113 431 78
3 讨论与结论
嗜蓝孢孔菌新种FomitiporiayanbeiensisS. Guo & L. Zhou 是一种珍稀的食药用真菌,含有丰富的三萜、黄酮、多糖等有益成分,本文对其液体发酵工艺进行优化培养,筛选最佳培养条件和培养基配方,以提高发酵菌球生物量替代野生野生资源的开采。
在试验测试中,微小的菌丝球不容易观察计数,因此试验并未将菌球密度作为指标来衡量,而是将菌球生物量、菌球萌发活力指数和菌丝生长速度为主要技术指标进行优化培养,更加真实体现菌球的萌发活力。在碳源试验中发现海藻糖相比其它的4种碳源更容易被吸收利用,可能是因为海藻糖在恶劣环境条件下可以在细胞表面能形成独特的保护膜,维持细胞完整性和保护细胞[15],导致在发酵后期菌球仍有很好的活性。不同的氮源单因素试验结果表明用豆粕粉更有利于形成菌球,这有可能是豆粕粉在液体发酵高温灭菌后发生了糊化作用,增加了培养基的粘度,有利于菌物分散形成菌球,这与董玉兰[8]等在白灵菇高活力液体菌种培养条件的研究中一致。在不同的pH试验中筛选的最始pH为8.0,相对于郭尚[16]等研究的最适pH较高,孟泽彬[17]等在研究古尼虫草胞内多糖高产培养基优化研究认为发酵液的pH在最初发酵的72 h内下降很快,导致的最适起始pH较高,也有能是该种采集于盐碱地域,其土壤pH比较高,从而导致其最适pH比较高,至于是环境因素还是发酵培养的影响,还有待进一步考察研究。试验中也发现接种量多少能够直接影响发酵的菌球生物量,接种量为11 %时菌球萌发快和菌球生物量高。FomitiporiayanbeiensisS. Guo & L. Zhou也具有较广的生长温度,21~33 ℃均可生长,最适宜的是27 ℃与郭尚[16]等研究的基本一致。在子实体与液体菌丝球中功能性成分分析中发现发酵菌丝体中三萜类化合物、黄酮和β-葡聚糖的含量分别是子实体中的4.66倍、25.80倍和2.38倍,液体菌丝体比新鲜子实体的功能性成含量高,这也为该菌的液体发酵技术开发研究奠定了理论基础。
发酵工艺的优化是提高FomitiporiayanbeiensisS. Guo & L. Zhou菌球生物量最有的效途径,以该菌的功能性成分为测量指标,分析和建立温度、接种量、转速和灌装量共同作用的交互模型是今后工作的重点研究方向,与此同时也应该加强该菌株的菌种抗性的研究。
试验通过单因素试验和正交试验对嗜蓝孢孔菌新种FomitiporiayanbeiensisS. Guo & L. Zhou的液体菌种培养条件进行优化研究,结果显示:(1)最佳的碳源是海藻糖,最适的氮源是豆粕粉,最适的培养温度27 ℃,最适起始pH为8.0,最适的接种量为11 %。(2)最佳培养基组合是:海藻糖20 g·L-1、豆粕粉35 g·L-1、KH2PO40.5 g·L-1、MgSO40.25 g·L-1,用该培养基可获得菌球生物量2.36 g·100 mL-1,相比较优化前增加了1.39倍。
参 考 文 献
[1]郭尚,周林,徐莉娜,等. 嗜蓝孢孔菌属(Fomitiporia)一新种[J].西南农业学报,2017,30(10):2334-2339.
[2]郭尚,庞荣,郭丽宏,等. 嗜蓝孢孔菌属一新种的营养成分及其急性毒性分析[J].中国食用菌,2016,35(4):54-57.
[3]魏立敏,高宝宁. 珍稀食药用真菌——榆耳的开发与利用[J]. 中国林副特产,2014(6):91-92.
[4]王义勋,陈京元. 湖北省大型真菌生物多样性及资源开发利用[J]. 湖北林业科技,2010(6):36-39.
[5]戴玉成. 中国多孔菌名录[J]. 菌物学报,2009,28(3):315-327.
[6]Ziping Zhu. Establishment and Analysis of the Fermentation Model of pHellinus Igniarius[A]. American Applied Sciences Research Institute, AASRI.Proceedings of 2012 AASRI Conference on Computational Intelligence and Bioinformatics (CIB 2012 V1)[C].American Applied Sciences Research Institute, AASRI:智能信息技术应用学会,2012:6.
[7]曹婧,张九天. 北虫草液体菌种培养的研究[J]. 中国农业信息,2014,(24):55-57,95.
[8]董玉兰,李书生,张丽萍,等. 白灵菇高活力液体菌种摇瓶发酵培养条件的优化[J]. 北方园艺,2014,(06):143-146.
[9]黄竹青,郑剑玲,邓铁宏,等. 白色金针菇液体菌种制备及工厂化生产应用初探[J]. 微生物学杂志,2013,33(02):75-79.
[10]李超,李红,张敏. 黑木耳液体培养基配方优化[J]. 北方园艺,2017(16):170-173.
[11]宋德龙,贠建民,艾对元,等. 双孢蘑菇工业化生产液体菌种繁育条件的优化[J]. 食品与发酵工业,2013,39(2):86-91.
[12]董玉兰,陈艳光,李书生,等. 白灵菇高活力液体菌种培养条件研究[J]. 中国农学通报,2014,30(7):82-85.
[13]刘洪梅,陈玉婷,何立美,等. 紫外-可见分光光度法测定枫蓼水煎液中总黄酮含量[J].中国畜牧兽医,2014,41(6):140-144.
[14]邓万和.燕麦中β-葡聚糖的含量分析及其性质研究[D].北京:中国农业大学,2005.
[15]张兰馨,张部昌.海藻糖分子的细胞保护作用研究进展[J].中国医药生物技术,2008,3(6):465-467.
[16]郭尚,李艳婷,周林,等. 嗜蓝孢孔菌新种FomitiporiayanbeiensisS. Guo & L. Zhou菌丝培养条件研究[J]. 安徽农学通报,2017,23(15):25-26,50.
[17]孟泽彬,文庭池,雷帮星,等. 古尼虫草胞内多糖高产培养基优化研究[J]. 菌物学报,2016,35(2):199-208.
