载多烯紫杉醇及酞菁锌并靶向乳腺癌多功能分子探针体外光声显像特性及寻靶能力
2018-05-21黄晓玲陈瑜莉冉海涛
喻 滔,黄晓玲*,曹 阳,陈瑜莉,冉海涛
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所,超声分子影像重庆市重点实验室,重庆 400016)
光声成像(photoacoustic imaging, PAI)利用光声效应成像,具有光学成像的高对比度和超声成像的良好组织穿透力,能实时收集包括结构、功能、代谢和分子信息在内的多种生理病理数据[1-2],且无辐射[3]。近年来对光声成像的研究一方面是关于光声成像技术方法的改进及应用[4-7];另一方面是制备具有多种功能的造影剂,将光声成像与治疗方法结合,实现诊疗一体化[8-9]。目前常用光声成像剂有金纳米棒[10]和吲哚菁绿(indocyanine green, ICG)。金纳米棒价格昂贵;ICG是目前唯一被FDA批准用于临床的染料分子,但其稳定性较差、体内清除快。酞菁锌(ZnPc)作为第二代光敏剂,具有光稳定性好、光热转化效应优等优势,多用于光动力学治疗,但应用于光声成像的研究鲜见。研究[11]表明,某些侵袭性肿瘤如乳腺癌、骨肉瘤和黑色素瘤的αvβ3整合素受体呈过度表达,具有RGD肽段的RGDfK作为肿瘤靶向肽,可与αvβ3整合素受体特异性结合,提高探针的肿瘤靶向性。本研究以聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid), PLGA]为基材,通过双乳化法及碳二亚胺法制备RGD靶向的载光敏剂ZnPc及化疗药物多烯紫杉醇(docetaxel, DTX)的多功能纳米探针,观察其光声介导下诱导乳腺癌细胞凋亡的能力。
1 材料与方法
1.1 材料与仪器 人乳腺癌(MBA-MD-231)细胞(重庆医科大学超声影像学研究所);PLGA-COOH(50∶50聚合比;济南岱罡生物工程有限公司);DTX(西安昊轩生物有限公司);聚乙烯醇(polyvinyl alcohol,PVA;Sigma);ZnPc(Sigma);FITC标记的RGDfk肽[FITC-RGDfk;吉尔(生化)上海有限公司];EDC/NHS(Sigma);荧光染料DAPI、DiI。Sonics声振仪;Malvern Zetasizer Nano ZS90激光电位及粒径测量仪;Hitachi S-3400N电子显微镜;Shimadzu UV-2550紫外分光光度计;DIONEX ultimate 3000高效液相色谱分析仪;NikonA1+R激光共聚焦显微镜;Opotech Vibrant 355 Ⅱ HE光声成像仪;BD Influx流式细胞分选仪。
1.2 载DTX及ZnPc的靶向PLGA纳米探针制备 采用双乳化法(O/W/O)制备载DTX及ZnPc的PLGA纳米粒(PLGA@ZnPc@DTX)。称取40 mg ZnPc,加入4 ml三氯甲烷中混匀,以5 000 rpm、离心5 min,取上液2 ml加入盛5 mg DTX及50 mg PLGA的EP管中,充分溶解后加入500 μl去离子水,冰浴下声振1.5 min,加入适量4%PVA水溶液;相同条件下再次声振后,置于磁力搅拌器搅拌4 h,双蒸水多次离心洗涤,制得载DTX及ZnPc的非靶向PLGA纳米。将载DTX及ZnPc的非靶向PLGA纳米重悬于适量MES缓冲液(0.1 mol/L,pH=5.5),分别加入适量耦联活化剂EDC和NHS(PLGA∶EDC摩尔比为1∶10;EDC∶NHS质量比为1∶3),冰浴下振荡2 h;离心洗涤后,重悬于适量MES缓冲液(0.1 mol/L,pH=8)中,再加入适量FITC-RGDfk(RGDfk∶PLGA摩尔比为1∶1),冰浴下振荡过夜;离心洗涤数次,制得靶向PLGA@ZnPc@DTX,4℃冰箱保存。
1.3 PLGA@ZnPc@DTX一般特征评价及包封率测定 观察PLGA@ZnPc@DTX探针形态,并检测其粒径、表面电位。采用紫外分光光度法及高效液相色谱法(HPLC)分别检测PLGA@ZnPc@DTX中ZnPc及DTX的包封率和载药量,检测波长分别为670 nm、275 nm。取适量已知浓度PLGA@ZnPc@DTX悬液,离心洗涤后,所得沉淀以DMSO∶三氯甲烷为1∶1的溶液溶解破乳,采用紫外分光光度法及HPLC法检测ZnPc及DTX含量。包封率(%)=检测量/总投放量×100%,载药量(μg/mg)=检测量/载药纳米粒总质量。
1.4 PLGA@ZnPc@DTX体外释放实验 取2个透析袋(相对分子质量14 000),分别标记为实验组和对照组,以去离子水浸泡处理后待用;将PLGA@ZnPc@DTX加入2 ml PBS(pH 7.4)溶液重悬,吸取2份适量纳米粒分别加入实验组和对照组透析袋中,扎紧袋口,以含0.5%十二烷基硫酸钠(SDS)的50 ml PBS(pH 7.4)溶液为释放介质,37℃水浴恒温搅拌(100 r/min);在预设时间点(0.5、1.0、2.0、3.0、4.0、6.0、7.0、8.0、10.0、12.0、24.0、48.0、72.0 h)取样2 ml,同时补加同体积释放介质。对实验组于2.0 h时以0.5 W功率激光照射5 min;对照组不进行激光照射。将所取样品用HPLC法测定释放介质中DTX含量,计算累计释放率,绘制体外释放曲线。
1.5 体外PAI 将PLGA@ZnPc@DTX稀释至适合浓度,加入3%琼脂糖凝胶模型中,采用光声成像仪680~960 nm波长激光触发纳米粒,并同步采集光声图像。制备6组不同ZnPc含量(1.25、2.50、5.00、10.00、20.00、40.00 mg)纳米粒,稀释至相同浓度,各取适量分置于凝胶模型中,以激光触发6组纳米粒,使用PAI仪同步采集图像,并记录光声信号值。以不含ZnPc纳米粒作对照。
1.6 体外细胞实验
1.6.1 靶向PLGA@ZnPc@DTX表面FITC-RGDfk连接率及体外寻靶能力 利用流式细胞仪检测FITC-RGDfk与PLGA@ZnPc@DTX结合率。取适量对数生长期MBA-MD-231细胞接种于数个培养皿中,待细胞全部贴壁并生长到适量密度,分别加入经DiI处理的靶向与非靶向PLGA@ZnPc@DTX孵育2 h后,4%多聚甲醛固定细胞,加入适量荧光染料DAPI,孵育10 min,PBS冲洗数次,置于激光共聚焦显微镜下观察。
1.6.2 流式细胞术检测细胞凋亡率 取适量对数生长期的MBA-MD-231细胞,接种于6孔板中,以37℃、5%CO2条件培养孵育24 h,并分为6组:A组,加入不含ZnPc及DTX的空白纳米粒;B组,加入含DTX、不含ZnPc的纳米粒;C组,加入含ZnPc及DTX的非靶向纳米粒;D组,加入含ZnPc及DTX的靶向纳米粒;E组,加入含ZnPc及DTX的非靶向纳米粒,并以激光辐照;F组,加入含ZnPc及DTX的靶向纳米粒,并以激光辐照;之后继续孵育12 h,重悬细胞,采用流式细胞仪检测各组细胞凋亡率。
1.7 统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示,多组均数间比较采用单因素方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PLGA@ZnPc@DTX基本特性 成功制备PLGA@ZnPc@DTX纳米粒,光镜下呈形态大小均匀的球形粒子;透射电镜下呈表面规整球形粒子(图1A);平均粒径为(266.00±65.85)nm,表面电位为(-29.20±6.27)mV(图1B、1C)。DTX的包封率、载药量分别为(88.00±0.32)%、(34.92±0.02)μg/mg,ZnPc的包封率、载药量分别为(97.25±0.22)%、(30.87±0.11)μg/mg。
2.2 体外释放实验结果 PLGA@ZnPc@DTX在释放介质中24.0 h后,释放率约50%,48.0 h后释放率约68%,72.0 h后释放率约77%。采用激光辐照,实验组呈缓慢释放趋势(图2)。
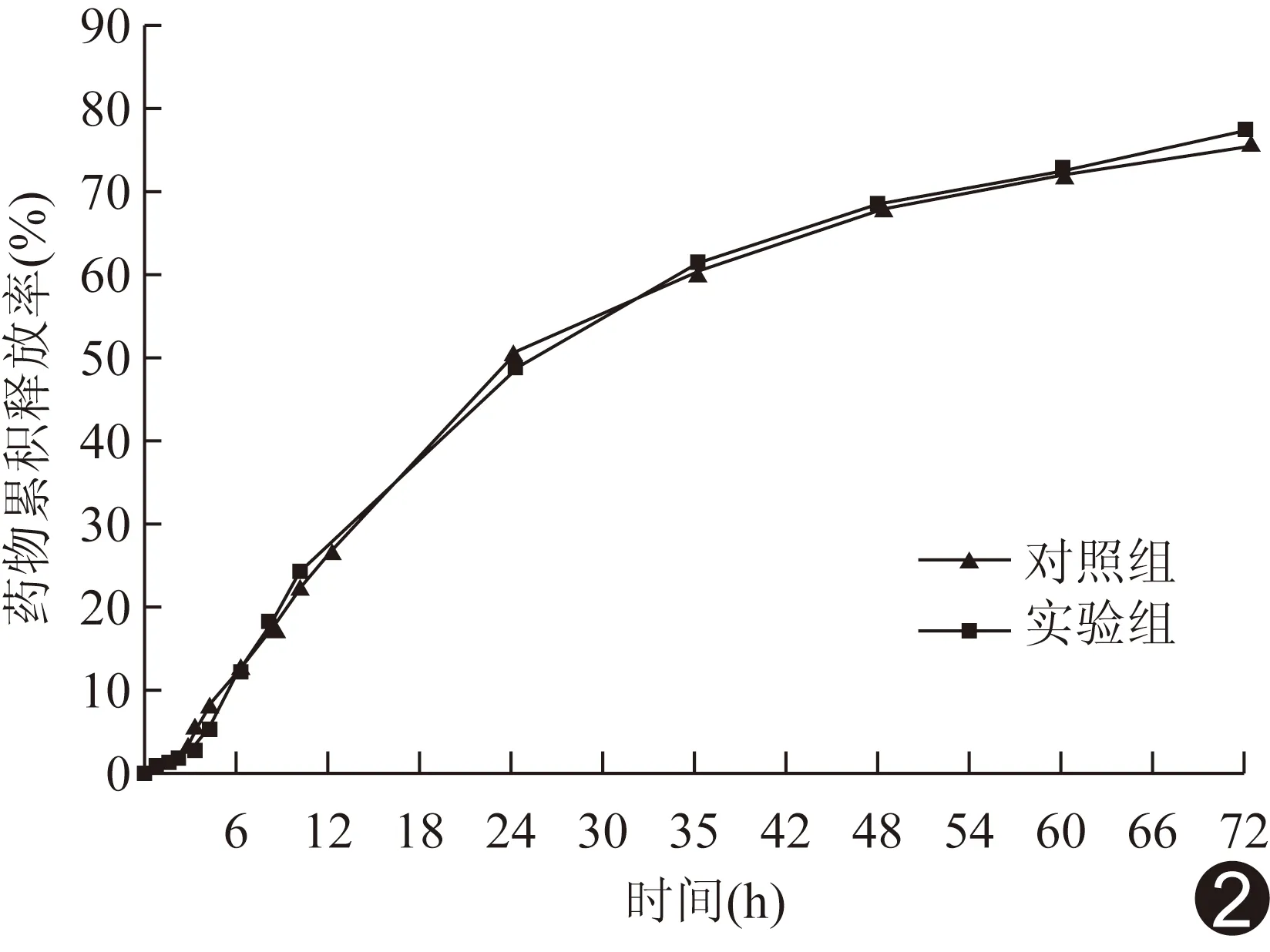
图2 不同时间点PLGA@ZnPc@DTX多烯紫杉醇累积释放率
2.3 体外PAI结果 光声值波峰出现于700 nm时,故选定700 nm为激光激发波长。不同ZnPc含量纳米粒光声信号随ZnPc含量增加而呈明显梯度增强(图3),呈近似线性关系。
2.4 靶向PLGA@ZnPc@DTX靶向连接率及及体外寻靶能力 共聚焦显微镜下靶向PLGA@ZnPc@DTX经DiI染色外壳呈红色荧光(图4A),FITC-RGDfk呈绿色荧光(图4B),融合图像中,两者叠加后呈黄色荧光(图4C)。流式细胞术测得PLGA@ZnPc@DTX与FITC-RGDfk结合率为89.19%。
经DAPI染色的细胞核发出蓝光,靶向纳米粒(图4D)细胞周围见大量黄色荧光的靶向纳米粒,而非靶向纳米粒(图4E)周围则见极少红色荧光。
2.5 细胞凋亡率 A、B、C、D、E、F组MBA-MD-231细胞凋亡率分别为(7.06±2.64)%、(19.31±4.83)%、(17.41±1.78)%、(26.99±5.53)%、(41.54±3.27)%、(62.87±5.95)%,5组间差异有统计学意义(F=39.22,P<0.05);其中A组与B组、F组,B组与F组,C组与D组、E组、F组,D组与F组,E组与F组细胞凋亡率差异均有统计学意义(P均<0.05)。
3 讨论
目前PAI研究多集中于检测肉眼可见的实体肿瘤[2,12-13],其敏感度由内源性对比决定,且不能准确区分正常与异常组织。除少数肿瘤细胞(如黑素瘤细胞)外,多数肿瘤细胞无内源性吸收对比[14-19],故选择可增强光学吸收、放大光声信号生成效率的外源性造影剂对提高PAI敏感度至关重要[20]。DTX虽是应用广泛的抗癌药物,但其水溶性差、毒副作用多,且常用制剂药物的半衰期较短;同时,相较于游离DTX分子由被动扩散进入细胞质、再通过P-糖蛋白泵运出细胞的过程,制备成纳米粒的DTX系通过内吞作用进入细胞,并可避免P-糖蛋白泵的影响,使肿瘤细胞内有更高药物浓度[21]。研究[22]表明,纳米颗粒可提高抗癌药物疗效的原因在于实体瘤的高通透性和滞留效应(enhanced permeability and retention effect, EPR)所致被动定向能力可促进局部药物吸收,并增加药物的生物利用度。
本研究以PLGA为基材,包裹ZnPc及DTX,采用双乳化法制备出一种拥有良好光声显影能力的外源性光声造影剂,并利用碳二亚胺法连接肿瘤靶向肽RGD,使其成为具备诊疗一体化能力的多功能纳米探针;其DTX及ZnPc包封率较高,克服了DTX水溶性差、毒副作用大及药物半衰期短的缺点;所制备纳米粒在700 nm处具有明显光声信号,具备成为光声造影剂的条件。体外乳腺癌细胞抑制实验结果证实,在激光辐照下,连接RGD的靶向PLGA@ZnPc@DTX能够显著提高对乳腺癌细胞的杀伤力,为后续进行体内PAI并联合肿瘤治疗提供了前提条件。另外,ZnPc是第二代光敏剂酞菁衍生物的代表,常用于另一新兴的无创性癌症治疗方法——光动力疗法(photodynamic therapy, PDT)[23]。今后将进一步研究其在光动力学疗法中的性能,并尝试制备结合光声显像、靶向化疗,以及光动力学治疗的新型纳米探针。

图3 不同浓度纳米粒光声信号图 A~F.ZnPc含量分别为1.25、2.50、5.00、10.00、20.00、40.00 mg的纳米粒PAI图像; G.不含ZnPc的纳米粒PAI图像; H.不同波长激光触发纳米粒时的光声值
图4PLGA@ZnPc@DTX表面RGD连接情况及体外寻靶能力 A.经DiI染色纳米粒呈红色荧光(×800); B.经FITC染色RGDfk呈绿色荧光(×800); C.图A与图B的融合图像叠加后呈黄色荧光(×800); D.靶向纳米粒(×400); E.非靶向纳米粒(×400)
[参考文献]
[1] Zhong J, Wen L, Yang S, et al. Imaging-guided high-efficient photoacoustic tumor therapy with targeting gold nanorods. Nanomedicine, 2015,11(6):1499-1509.
[2] Mallidi S, Luke GP, Emelianov S. Photoacoustic imaging in cancer detection, diagnosis, and treatment guidance. Trends Biotechnol, 2011,29(5):213-221.
[3] Wang L, Yang PP, Zhao XX, et al. Self-assembled nanomaterials for photoacoustic imaging. Nanoscale, 2016,8(5):2488-2509.
[4] 孙正,马晓乾.血管内超声/光声联合成像研究进展.中国医学影像技术,2016,32(6):979-982.
[5] Govinahallisathyanarayana S, Ning B, Cao R, et al. Dictionary learning-based reverberation removal enables depth-resolved photoacoustic microscopy of cortical microvasculature in the mouse brain. Sci Rep, 2018,8(1):985.
[6] Wu D, Yang J, Zhang G, et al. Noninvasive in vivo monitoring of collagenase induced intracerebral hemorrhage by photoacoustic tomography. Biomed Opt Express, 2017,8(4):2276-2286.
[7] Sim JY, Ahn CG, Jeong EJ, et al. In vivo microscopic photoacoustic spectroscopy for non-invasive glucose monitoring invulnerable to skin secretion products. Sci Rep, 2018,8(1):1059-1070.
[8] 杨瑶,张春雷,夏芳芳,等.金纳米棒标记的人CIK细胞用于胃癌靶向光声成像与免疫治疗.中国肿瘤生物治疗杂志,2016,23(6):789-794.
[9] Zhang J, Zhang J, Li W, et al. Degradable hollow mesoporous Silicon/Carbon nanoparticles for photoacoustic imaging-guided highly effective Chemo-Thermal tumor therapyin vitroandin vivo. Theranostics, 2017,7(12):3007-3020.
[10] 夏琼,冉海涛,王志刚,等.VCAM-1靶向双模态光声/超声纳米级分子探针的制备及其体外寻靶实验.中国医学影像技术,2016,32(3):333-337.
[11] North AJ, Karas JA, Ma MT, et al. Rhenium and technetium-oxo complexes with thioamide derivatives of pyridylhydrazine bifunctional chelators conjugated to the tumour targeting peptides octreotate and Cyclic-RGDfK. Inorg Chem, 2017,56(16):9725-9741.
[12] Kim C, Cho EC, Chen J, et al. In vivo molecular photoacoustic tomography of melanomas targeted by bioconjugated Gold nanocages. ACS Nano, 2010,4(8):4559-4564.
[13] Nima ZA, Mahmood M, Xu Y, et al. Circulating tumor cell identification by functionalized silver-gold nanorods with multicolor, super-enhanced SERS and photothermal resonances. Sci Rep, 2014,4:4752.
[14] Strohm EM, Moore MJ, Kolios MC. Single cell photoacoustic microscopy: A review. IEEE J Sel Top Quantum Electron, 2016,22(3):137-151.
[15] Jathoul AP, Laufer J, Ogunlade O, et al. Deep in vivo photoacoustic imaging of mammalian tissues using a tyrosinase-based genetic reporter. Nat Photonics, 2015,9(4):239-246.
[16] Wilson K, Homan K, Emelianov S. Biomedical photoacoustics beyond thermal expansion using triggered nanodroplet vaporization for contrast-enhanced imaging. Nat Commun, 2012,3:618.
[17] Yang S, Ye F, Xing D. Intracellular label-free Gold nanorods imaging with photoacoustic microscopy. Opt Express, 2012,20(9):10370-10375.
[18] Li J, Arnal B, Wei CW, et al. Magneto-optical nanoparticles for cyclic magnetomotive photoacoustic imaging. ACS Nano, 2015,9(2):1964-1976.
[19] Lee DE, Koo H, Sun IC, et al. Multifunctional nanoparticles for multimodal imaging and theragnosis. Chem Soc Rev, 2012,41(7):2656-2672.
[20] Nune SK, Gunda P, Thallapally PK, et al. Nanoparticles for biomedical imaging. Expert Opin Drug Deliv, 2009,6(11):1175-1194.
[21] Panyam J, Labhasetwar V. Dynamics of endocytosis and exocytosis of poly(D,L-lactide-co-glycolide) nanoparticles in vascular smooth muscle cells. Pharm Res, 2003,20(2):212-220.
[22] Zhang Y, Yang C, Wang W, et al. Co-delivery of doxorubicin and curcumin by pH-sensitive prodrug nanoparticle for combination therapy of cancer. Sci Rep, 2016,6:21225.
[23] Soriano J, Villanueva A, Stockert JC, et al. Regulated necrosis in Hela cells induced by ZnPc photodynamic treatment: A new nuclear morphology. Int J Mol Sci, 2014,15(12):22772-22785.