3种三唑类杀菌剂对斑马鱼的毒性研究
2018-05-21蒋金花蔡磊明
葛 婧,蒋金花,蔡磊明,*
(1.新疆农业大学 草业与环境科学学院,新疆 乌鲁木齐830052;2.浙江省农业科学院 农产品质量标准研究所,浙江 杭州310021)
三唑类杀菌剂是目前销售量最大的一种杀菌剂,其杀菌谱较广,可用于对担子菌、子囊菌及半知菌三大亚门真菌引起的多种病害的防治[1-2]。三唑类杀菌剂在农业生产中的使用是极其广泛的,但也存在着一定的风险。三唑类杀菌剂中的烯效唑、己唑醇、戊唑醇、丙环唑和氟环唑已经被美国环保署列入可能的人类致癌物名单[3]。相关文献表明,戊唑醇已被报道对水生环境生物有毒,并对水生生物可能产生长期不良影响[4]。在我国,苯醚甲环唑是最重要的水稻真菌病害控制剂之一,其应用非常广泛,半衰期为6 d左右[5];此外,还有研究表明苯醚甲环唑对鱼类发育有不良影响[6]。郭晶[7]测定了17种三唑类杀菌剂以斑马鱼为试验对象96 h的LC50,其中6种三唑类杀菌剂对斑马鱼为中等毒性,其余11种为低毒。三唑类杀菌剂对鱼类的胚胎具有一定的毒性,前期研究发现烯效唑、戊唑醇、氟哇唑、环唑醇、己唑醇、睛菌唑、灭菌唑、三唑酮等对斑马鱼胚胎具有明显的致死、致畸和抑制发育等不良影响[8-11]。
鱼类种群是水生生态系统重要的组成部分,在水体环境中,鱼类处于体系食物链的高营养级,可通过检测其组织器官和脂肪中富集的污染物对水生生态系统进行评价。当水生生态系统中污染物的浓度达到鱼类所能承载的阈值,则其生长发育和生殖行为就会受到影响,甚至死亡,故鱼类不仅可以作为污染物的指示生物,也能反映出不同层次上的毒性效应[12]。
通过对不同生命阶段的斑马鱼进行毒性测试,可以客观全面地了解该农药对斑马鱼个体甚至种群的影响,同时也可以确定最敏感的生命阶段。已有研究表明[11],斑马鱼早期生命阶段较为敏感,应值得重视,且Nagel等[13]证实斑马鱼胚胎比斑马鱼成鱼更为敏感。因此,探究戊唑醇、丙环唑和苯醚甲环唑3种三唑类农药单剂对不同生命阶段的斑马鱼的急性毒性,早期生命阶段的发育毒性;以及3种三唑类杀菌剂两两联合使用时对斑马鱼早期生命阶段的联合毒性对这3种三唑类杀菌剂的使用有指导意义。
1 材料与方法
1.1 实验生物与饲养条件
斑马鱼亲鱼种鱼购买自武汉水生生物研究所,AB品系,在本实验室饲养超过1年,试验中所用到的斑马鱼成鱼和胚胎均为其后代。光周期为14 h∶10 h,每日早晚两次饲喂丰年虾。斑马鱼成鱼由实验室亲鱼产卵获得,以亲鱼相同的饲养条件进行饲养3个月以上,达到性成熟后进行试验。斑马鱼仔鱼由实验室亲鱼产卵获得,在胚胎孵化后72 h 进行试验。斑马鱼胚胎由实验室亲鱼(AB品系)产卵获得。
1.2 药品与试剂
戊唑醇原药、丙环唑、苯醚甲环唑(含量>90%,北京广源益农化学有限责任公司)。助剂为DMSO(上海生工有限责任公司)。分别称取0.11 mg的戊唑醇、丙环唑、苯醚甲环唑原药,分别放入10 mL容量瓶中,以DMSO为助剂,将原药配制成浓度为10 000 mg·L-1的母液备用。进行实验时将母液进一步用水逐级稀释至指定浓度。
1.3 急性毒性试验
1.3.1 斑马鱼胚胎的急性毒性试验
参考OECD[14]的方法,采用“半静态法”进行试验,每24 h更换1次药液。戊唑醇对斑马鱼胚胎急性毒性试验浓度为15.00、9.38、5.86、3.66、2.29、1.43、0.89 mg·L-1,丙环唑对斑马鱼胚胎急性毒性试验浓度为24.00、15.00、9.38、5.86、3.66、2.29、1.43、0.89 mg·L-1,苯醚甲环唑对斑马鱼胚胎急性毒性试验浓度为5.00、3.13、1.95、1.21、0.76、0.48、0.30 mg·L-1。设助剂为对照组。收集斑马鱼胚胎,将受精的胚胎放入24孔板中,每孔加一枚胚胎,加试验药液至每孔的2/3处。每24孔板为1重复,整个试验设置3组重复,将加好胚胎和试验药液的孔板放入人工气候培养箱,温度为26 ℃,光周期为14 h∶10 h,分别在暴露后6、24、48、72、96 h,按照Nagle等[13]提出的死亡终点进行胚胎死亡的统计,死亡终点为卵凝结、发育停滞、无法观测心跳等。
1.3.2 斑马鱼仔鱼的急性毒性试验
参考OECD[14]的方法,采用“半静态法”进行试验,每24 h更换1次药液。戊唑醇对斑马鱼仔鱼急性毒性试验浓度为5.20、4.00、3.08、2.37、1.82、1.40、1.08 mg·L-1,丙环唑对斑马鱼仔鱼急性毒性试验浓度为5.00、4.17、3.47、2.89、2.41、2.01、1.67 mg·L-1,苯醚甲环唑对斑马鱼仔鱼急性毒性试验浓度为3.00、2.30、1.77、1.37、1.05、0.81 mg·L-1。设助剂为对照组。斑马鱼仔鱼为斑马鱼胚胎孵化获得,取72 h后孵化的仔鱼进行急毒试验。将斑马鱼仔鱼放入24孔板中,每孔加1条仔鱼,加试验药液至每孔的2/3处。每个24孔板为1重复,整个试验设置3组重复,将加好仔鱼和试验药液的孔板放入人工气候培养箱,温度为26 ℃,光周期为14 h∶10 h,分别在暴露后6、24、48、72、96 h观察斑马鱼仔鱼死亡数量和中毒症状。在体式显微镜下无法观测到心跳即判定为死亡。
1.3.3 斑马鱼成鱼的急性毒性试验
参考OECD[14]的方法,采用“半静态法”进行试验,每24 h更换1次药液。戊唑醇对斑马鱼成鱼急性毒性试验浓度为8.00、5.33、3.56、2.37、1.58、1.05 mg·L-1,丙环唑对斑马鱼成鱼急性毒性试验浓度为4.00、2.67、1.78、1.19、0.79、0.53 mg·L-1,苯醚甲环唑对斑马鱼成鱼急性毒性试验浓度为3.00、2.50、2.08、1.14、1.45、1.21 mg·L-1,设助剂为对照组。取3月龄的斑马鱼成鱼,采用6 L鱼缸,每缸10条鱼,均设2次重复,温度为26 ℃,光周期为14 h∶10 h,分别在暴露后6、24、48、72、96 h观察斑马鱼成鱼死亡数量和中毒症状。死亡标准为:用玻璃棒轻触受试鱼体无应激反应,并观察受试鱼鳃部无呼吸活动,即判定为死亡。
1.4 联合毒性试验
根据急性毒性试验结果,分别按照毒性比1∶1和浓度比1∶1设置戊唑醇、丙环唑和苯醚甲环唑两两联合时的试验浓度进行联合毒性试验。试验方法与急性毒性试验相同。联合毒性效应按改进的Marking联合效应的相加指数法(Additional Index)[15]进行评定。
1.5 胚胎发育试验
胚胎发育试验暴露方法与胚胎毒性试验相同,参考OECD[16]的方法,戊唑醇对斑马鱼胚胎发育试验浓度为3.80、1.90、0.95、0.48、0.24 mg·L-1,丙环唑对斑马鱼胚胎发育试验浓度为8.25、4.13、2.06、1.03、0.52 mg·L-1,苯醚甲环唑对斑马鱼胚胎发育试验浓度为1.47、0.74、0.37、0.18、0.09 mg·L-1。以24孔板为试验容器,每个24孔板为1个重复,整个试验设置3个重复,暴露时间为6 d。
参考Nagel等[13]提出的毒理指标,用倒置显微镜观察其致死效应、亚致死效应和致畸效应。其中,亚致死效应的观察统计包括:每天观察所有胚胎的发育情况,每天统计孵化的仔鱼数量,计算孵化率,每24 h更换的药液;24 h时,从每重复随机取5粒有活性的卵,在倒置显微镜下观察斑马鱼胚胎自主运动情况,并记录20 s内自主运动的次数;分别在48和96 h时,在倒置显微镜下观察斑马鱼心跳情况,每个重复随机取5粒活卵,记录20 s内心跳次数[17]。
1.6 试验水样分析
试验用水为曝气自来水,充分曝气,溶解氧在6.5~7.5 mg·L-1,pH值为6.85,水质总硬度在85.32 mg·L-1。在第一次配好药液和第1次换药时,从每个处理取10 mL水样进行浓度分析。
仪器设备。LCMS 8050超高效液相色谱质谱串联质谱联用仪,(UPLC-MS/MS,日本岛津公司),AB104-S电子天平(感量0.0001,梅特勒-托利多国际贸易上海有限公司),旋转蒸发仪(瑞士 BUCHI)。
化学试剂。色谱纯乙腈(萨劳公司)、色谱纯甲醇(萨劳公司)饮用纯净水(杭州娃哈哈集团有限公司)、色谱纯甲酸(Anaqua Chemicals Supply公司)
1.6.1 戊唑醇检测条件
样品处理。用甲醇-水(1∶1)稀释样品,使样品浓度稀释至标准曲线范围内,过0.22 μm滤膜,待检测。
液相色谱条件。色谱柱Kinetex 2.6u XB-C18100A(100 mm×2.1 mm);流动相甲醇(0.1%甲酸):超纯水=80∶20;流速0.25 mL·min-1;柱温30 ℃;进样体积2.00 μL。
质谱条件。毛细管电压4.0 kV;雾化气流速3.0 L·min-1;干燥气流速10.0 L·min-1;Interface温度300 ℃;DL温度250 ℃;Heat Block温度400 ℃;采用MRM多反应监测,电离方式为正离子电离(ESI+);戊唑醇定量离子对为308.2>70.1,定性离子对为256.05>209.05。
1.6.2 丙环唑检测条件
样品处理。移取水样5.00 mL置于10 mL容量瓶中,用乙腈(色谱纯)定容,涡旋30 s后,过0.22 μm滤膜,若浓度超出标准曲线范围,需用乙腈稀释后再过0.22 μm滤膜,待检测。
液相色谱条件。色谱柱ACQUITY UPLCTMNEH C18(2.1 mm×100 mm,1.8 μm);流动相乙腈∶甲酸=85∶15;流速0.20 mL·min-1;柱温40 ℃;进样体积3.00 μL。
质谱条件。毛细管电压4.0 kV;雾化气流速3.0 L·min-1;干燥气流速10.0 L·min-1;Interface温度300 ℃;DL温度250 ℃;Heat Block温度400 ℃;采用MRM多反应监测,电离方式为正离子电离(ESI+);丙环唑定量离子对为342.05>159.01,定性离子对为342.05>205.10。
1.6.3 苯醚甲环唑检测条件
样品处理。用甲醇-水(1∶1)稀释样品,使样品浓度稀释至标准曲线范围内,过0.22 μm滤膜,待检测。
液相色谱条件。色谱柱ACQUITY UPLC HSS T3(2.1 mm ×100 mm×1.7 μm);流动相甲醇(0.1%甲酸):超纯水=80∶20;流速0.25 mL·min-1;柱温30 ℃;进样体积3.00 μL。
质谱条件。毛细管电压4.0 kV;雾化气流速3.0 L·min-1;干燥气流速10.0 L·min-1;Interface温度300 ℃;DL温度250 ℃;Heat Block温度400 ℃;采用MRM多反应监测,电离方式为正离子电离(ESI+);苯醚甲环唑定量离子对为406.1>251.0,定性离子对为406.1>337.1。
1.7 数据统计与分析
使用SPSS 19.0对所得数据进行分析,采用One-Way ANOVA 法进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 试验药液浓度分析
由表1—3可以看出,实测浓度与理论浓度的偏差均小于20%,根据OECD导则[14,16,18],本试验中理论浓度可以代表实际浓度。
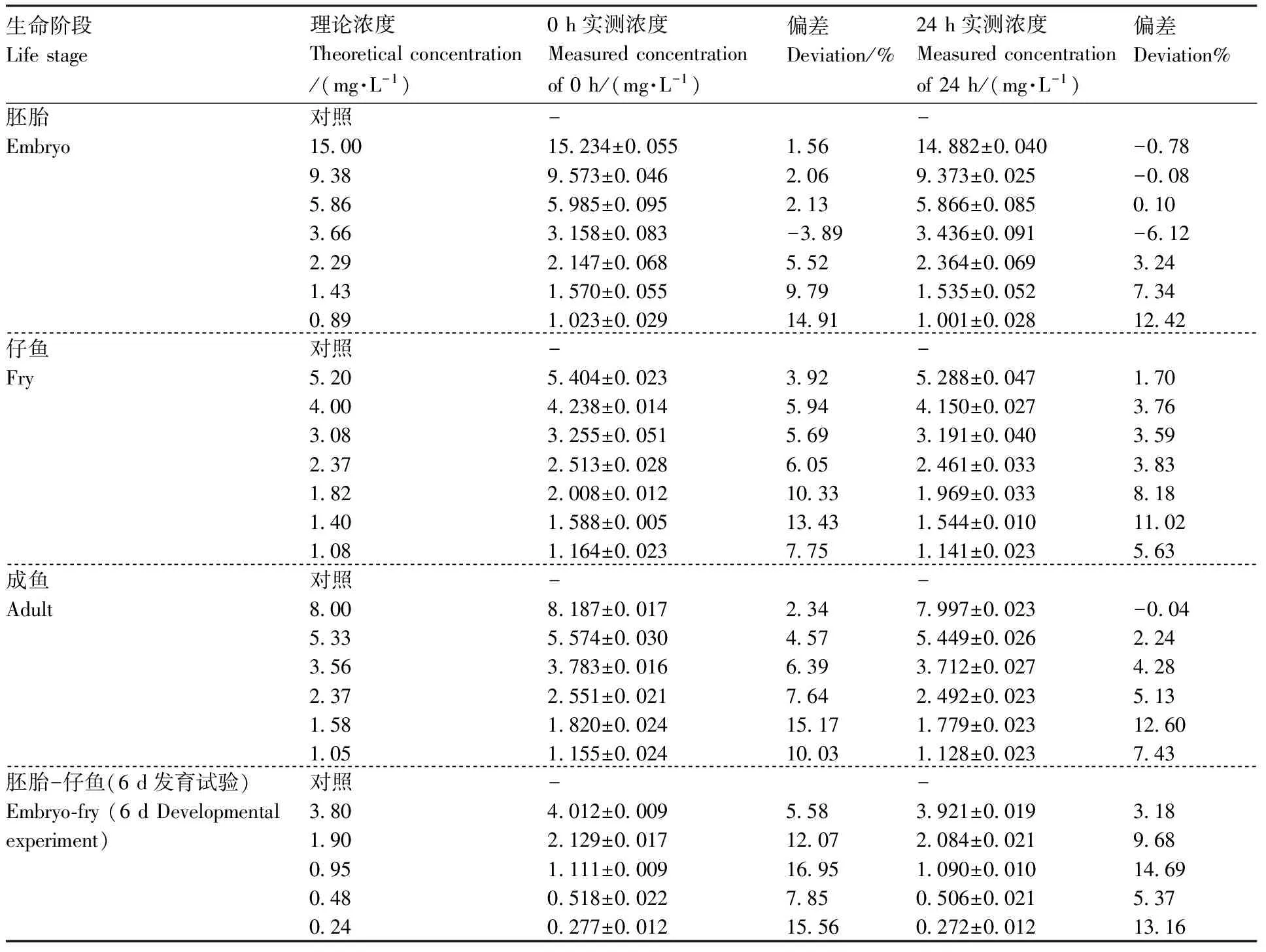
表1 戊唑醇暴露药液实测试验浓度Table 1 Chemical analysis result of tebuconazole solution
“-”表未检出。下同。
“-” represents no detection. The same as below.
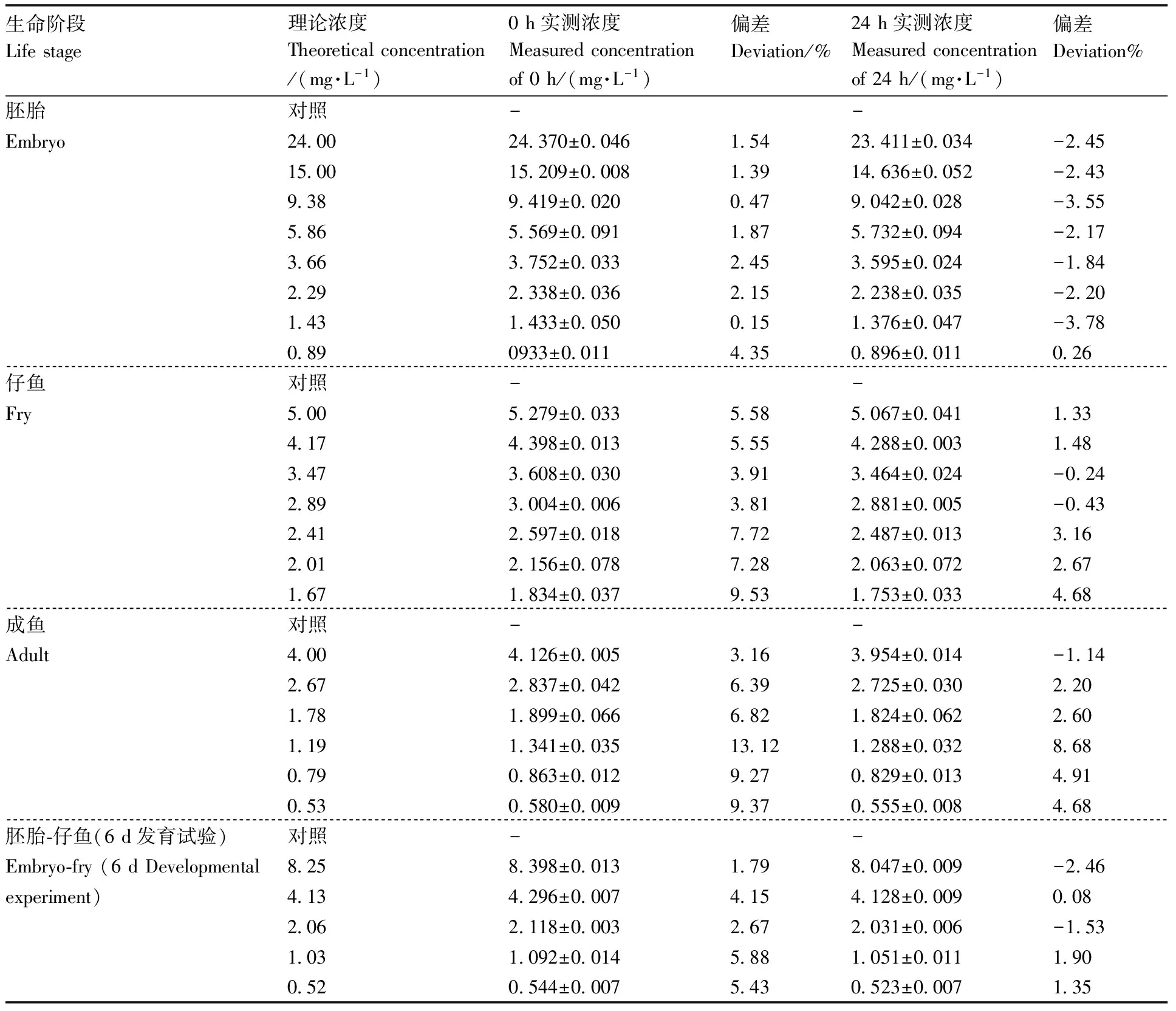
表2 丙环唑暴露药液实测试验浓度Table 2 Chemical analysis result of propiconazole solution
2.2 急性毒性试验
急性毒性结果表明,戊唑醇对斑马鱼胚胎96 h LC50值为3.75 mg·L-1;丙环唑对斑马鱼胚胎的96 h LC50值为8.25 mg·L-1;苯醚甲环唑对斑马鱼胚胎96 h LC50值为1.51 mg·L-1。戊唑醇对斑马鱼仔鱼96 h LC50值为3.39 mg·L-1;丙环唑对斑马鱼仔鱼96 h LC50值为1.90 mg·L-1;苯醚甲环唑对斑马鱼仔鱼96 h LC50值为1.35 mg·L-1。戊唑醇对斑马鱼成鱼96 h LC50值为5.33 mg·L-1;丙环唑对斑马鱼成鱼96 h LC50值为1.93 mg·L-1;苯醚甲环唑对斑马鱼成鱼96 h LC50值为2.08 mg·L-1。根据《GB/T 27861—2011 化学品 鱼类急性毒性试验》[19]中毒性等级标准判定,这3种三唑类杀菌剂对斑马鱼各生命阶段的毒性均为中毒。
戊唑醇、丙环唑、苯醚甲环唑对斑马鱼不同生命阶段均有一定的致死效应。根据96 h-LC50(表4),斑马鱼3个生命阶段对戊唑醇的敏感顺序为仔鱼(3.39 mg·L-1)>胚胎(3.75mg·L-1)>成鱼(5.33 mg·L-1);斑马鱼3个生命阶段对丙环唑的敏感顺序为仔鱼(1.90 mg·L-1)>成鱼(1.93 mg·L-1)>胚胎(8.25 mg·L-1);斑马鱼3个生命阶段对苯醚甲环唑的敏感顺序为仔鱼(1.35 mg·L-1)>胚胎(1.51 mg·L-1)>成鱼(2.08 mg·L-1)。可以看出,仔鱼阶段对戊唑醇、丙环唑、苯醚甲环唑这3种三唑类杀菌剂最为敏感。

表3 苯醚甲环唑暴露药液实测试验浓度Table 3 Chemical analysis result of difenoconazole solution

表4 戊唑醇、丙环唑、苯醚甲环唑对斑马鱼不同生命阶段的急性毒性Table 4 Acute toxicity of tebuconazole,propiconazole and difenoconazole on zebrafish at different stages of life
2.3 联合毒性试验
在急性毒性相同的试验条件下,戊唑醇、丙环唑、苯醚甲环唑采用浓度比1∶1和毒性比1∶1两种配比方式进行两两联合毒性试验。
2.3.1 胚胎联合毒性试验
由图5—7可知,戊唑醇和丙环唑采用浓度比1∶1和毒性比1∶1对斑马鱼胚胎进行联合毒性试验时,相加指数AI值分别为-0.44和-0.98。联合毒性表现为拮抗作用。戊唑醇和苯醚甲环唑采用浓度比1∶1和毒性比1∶1对斑马鱼胚胎进行联合毒性试验时,相加指数AI值分别为-0.65和-0.43,联合毒性表现为拮抗作用。苯醚甲环唑和丙环唑采用浓度比1∶1和毒性比1∶1对斑马鱼胚胎进行联合毒性试验时,相加指数AI值分别为0.18和0.22,联合毒性表现为协同作用。
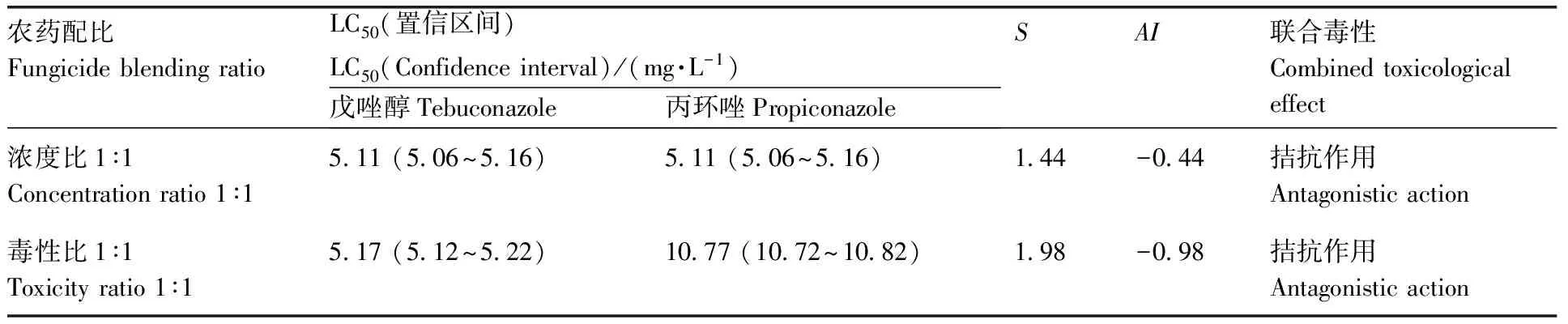
表5 戊唑醇和丙环唑对斑马鱼胚胎联合毒性Table 5 Combined toxicity of tebuconazole and propiconazole on zebrafish embryos

表6 戊唑醇和苯醚甲环唑对斑马鱼胚胎联合毒性Table 6 Combined toxicity tebuconazole and difenoconazole of on zebrafish embryos

表7 苯醚甲环唑和丙环唑对斑马鱼胚胎联合毒性Table 7 Combined toxicity difenoconazole and propiconazole of on zebrafish embryos

表9 戊唑醇和苯醚甲环唑对斑马鱼仔鱼联合毒性Table 9 Combined toxicity tebuconazole and difenoconazole of on zebrafish larvae

表10 丙环唑和苯醚甲环唑对斑马鱼仔鱼联合毒性Table 10 Combined toxicity difenoconazole and propiconazole of on zebrafish embryos larvae
2.3.2 仔鱼联合毒性试验
由图8—10可知,戊唑醇和丙环唑采用浓度比1∶1和毒性比1∶1对斑马鱼仔鱼进行联合毒性试验时,相加指数AI值分别为-0.51和-0.17,联合毒性表现为拮抗作用。戊唑醇和苯醚甲环唑采用浓度比1∶1和毒性比1∶1对斑马鱼仔鱼进行联合毒性试验时,相加指数AI值分别为-0.01和-0.05,联合毒性表现为拮抗作用。苯醚甲环唑和丙环唑采用浓度比1∶1和毒性比1∶1对斑马鱼胚胎进行联合毒性试验时,相加指数AI值分别为0.08和0.37,联合毒性表现为协同作用。
2.4 胚胎发育试验
2.4.1 不同杀菌剂对胚胎的抑制作用
戊唑醇、丙环唑、苯醚甲环唑对斑马鱼胚胎孵化率的影响如图1所示。3.80、1.90、0.95、0.48、0.24 mg·L-1的戊唑醇处理组斑马鱼胚胎的孵化率分别为68.75%、87.50%、89.58%、93.75%、100.00%。8.25、4.13、2.06、1.03、0.52 mg·L-1的丙环唑处理组斑马鱼胚胎的孵化率分别为6.25%、37.50%、70.83%、85.42%、87.50%。1.47、0.74、0.37、0.18、0.09 mg·L-1的苯醚甲环唑处理组斑马鱼胚胎的孵化率分别为47.92%、77.08%、89.58%、89.58%、97.92%。助剂对照组对斑马鱼的孵化率没有影响。根据胚胎发育试验结果可以看出,在这3种三唑类杀菌剂中,浓度较低的苯醚甲环唑对斑马鱼胚胎的孵化有一定的抑制,斑马鱼胚胎孵化受到抑制的敏感顺序为苯醚甲环唑>丙环唑>戊唑醇。
由图1可知,在染毒96 h后,斑马鱼胚胎的孵化率保持恒定。对照组和试验设计中的低浓度暴露组从48 h开始出现完成孵化的个体,在96 h时绝大部分存活的胚胎均完成孵化,但在144 h时,试验设计中的高浓度暴露组中仍观测到有胚胎完成孵化。

图1 不同杀菌剂对斑马鱼胚胎孵化率的影响Fig.1 Effect of different germicides on hatching rate of zebrafish embryos
2.4.2 不同杀菌剂对胚胎自主运动和心跳的影响
自主运动是脊柱神经元刺激产生的运动,主要表现形式为斑马鱼尾部自发地从一边到另一边的交替运动[20]。斑马鱼胚胎发育到24 h时,会出现有规律的自主运动。自主运动统计结果表明,戊唑醇、丙环唑、苯醚甲环唑3种三唑类杀菌剂在不同剂量的暴露下均能抑制斑马鱼胚胎24 h自主运动,随着暴露浓度的升高,斑马鱼胚胎自主运动受到的抑制越明显。
如图2所示,0.52 mg·L-1的丙环唑对斑马鱼胚胎的自主运动的抑制不明显,1.47、0.74 mg·L-1的苯醚甲环唑对斑马鱼胚胎的自主运动的抑制有极显著抑制,0.37、0.18、0.09 mg·L-1的苯醚甲环唑对斑马鱼胚胎的自主运动的抑制不明显。
心跳次数受到的抑制与对自主运动的影响趋势类似,戊唑醇、丙环唑、苯醚甲环唑3种三唑类杀菌剂在不同剂量的暴露下对斑马鱼胚胎的心跳影响也存在抑制作用。试验中高浓度处理组受到显著抑制。如图2所示,不同浓度的戊唑醇、丙环唑和苯醚甲环唑对斑马鱼48 h和96 h的心跳次数的抑制有极显著差异。

无相同大写或小写字母表示组间差异极显著(P<0.01)或显著(P<0.05)。下同The values without the same capital or lowercase letters indicate extremely significant (P<0.01) or significant difference among groups(P<0.05).The same as below.图2 不同杀菌剂对斑马鱼胚胎自主运动和心跳的影响Fig.2 Effects of different germicides on fetal heartbeat and autonomic motility of zebrafish
3 讨论
急性毒性试验结果表明,戊唑醇、丙环唑、苯醚甲环唑对于斑马鱼的3个生命阶段均有致死能力,且仔鱼所在的早期生命阶段最为敏感。目前很多研究发现,水生生物早期生命阶段对化学物质的敏感性要高于成鱼阶段[17]。而硬骨鱼的胚胎和仔鱼阶段同样被认为是鱼类生命周期中最为敏感的阶段[21-23],原因之一是硬骨鱼在胚胎阶段很可能不具备像成年个体那样的代谢解毒能力[20]。胚胎阶段的敏感程度低于仔鱼阶段,可能是由于胚胎有胚胎膜的保护。有研究表明,斑马鱼胚胎膜可以防止部分物质渗入[24]。仔鱼阶段最为敏感,这可能是因为处于该阶段的斑马鱼既未完成生长发育,又没有胚胎膜的保护[17]。戊唑醇、丙环唑、苯醚甲环唑3种三唑类杀菌剂对斑马鱼毒性影响涵盖了斑马鱼生长的整个生命周期,所得结果可以为这3种三唑类杀菌剂的毒性效应以及生态风险评价提供基础数据。当前农药毒性评价均以成鱼为试验对象,只能得到农药对成鱼的毒性效应,而仔鱼所在的早期生命阶段与成鱼相比更加敏感,所以,农药对鱼类早期生命阶段的毒性效应更应受到重视。因此,研究这3种三唑类杀菌剂对鱼类整个生命阶段的影响对其毒性预测和生态风险评估更加准确。
联合毒性试验结果表明,戊唑醇和丙环唑等浓度和等毒性混合与戊唑醇和苯醚甲环唑等浓度和等毒性混合对斑马鱼早期胚胎生命阶段为拮抗作用,丙环唑和苯醚甲环唑等浓度和等毒性混合对斑马鱼早期胚胎生命阶段为协同作用。影响农药联合毒性的因素有很多,不同浓度的配比结果也会不同。有研究表明,戊唑醇和苯醚甲环唑在不同浓度的配比下对橡树炭疽病菌的联合毒性效应不同,既有拮抗作用也有协同作用[25]。本文中联合毒性试验仅表示在浓度比1∶1和毒性比1∶1条件下的联合毒性效应,这3种三唑类杀菌剂在其他浓度配比条件下和其对斑马鱼的联合毒性有待研究。采用相加指数法对联合毒性的评价考虑的因素相对单一,联合毒性应进行多种方法的全面评价。农药的联合使用可在一定程度上减少对环境的污染,有效达到防治病虫害的结果,农业生产中采用对防治对象毒性高、对非靶标生物毒性低的组合将更有效的降低农药对环境的负面影响。
根据胚胎发育试验结果,戊唑醇、丙环唑和苯醚甲环唑这3种三唑类杀菌剂对斑马鱼胚胎发育有一定的抑制作用,同时也抑制了自主运动和心跳次数。孵化率与孵化后仔鱼的质量有着直接关系[18],是胚胎发育阶段的重要毒理学指标。本研究中,斑马鱼胚胎孵化延迟的原因可能是由于农药暴露后,胚胎自身发育受到农药的抑制,同时斑马鱼胚胎的自主运动也受到了抑制。心脏是斑马鱼胚胎发育过程中的第一个功能性器官,同时也是鱼类胚胎试验的重要毒理学终点[19]。之前的研究已经发现,胚胎发育过程中心脏是最早发生并发挥功能的器官,完整的心脏功能对于胚胎的正常发育起着关键作用,斑马鱼胚胎发育至48 hpf心率基本趋于稳定[26-27]。而在本研究中,3种三唑类杀菌剂在不同剂量的暴露下,斑马鱼胚胎心率受到明显抑制,其中,随着时间的延长,受到的抑制越明显。
参考文献(References):
[1] 周子燕,李昌春,高同春,等.三唑类杀菌剂的研究进展[J].安徽农业科学,2008,36(27):11842-11844.
ZHOU Z Y,LI C C,GAO T C,et al. Research progress on triazole fungicides[J].JournalofAnhuiAgriculturalSciences,2008,36(27):11842-11844. (in Chinese with English abstract)
[2] WEISBROD A V,SAHI J,SEGNER H,et al. The state of in vitro science for use in bioaccumulation assessments for fish †[J].EnvironmentalToxicology&Chemistry,2009,28(1):86-96.
[3] 吴绅溶. 三唑类杀菌剂对斑马鱼胚胎发育毒性效应研究[D]. 天津:天津工业大学,2014.
WU S R. Study on the toxic effects of three azoles on the development of zebrafish embryos[D]. Tianjin:Tianjin University of Technology,2014.(in Chinese with English abstract)
[4] 齐素贞. 戊唑醇对映异构体对大型溞的毒性差异及双酰胺类杀虫剂结合位点的选择性研究[D]. 北京:中国农业大学,2014.
QI S Z. Differences of the tebuconazole enantiomers toxicity toDaphniamagnaand selective studies of binding sites of diamide insecticides[D]. Beijing: China agricultural University,2014. (in Chinese with English abstract)
[5] 张志勇,王冬兰,张存政,等. 苯醚甲环唑在水稻和稻田中的残留[J].中国水稻科学,2011,25(3):339-342.
ZHANG Z Y,WANG D L,ZHANG C Z,et al. Difenoconazole residues in rice and paddy system[J].ChineseJournalofRiceScience,2011,25(3):339-342. (in Chinese with English abstract)
[6] HINFRAY N,PORCHER J F. Inhibition of rainbow trout (Oncorhynchusmykiss) P450 aromatase activities in brain and ovarian microsomes by various environmental substances[J].ComparativeBiochemistry&PhysiologyPartCToxicology&Pharmacology,2006,144(3):252-262.
[7] 郭晶,宋文华,丁峰,等. 三唑类杀菌剂对斑马鱼急性毒性研究[J]. 东南大学学报(医学版),2010,29(4):402-406.
GUO J,SONG W H,DING F,et al. Acute toxicity study on zebrafish (Daniorerio) exposure to triazole fungicides[J].JSoutheastUniv(Med Sci Edi), 2010,29 (4) :402-406.(in Chinese with English abstract)
[8] 周炳,赵美蓉,黄海凤. 4种农药对斑马鱼胚胎的毒理研究[J]. 浙江工业大学学报,2008,36(2):136-140.
ZHOU B,ZHAO F R,HUANG H F. Study on zebrafish embryo-toxicity of four pesticides[J].JournalofZhejiangUniversityofTechnology,2008,36(2):136-140. (in Chinese with English abstract)
[9] LIU S,CHANG J,YING Z,et al. Changes of thyroid hormone levels and related gene expression in zebrafish on early life stage exposure to triadimefon[J].EnvironmentalToxicology&Pharmacology,2011,32(3):472-477.
[10] HERMSEN S A B,PRONK T,BRANDHOF E J V D,et al. Triazole-induced gene expression changes in the zebrafish embryo[J].ReproductiveToxicology,2012,34(2):216-224.
[11] HERMSEN S A,PRONK T E,EJ V D B,et al. Chemical class-specific gene expression changes in the zebrafish embryo after exposure to glycol ether alkoxy acids and 1,2,4-triazole antifungals.[J].ReproductiveToxicology,2011,32(2):245-252.
[12] 马陶武,王子健. 环境内分泌干扰物筛选和测试研究中的鱼类实验动物[J]. 环境科学学报,2005,25(2):135-142.
MA T W,WANG Z J. Fish exprimental model in the screening and testing far the environmental endocrine disruptors[J].ActaScientiaeCircumstantiae,2005,25 (2) :135-140.(in Chinese with English abstract)
[13] NAGEL R, DAR T: The embryo test with the Zebrafish Danio rerio-a general model in ecotoxicology and toxicology[J].Altex,2002,19 (Suppl 1):38-48.
[14] OECD. Test no. 203: fish,acute toxicity test [EB/OL].[1992-07-17].https://read.oecd-ilibrary.org/environment/test-no-203-fish-acute-toxicity-test_9789264069961-en.
[15] MARKING L L. Method for assessing additive toxicity of chemical mixtures[J].AquaticToxicologyandHazardEvaluation,1977,634:99-105.
[16] OECD. OECD Guidelines for the testing of chemicals.In:Section2:Effects on biotic systems test no.210:fish,early-life stage toxicity test[EB/OL].[2013-07-26].http://dx.doi.org/10.1787/9789264203785-en.
[17] 穆希岩.苯醚甲环唑对斑马鱼毒性及作用机制研究[D]. 北京:中国农业大学,2015.
MU X Y. The toxicity effect and mechanism of difenoconazole on zebrafish(Daniorerio)[D]. Beijing:China Agricultural University,2015.(in Chinese with English abstract)
[18] OECD/OCDE. OECD guidelines for the testing of chemicals: test No.236, fish embryo acute toxicity (FET) text[EB/OL]. (2013-07-26)[2018-01-04].http://www.oecd-ilibrary.org/docserver/9789264203709-en.pdf?expires=1525334774&id=id&accname=guest&checksum=DDAAF9FE6D16E9F0B02C84691E97C88B
[19] 中国国家标准化管理委员会. GB/T 27861-2011 化学品 鱼类急性毒性试验[S]. 北京:中国国家标准化管理委员会,2011.
Standardization Administration of the People’s Republic of China.GB/T 27861-2011 Chenicals-fish actue toxicity test[S]. Beijing: Standardization Administration of the People’s Republic of China.(in Chinese)
[20] 刘少颖. 三唑酮对斑马鱼的胚胎发育和内分泌-生殖毒性[D]. 杭州:浙江大学,2011.
LIU S Y. Embryonic developmental and endocrine-reproductive toxicity of triadimefon on zebrafish[D]. Hangzhou:Zhejiang University,2011.(in Chinese with English abstract)
[21] LELE Z,KRONE P H. The zebrafish as a model system in developmental,toxicological and transgenic research[J].BiotechnologyAdvances,1996,14(1):57-72.
[22] WESTERNHAGEN H V. 4 sublethal effects of pollutants on fish eggs and larvae[J].FishPhysiology,1988,11:253-346.
[23] EMBRY M,BRAUNBECK T A,GALAY-BURGOS M,et al. The fish embryo toxicity test as an animal alternative method in hazard and risk assessment and scientific research[J].AquaticToxicology,2010,97(2):79-87.
[24] ZHA J,WANG Z. Assessing technological feasibility for wastewater reclamation based on early life stage toxicity ofJapanesemedaka(Oryziaslatipes)[J].AgricultureEcosystems&Environment,2005,107(2):187-198.
[25] 郑肖兰,易克贤,吴伟怀,等. 戊唑醇与苯醚甲环唑混配对橡胶树炭疽病菌的联合毒力[J].热带农业科学,2014,34(9):43-47.
ZHENG X L,YI K X ,WU W H,et al. Co-toxicity of tebuconazole and difenoconazole against colletotrichum sp. on rubber tree[J].ChineseJournalofTropicalAgriculture, 2014,34(9):43-47. (in Chinese with English abstract)
[26] KITAMBI S S,NILSSON E S,SEKYROVA P,et al. Small molecule screening platform for assessment of cardiovascular toxicity on adult zebrafish heart[J].BMCPhysiology,2012,12:3.
[27] 王思锋,刘可春,王希敏,等. 雷公藤红素对斑马鱼胚胎心脏毒性的初步研究[J]. 中国药理学通报,2009,25(5):634-636.
WANG S F,LIU K C,WANG X M,et al. The preliminary study on the toxicity of celastrol on the heart of zebrafish[J].ChinesePharmacologicalBulletin, 2009,25(5):634-636.(in Chinese with English abstract)
