thanatin串联抗菌肽原核表达研究
2018-05-21李清海刘仁虎
刘 伟,李清海,刘仁虎
(1.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021; 2.浙江大学医学院附属第二医院 放射科,浙江 杭州 310009; 3.浙江省农业科学院 病毒生物技术研究所,浙江 杭州 310021)
抗菌肽是一类具有抗菌活性的生物短肽,在自然界分布广泛、种类繁多,但是产量不多[1]。抗菌肽不易产生耐药性,因而是未来应对耐药性病原菌的希望之星,近年来成为新兴医药、植物抗病基因工程、养殖饲料添加剂的研究热点[2-3]。与传统的抗生素相比,抗菌肽的价格限制了大规模生产[4]。thanatin是从半翅目昆虫刺肩蝽(Podisusmaculiventris)的血淋巴中分离的一种高活性抗菌肽,由21个氨基酸组成(GSKKPVPIIYCNRRTGKCQRM),在11位和18位的半胱氨酸形成二硫键[5]。二硫键对thanatin的抗菌活性可有可无,并不是必需的[6]。由于该抗菌肽对真菌的杀菌活性高而受到关注。
利用微生物工程菌对抗菌肽进行表达是低成本获得抗菌肽的最佳途径。大肠埃希菌E.coli是目前利用最为广泛的表达宿主菌,因为其具有遗传背景清楚,易于操作,培养成本简单,生产上应用成本低的特点[7]。对于一些含有维持抗菌活性必需的二硫键的抗菌肽,可以选择trxB和gor基因缺失的大肠埃希菌菌株,Novagen公司的Origami B、Origami 2和 Rosetta-gami B菌株具有该特性[8],另外的方法就是引入信号序列,使目标蛋白进入细胞周质空间,形成二硫键[9]。由于抗菌肽对宿主具有毒性,不少学者都尝试用不同的融合标签来提高抗菌肽的表达水平和增加蛋白的可溶性[10]。因此本研究通过串联表达抗菌肽单体与MBP蛋白融合表达,希望能够提高抗菌肽的表达效率,同时提高抗菌肽单位效价,为后续进行不同抗菌肽串联的表达提供一种新思路。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
表达宿主菌BL21(DE3),为本实验室保存,表达载体pCreat-M由通用生物系统(安徽)有限公司提供。
1.1.2 酶与试剂
限制内切酶、连接酶以及DNA marker购自NEB北京有限公司,6×His Tag Antibody,HRP conjugate购自Invitrogen,Western荧光检测试剂BeyoECL Plus购自碧云天生物技术研究所。蛋白分子标准购自Thermo公司,IPTG购自Amresco公司,脱脂奶粉购自国内伊利集团;其他化学试剂来自国药集团。
1.2 方法
1.2.1 目的基因的获得
从抗菌肽数据库中检索抗菌肽的氨基酸序列,进行核苷酸密码子优化,并合成3个串联重复的thanatin基因,该基因由通用生物系统(安徽)有限公司合成。
1.2.2 载体的构建
将含有3×thanatin基因的克隆载体pUC57,经过BamHⅠ和XhoⅠ双酶切纯化回收后,与含有相同酶切过的表达载体pCreat-M,通过 T4 DNA ligase,20 ℃连接 2 h,转化到E.coliTOP10,通过抗性筛选和酶切验证,验证目的片段是否连接到目的载体。
1.2.3 表达及优化
挑取划线平板上单克隆接种于含适量抗性的LB培养液的试管中;37 ℃ 220 r·min-1振摇至菌体D600为0.6~0.8;取出1 mL培养物,10 000g室温离心2 min,弃上清,用80 μL 1×PBS缓冲液重悬菌体沉淀加入20 μL的5×Loading Buffer;向剩余的培养物中加入IPTG至终浓度为1 mmol·L-1,在37 ℃ 220 r·min-1振摇4 h,诱导融合蛋白表达;取出1 mL培养物,12 000g室温离心2 min,弃上清,用80 μL 1×PBS缓冲液重悬菌体沉淀加入20 μL的5×loading buffer。随后对不同诱导浓度和不同诱导时间进行检测分析,找出最佳表达条件。最后在此基础上,对表达的蛋白进行可溶性分析,诱导后的菌液离心2 min,弃上清,用500 μL的缓冲液A(20 mmol·L-1Tris,300 mmol·L-1NaCl,pH 8.0)重悬离心后沉淀,超声波破碎(Φ3,15%,2 s/8 s,10 min),上清沉淀分别制样,通过电泳分析目的蛋白可溶性。
1.2.4 蛋白电泳
加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,轻轻混合,95 ℃变性10 min,立即插入冰中待用;将样品轻轻加至凝胶孔中,电泳仪设置成稳压状态,接通电源,将电压调至200 V使样品通过浓缩胶与分离胶。电泳使染料至分离胶适当位置,结束电泳。进行12% SDS-PAGE分析。
1.2.5 Western-blot检测
按着上述条件电泳完毕,进行半干式电转印凝胶电泳,30 V,45 min结束后,将凝胶上分离到的蛋白条带转到PVDF,然后用1×PBST洗膜3次,用5%的脱脂奶粉进行封闭,室温漂洗3次,加入抗体6×His Tag antibody,HRP conjugate(1∶2 000到5% 脱脂奶粉中),孵育1 h。室温用1×PBST漂洗5 min,共3次。缓慢加入少量ECL显色液,能将膜全部覆盖,然后用凝胶成像系统观察条带,拍摄。
1.2.6 亲和纯化与酶切
亲和纯化:采用最优表达条件进行诱导,8 000 r·min-1离心10 min,弃去上清,收集所有菌体。使用缓冲液A(20 mmol·L-1Tris,300 mmol·L-1NaCl,pH 8.0)重悬菌体,超声破碎(Φ10,15%,2 s/8 s,30 min)。16 000 r·min-1离心10 min,收集上清。在上清中加入2 mL Ni-NTA,混匀后4 ℃孵育1 h。将孵育物加入空柱管,收集流出液。分别以缓冲液B(20 mmol·L-1Tris,300 mmol·L-1NaCl,20 mmol·L-1imidazole,pH 8.0)与缓冲液C(20 mmol·L-1Tris,300 mmol·L-1NaCl,40 mmol·L-1imidazole,pH 8.0)清洗填料,收集清洗液。利用缓冲液D(20 mmol·L-1Tris,300 mmol·L-1NaCl,500 mmol·L-1imidazole,pH 8.0)洗脱,收集洗脱液。
酶切:将上一步骤洗脱样透析至缓冲液A中,取少量透析产物,在其中加入适量的TEV protease,4 ℃反应16 h。利用缓冲液A平衡Ni-NTA亲和层析柱后,将反应产物缓慢加入层析柱,收集流出样。利用缓冲液A清洗层析柱,收集清洗样。利用缓冲液D洗脱,收集洗脱样。将上一步骤酶切后流出样全部收集至透析袋(3.8 ku截留分子量),在PEG8000粉末中浓缩,经SDS-PAGE电泳检测。
1.2.7 液相质谱分析
蛋白的制备:细胞培养的上清液混合了4倍体积的冷丙酮,过夜保存在-20 ℃,在20 000g下离心沉淀蛋白。蛋白沉淀用丙酮洗涤3次,并溶解在8 mol·L-1尿素和50 mmol·L-1TEAB(pH 8.0)中,随后经过一系列的TECP还原、碘乙酰胺烷基化、稀释以及胰蛋白酶消化(1∶100酶蛋白比),然后将经过C18柱脱盐和真空冷冻离心干燥。肽段分析采用Dionex ultiMate 3000 nano LC系统耦合到Thermo Scientific公司的Flex离子源。柱子型号为PepMap C18柱。样品通过Q-Exactive Orbitrap HF质谱仪进行分析。
1.2.8 抗菌试验
取一小块活化的核盘菌菌丝接种于PDA平板中央,21.5 ℃黑暗培养24 h,在新长出的菌丝圈外0.5 cm处,用200 μL枪头印下浅沟(1~2 mm深),将20 μL相应浓度的抗菌肽水溶液加于环状沟中,再在21.5 ℃下黑暗培养48 h,观察抑菌效果,拍照。
2 结果与分析
2.1 基因的克隆及其表达载体的成功构建
thanatin核苷酸序列由通用公司体外合成。含有该基因的pUC57克隆质粒转化到含有AP+抗性平板上大肠埃希菌E.coliTOP,挑选单克隆,提取质粒,通过BamHⅠ和XhoⅠ双酶切进行电泳检测,如图1,酶切后基因片段大小符合理论值。后经基因测序公司进行测序,证明该基因正确地克隆到表达载体pCreat-M中。
2.2 蛋白表达检测及优化
将上述构建好的表达抗菌肽的工程菌pCreat-T/E.coliBL21(DE3)进行不同时间诱导表达,如图2所示,每隔2 h取样,进行SDS-PAGE分析,结果表明目的融合蛋白得到了表达。诱导4 h,目的蛋白表达量最大,表达的氨基酸序列理论分子量为52.4 ku,与预期大小相符,随后通过Western blot进行检测,目的蛋白表达进一步被证实,如图3。通过不同温度,不同诱导物IPTG的浓度进行诱导表达,通过SDS-PAGE结果可以发现在37 ℃和15 ℃蛋白均可以表达,但37 ℃温度下蛋白的可溶性的表达量优于15 ℃条件下的表达,且1.0 mmol·L-1浓度的IPTG诱导表达目的蛋白的可溶性优于0.2 mmol·L-1浓度IPTG下的蛋白表达(图4)。
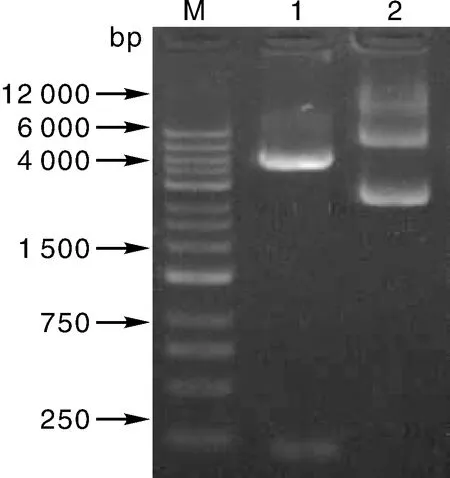
Lane M,DNA 标准分子质量; Lane 1,构建的质粒BamHⅠ和XhoⅠ双酶切的电泳,目标片段位于250 bp下方; Lane 2,构建的质粒电泳。Lane M,DNA standard molecular weight;Lane 1,Electrophoresis analysis of plasmids by the double enzyme digestion; Lane 2,Electorphories analysis of the plasmids.图1 质粒双酶切结果Fig.1 Double enzymes digestion results of recombinant plasmid

Lane M,Protein ladder marker;Lane 1,诱导前;Lane 2-6,每隔2 h不同时间点取样。Lane M,Protein ladder marker; Lane 1,SDS-PAGE of induced sample; Lane 2-6: SDS-PAGE of induced samples at every 2 hours.图2 抗菌肽表达的SDS-PAGE电泳峰分析Fig.2 SDS analysis of protein expression after different periods of E. coli strain
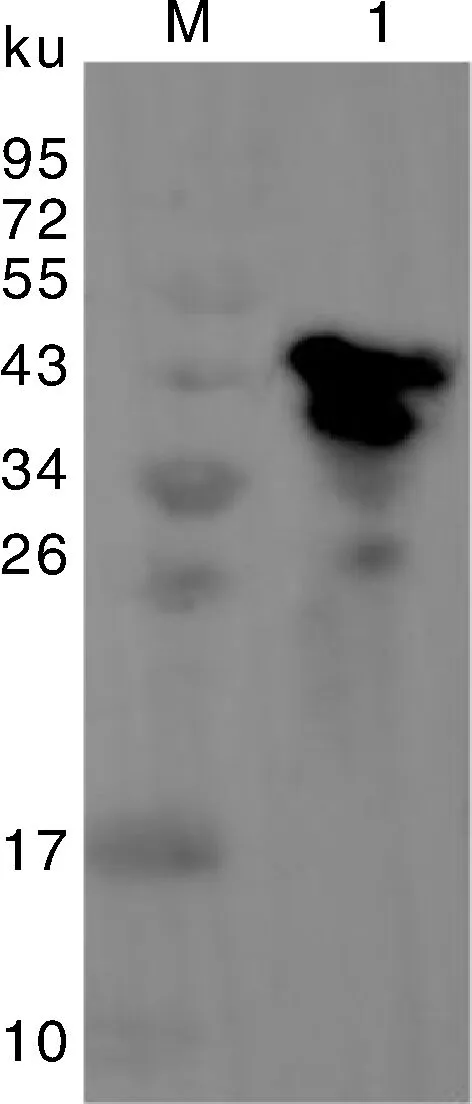
M,蛋白分子质量标准;Lane 1,样品。M,Protein marker; Lane 1,Sample.图3 重组菌pCreat-T/BL21(DE3)诱导表达产物Western blot鉴定Fig.3 Western blot identification of the induced products of recombinant bacteria pCreat-T/BL21(DE3)
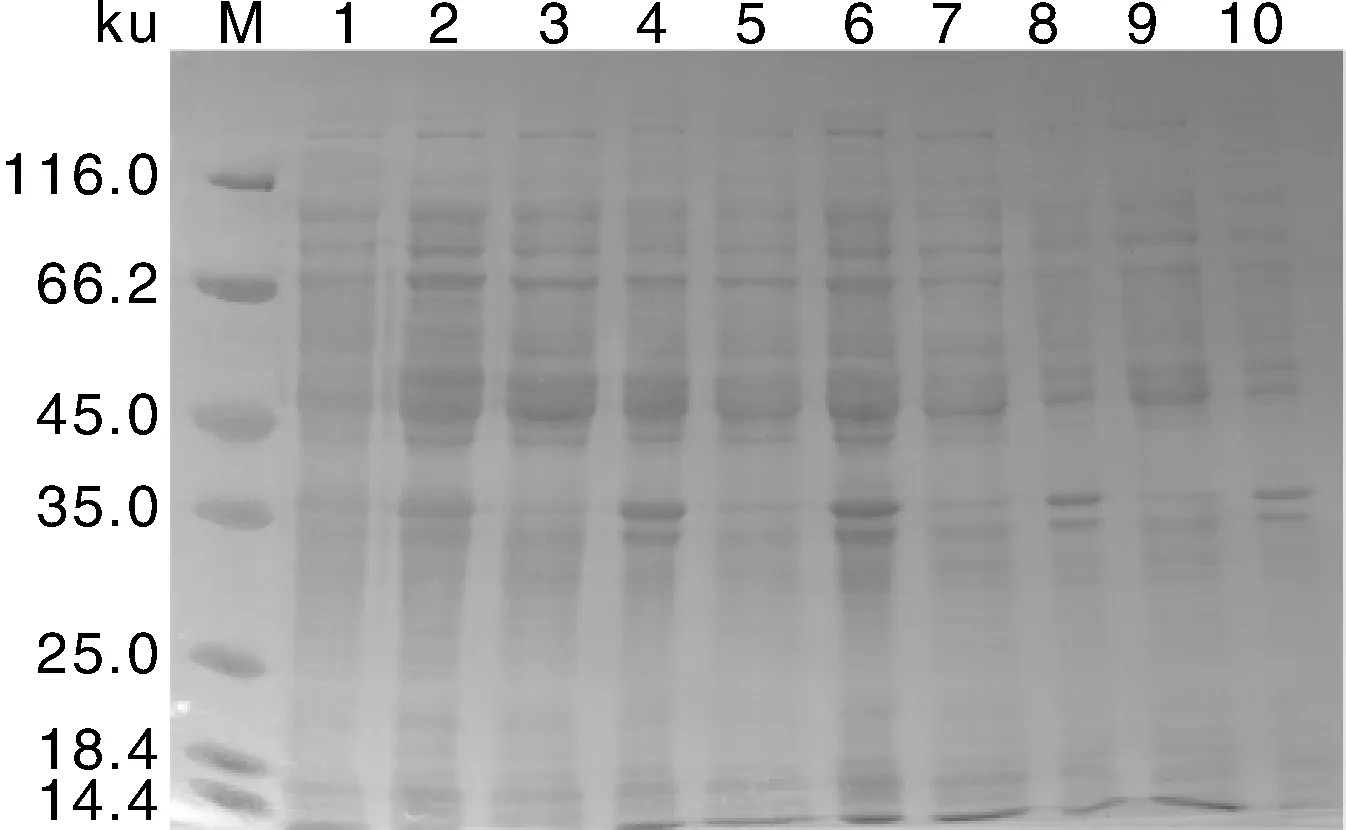
M,Protein marker;Lane 1,未诱导样品;Lane 2,诱导后样品;Lane 3,37 ℃ 1.0 mmol·L-1 IPTG诱后上清样;Lane 4,37 ℃ 1.0 mmol·L-1 IPTG诱后沉淀样;Lane 5,37 ℃ 0.2 mmol·L-1 IPTG诱后上清样;Lane 6,37 ℃ 0.2 mmol·L-1 IPTG诱后沉淀样;Lane 7,15 ℃ 1.0 mmol·L-1 IPTG诱后上清样;Lane 8,15 ℃ 1.0 mmol·L-1 IPTG诱后沉淀样;Lane 9,15 ℃ 0.2 mmol·L-1 IPTG诱后上清样;Lane 10,15 ℃ 0.2 mmol·L-1 IPTG诱后沉淀样。M,Protein marker; Lane 1,Uninduced control; Lane 2,Induced sample; Lane 3,Induced supernatant by 1.0 mmol·L-1 IPTG under 37 ℃; Lane 4,Induced precipitated sample by 1.0 mmol·L-1 IPTG under 37 ℃; Lane 5,Induced supernatant by 0.2 mmol·L-1 IPTG under 37 ℃; Lane 6,Induced precipitated sample by 0.2 mmol·L-1 IPTG under 37 ℃; Lane 7,Induced supernatant by 1.0 mmol·L-1 IPTG under 15 ℃; Lane 8,Induced precipitated sample by 1.0 mmol·L-1 IPTG under 15 ℃; Lane 9,Induced supernatant by 0.2 mmol·L-1 IPTG under 15 ℃; Lane 10,Induced precipitated sample by 0.2 mmol·L-1 IPTG under 15 ℃.图4 pCreat-T在E. coli中的可溶性分析Fig.4 Soluble detection of pCreat-T in E. coli
2.3 蛋白的纯化与酶切
经过对含有20、40和500 mmol·L-1不同浓度的咪唑缓冲液进行梯度洗脱,发现500 mmol·L-1咪唑洗脱液里含有目的蛋白(图5)。经过酶切后流出液全部收集至透析袋(3.8 ku截留分子量),在PEG8000粉末中浓缩,最终溶解在20 mmol·L-1Tris,300 mmol·L-1NaCl,pH 8.0溶液中,Nanodrop测得最终样品浓度为0.02 mg·mL-1。样品经过质谱检测,检测出抗菌肽序列片段(图6),表明抗菌肽已成功表达。根据该质谱特征目标多肽鉴定为KPVPIIYCNR,其中C8氨基酸为脲甲基化修饰。该多肽为3×thanatin多聚抗菌肽胰蛋白酶酶解后的主要产物。
2.4 抑菌结果
将3×thanatin串联表达产物稀释到不同浓度进行体外抑菌试验,结果见图7与对照缓冲液D比较,12~36 ng·μL-1的抗菌肽表达产物对核盘菌具有微弱的抑菌活性,48 ng·μL-1的抗菌肽原核表达产物对核盘菌具有显著的抑菌活性。换算为3×thanatin抗菌肽的当量浓度约在6.6 μmol·L-1,而化学合成的thanatin抗菌肽对核盘菌的抑菌浓度约为64 μmol·L-1,3×thanatin抗菌肽抑菌活性提升了约1个数量级。

Lane M,Protein marker;Lane 1,破碎后沉淀;Lane 2,破碎后上清;Lane 3,Ni-NTA孵育后流出液;Lane 4,缓冲液B清洗样;Lane 5,缓冲液C清洗样;Lane 6,缓冲液D洗脱样。Lane M,Protein marker; Lane 1,Precipitate of ultrasonic treatment; Lane 2,Supernatant of ultrasonic treatment; Lane 3,Ni-NTA column flow through; Lane 4,Column wash by buffer B; Lane 5,Column wash by buffer C; Lane 6,Column elution by buffer D.图5 pCreat-T在E. coli表达产物纯化结果Fig.5 Purification result of recombinant pCreat-T in E. coli
3 讨论
菌核病(Sclerotiniastem rot)是由核盘菌寄生引起的一种严重的真菌性病害。该病的发生每年对油菜的产量损失达到10%~30%[11]。在前期的研究工作中,我们发现在64 μmol·L-1浓度下1×thanatin对核盘菌具有明显的抑制效果,而本研究发现3×thanatin对核盘菌的抑菌活性提高了约1个数量级,其中的作用机制尚不明确,一方面3×thanatin在相同摩尔浓度下质量浓度更高,另一方面原核表达的3×thanatin在半胱氨酸残基上有脲甲基修饰。除此之外,抗菌肽thanatin对细菌也有抑制效果,细胞毒性小,且革兰氏阴性细菌的抑菌效果要远远强于革兰氏阳性菌[12],这些研究发现都为thanatin在防治菌核病上应用提供了技术支撑。

图6 洗脱样的质谱鉴定Fig.6 MS spectra of the substance derived from the elution sample

1,对照缓冲液D; 2,原核表达的抗菌肽12 ng·μL-1; 3,原核表达的抗菌肽 24 ng·μL-1; 4,原核表达的抗菌肽36 ng·μL-1; 5,原核表达的抗菌肽48 ng·μL-1。1,Buffer D as control; 2,The expressed thanatin at 12 ng·μL-1; 3,The expressed thanatin at 24 ng·μL-1; 4,The expressed thanatin at 36 ng·μL-1; 5,The expressed thanatin at 48 ng·μL-1. 图7 原核表达的thanatin抗菌肽串联体对核盘菌的抑菌效果Fig.7 Inhibition effect of tandem thanatin on Sclerotinia sclerotiorum
在过去几十年,很多学者尝试对不同抗菌肽杂合进行表达以获得高效抗菌活力和降低细胞毒性[3,13-16],如CecropinA和LL-37杂交形成的新抗菌肽展示出很强的抗菌活性,并且对绵羊红细胞没有溶血毒性[15]。在前期,我们对抗菌肽thanatin的不同拷贝数以及不同蛋白标签进行构建[17],结果发现超过3个拷贝的thanatin和含有sumo标签的蛋白在大肠埃希菌中都没有成功表达。只有3个拷贝的thanatin与MBP标签融合表达才能成功,个中原因并不清楚。总之,本研究对相同多拷贝抗菌肽的成功表达,为后续多拷贝基因以及杂合抗菌肽的融合表达提供了一种策略,同时对提高抗菌肽表达丰度和扩大抗菌肽抗菌谱提供了理论依据和应用价值。
参考文献(References):
[1] BROWN K L, HANCOCK R E. Cationic host defense (antimicrobial) peptides[J].CurrentOpinioninImmunology, 2006, 18(1): 24-30.
[2] HWANG I S, HWANG J S, HWANG J H, et al. Synergistic effect and antibiofilm activity between the antimicrobial peptide coprisin and conventional antibiotics against opportunistic bacteria[J].CurrentMicrobiology, 2013, 66(1): 56-60.
[3] LU X M, JIN X B, ZHU J Y, et al. Expression of the antimicrobial peptide cecropin fused with human lysozyme inEscherichiacoli[J].AppliedMicrobiology&Biotechnology, 2010, 87(6): 2169-2176.
[4] MARR A K, GOODERHAM W J, HANCOCK R E. Antibacterial peptides for therapeutic use: obstacles and realistic outlook[J].CurrentOpinioninPharmacology, 2006, 6(5): 468-472.
[5] FEHLBAUM P, BULET P, CHERNYSH S, et al. Structure-activity analysis of thanatin, a 21-residue inducible insect defense peptide with sequence homology to frog skin antimicrobial peptides[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1996, 93(3): 1221-1225.
[6] MA B, NIU C, ZHOU Y, et al. The disulfide bond of the peptide thanatin is dispensible for its antimicrobial activity in vivo andinvitro[J].AntimicrobialAgentsandChemotherapy, 2016, 60(7): 4283-4289.
[7] JIA B, JEON C O. High-throughput recombinant protein expression inEscherichiacoli: current status and future perspectives[J].OpenBiology, 2016, 6(8): pii: 160196.
[8] SCHREIBER C, MÜLLER H, BIRRENBACH O, et al. A high-throughput expression screening platform to optimize the production of antimicrobial peptides[J].MicrobialCellFactories, 2017, 16(1):29.
[9] KLINT J K, SENFF S, SAEZ N J, et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm ofE.coli[J].PLoSOne, 2013, 8(5): e63865.
[10] ZHAO X, LI G, LIANG S. Several affinity tags commonly used in chromatographic purification[J].JournalofAnalyticalMethodsinChemistry, 2013: 581093.
[11] 胡宝成, 朱洪涛. 油菜菌核病抗(耐),避病遗传育种研究进展[J]. 安徽农业大学学报, 1995, 2(A01): 55-58.
HU B C, ZHU H T. The development of genetics and breedingon sclerotinia rot of colza[J].JournalofAnhuiAgriculturalUniversity,1995, 2(A01): 55-58. (in Chinese)
[12] EDWARDS I A, ELLIOTT A G, KAVANAGH A M, et al. Contribution of amphipathicity and hydrophobicity to the antimicrobial activity and cytotoxicity of β-hairpin peptides[J].ACSInfectiousDiseases, 2016, 2(6): 442-450.
[13] SHIN S Y, KANG J H, HAHM K S. Structure-antibacterial, antitumor and hemolytic activity relationships of cecropin A-magainin 2 and cecropin A-melittin hybrid peptides[J].JournalofPeptideResearch, 1999, 53(1): 82-90.
[14] SAUGAR J M, RODRIGUEZ-HERNANDEZ M J, DE LA TORRE B G, et al. Activity of cecropin A-melittin hybrid peptides against colistin-resistant clinical strains ofAcinetobacterbaumannii: molecular basis for the differential mechanisms of action[J].AntimicrobialAgentsandChemotherapy, 2006, 50(4): 1251-1256.
[15] WEI X B, WU R J, SI D Y, et al. Novel hybrid peptide cecropin A (1-8)-ll37 (17-30) with potential antibacterial activity[J].InternationalJournalofMolecularSciences, 2016, 17(7): 983.
[16] SHIN S Y, LEE M K, KIM K L, et al. Structure-antitumor and hemolytic activity relationships of synthetic peptides derived from cecropin A-magainin 2 and cecropin A-melittin hybrid peptides[J].JournalofPeptideResearch, 1997, 50(4): 279-285.
[17] 汪小福, 刘仁虎, 陈笑芸, 等. 可剪切多拷贝抗菌肽融合表达载体的构建[J]. 遗传, 2007, 29(6): 758-764.
WANG X F, LIU R H, et al.Construction of vectors for expression of cleavable tandem repeat thanatin fusion protein in plants[J].Hereditas, 2007, 29(6): 758-764. (in Chinese with English abstract)
