聚苹果酸-阿霉素/多烯紫杉醇纳米共聚物的制备及性质研究
2018-05-18乔友备郭松岩
余 喆,周 青,乔友备,郭松岩,张 雨,吴 红
(空军军医大学药学院药物分析学教研室,西安 710032)
化疗是治疗癌症的重要手段之一[1],化疗药物通常为小分子药物,难溶于水,生物利用度较低,尤其是非特异性毒性及多药耐药性等限制了其发展[2]。聚合物载体材料用于药物的输送可实现高效低毒地治疗肿瘤[3-4],药物通过共价键与聚合物连接形成纳米共聚物,可改善药物水溶性并靶向肿瘤部位给药,减少药物在正常组织的蓄积。常用的聚合物载体主要有聚氨基酸类、聚酯类和多糖等,其中聚酯类是应用最广泛的载体材料,包括聚乳酸乙醇酸共聚物(PLGA)、聚乳酸(PLA)和聚己内酯(PCL)等,它们不溶于水,且可修饰基团有限,仅有端基可供修饰,难以满足药物载体多功能修饰的要求。聚苹果酸[poly (β-malic acid),PMLA]是一种新型的脂肪族聚酯,在体内可生物降解,水溶性好,且有许多悬挂羧基可供修饰,是一种优于多糖和多肽类生物高分子的新型药物载体。但PMLA作为药物载体研究还处于起步阶段,鲜见其他以PMLA为药物载体的研究报道。
阿霉素(doxorubicin,DOX)与多烯紫杉醇(docetaxel,DTX)是临床常见的化疗小分子药物,是治疗乳腺癌的一线用药[5-7]。DOX能干扰DNA合成期碱基对的配对,使S期细胞比例提高[8];DTX为紫杉烷类药物,主要抑制细胞分裂期,使细胞停滞在G2/M期,两药联用产生序贯协同作用。阿霉素的分子结构具有活性氨基,较易被聚合物通过共价键相连修饰成DOX前药且保留了DOX的抗肿瘤活性[9]。早期研究表明,DTX的2′位C上所连羟基酰基化取代具有更好的抗肿瘤效果,且2′位C的单羟基取代比多羟基取代在生理条件下更易水解[10-11]。因此,本研究利用PMLA作为载体,采用“一锅煮”法同时将DOX与DTX分别以酰胺键和酯键与PMLA连接,考察纳米共聚物与游离药物的细胞内摄作用及对肿瘤细胞的抑制作用,研究2种药物的协同抗肿瘤作用。
1 仪器与试药
1.1仪器 Advance DMX500核磁共振波谱仪(德国Bruker公司);THZ-C-1全温振荡器(太仓市实验设备厂);1260 Inifity Ⅱ高效液相色谱仪(美国Agilent公司);LGJ-10冷冻干燥机(美国SIM公司);BIO-RAD 680酶联免疫检测仪(美国伯乐公司);Tecnai Spirit 100KV透射电子显微镜(美国FEI公司);DelsaTMNano C动态光散射粒度分析仪(美国贝克曼库尔特公司);FluoView FV1000激光共聚焦显微镜(奥林巴斯(中国)有限公司)。
1.2试药 三氟乙酸酐(济南万兴达化工厂);N-羟基丁二酰亚胺(NHS),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)和4-二甲氨基吡啶(DMAP),均购自梯希爱(上海)化成工业发展有限公司;盐酸阿霉素(DOX·HCl)和多烯紫杉醇(DTX),均购自北京华奉联博化学材料有限公司;透析袋购自科昊生物工程有限公司;人肝脏组织蛋白酶B与猪肝酯酶均购自美国西格玛奥德里奇公司;细胞毒性活性试剂检测盒CCK-8与4′,6-二脒基-2-苯基吲哚(DAPI)购自英国赛默飞世尔公司;人乳腺癌细胞MDA-MB-231购自上海细胞库;其他化学试剂均由天津市富宇精细化工有限公司提供。
2 方法与结果
2.1PMLA-DOX/DTX的制备 采用课题组建立的方法合成载体PMLA[12-15],以L-天冬氨酸为原料,通过氨基重氮化、酯化和阴离子开环聚合反应,最后氢化得PMLA。得到的PMLA透析除去小相对分子质量的聚合物,冷冻干燥待用。取116 mg干燥的PMLA(相对分子质量9 kDa,含-COOH 1 mmol)、172.6 mg NHS(1.5 mmol)、191.7 mg EDC·HCl(1 mmol)和122.17 mg DMAP(1 mmol)溶于无水二甲基亚砜(DMSO),抽真空反应2 h。DOX·HCl与三乙胺(TEA)反应过夜,得到游离DOX。同时将游离DOX(0.5 mmol)与DTX(0.5 mmol)加入PMLA反应液,真空通N2保护,避光反应24 h,透析冻干得180 mg PMLA-DOX/DTX,合成路线见图1。
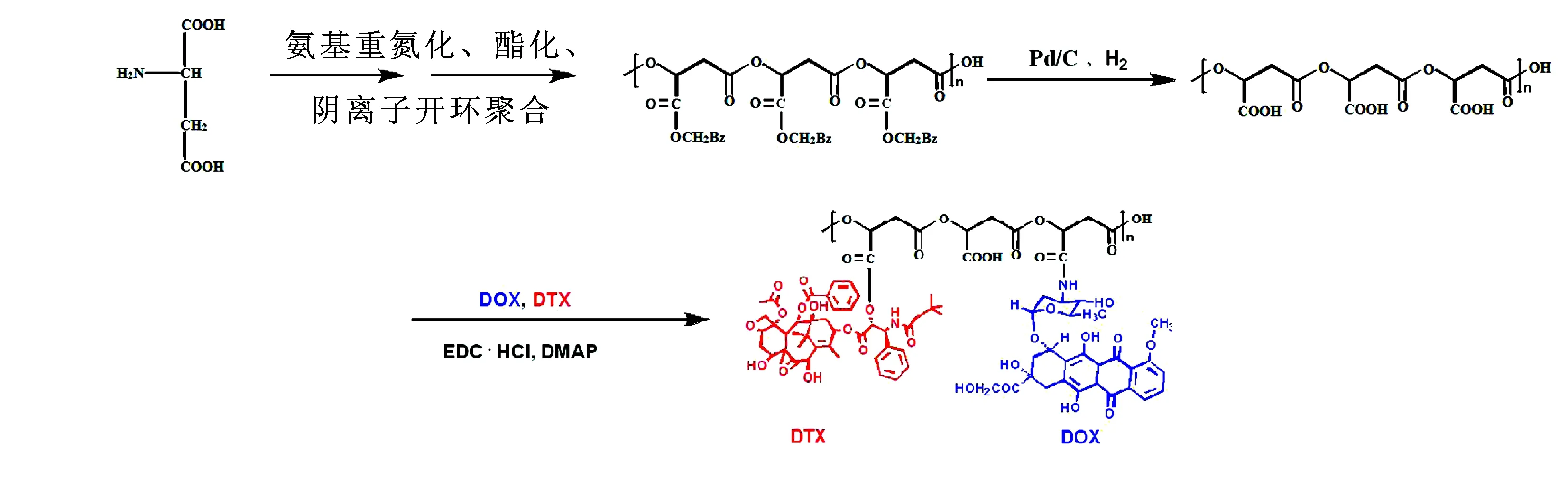
图1PMLA-DOX/DTX的合成路线
Fig.1 The synthesis route of PMLA-DOX/DTX
2.2PMLA-DOX/DTX的结构表征 取10 mg PMLA-DOX/DTX溶于氘代DMSO,核磁共振氢谱(1H-NMR)结果见图2。2.95~3.02为主链上亚甲基质子峰,5.39~5.41为主链上次甲基质子峰。共聚物在7.0~8.0出现的苯环质子峰来自药物,证实两药共价连接于载体。
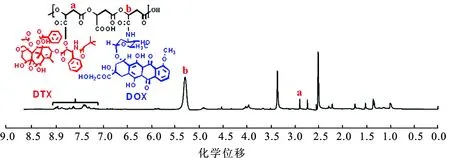
图2PMLA-DOX/DTX的核磁共振氢谱
Fig.2 The1H-NMR spectroscopy of PMLA-DOX/DTX
2.3载药率的测定 各取10 mg PMLA-DOX/DTX溶于透析袋内,分别置于100 mL pH值为7.4与pH值为5.0 的PBS缓冲液中,模拟体内环境,在pH值为7.4的缓冲液中加入猪肝酯酶(0.25 U),pH值为5.0的缓冲液中加入组织蛋白酶B(300 U),37 ℃,100 r·min-1搅拌。1 h后每隔一段时间吸取上述缓冲液各20 μL,直至对应游离药物的高效液相色谱峰峰面积不再增加,计算其药物含量。DOX的色谱条件:十二烷基硫酸钠溶液(取十二烷基硫酸钠1.44 g和磷酸0.68 mL,加水500 mL使溶解)∶乙腈∶甲醇=500∶500∶60;流速:1.0 mL·min-1;柱温:35 ℃;检测波长:254 nm。DTX的色谱条件:流动相:乙腈∶水=45∶55;流速:1.0 mL·min-1;柱温:35 ℃;检测波长:227 nm。精密称取10 mg DOX和DTX分别溶于10 mL流动相中,配置成质量浓度为1 mg·mL-1的母液,根据母液准确稀释至100,75,50,25和10 μg·mL-1的梯度质量浓度的DOX和DTX系列标准溶液。滤膜过滤后,取20 μL进样记录不同质量浓度峰面积,计算其标准曲线的回归方程。根据此标准曲线计算缓冲液中游离药物的质量浓度。见图3。由图3可知,分别按照两药的标准曲线计算,按照共聚物中药物的载药率计算:
载药率(%)=m药物÷(m药物+m聚合物),得DOX的载药率为21.5%±1.2%,DTX的载药率为11.03%±1.51%。
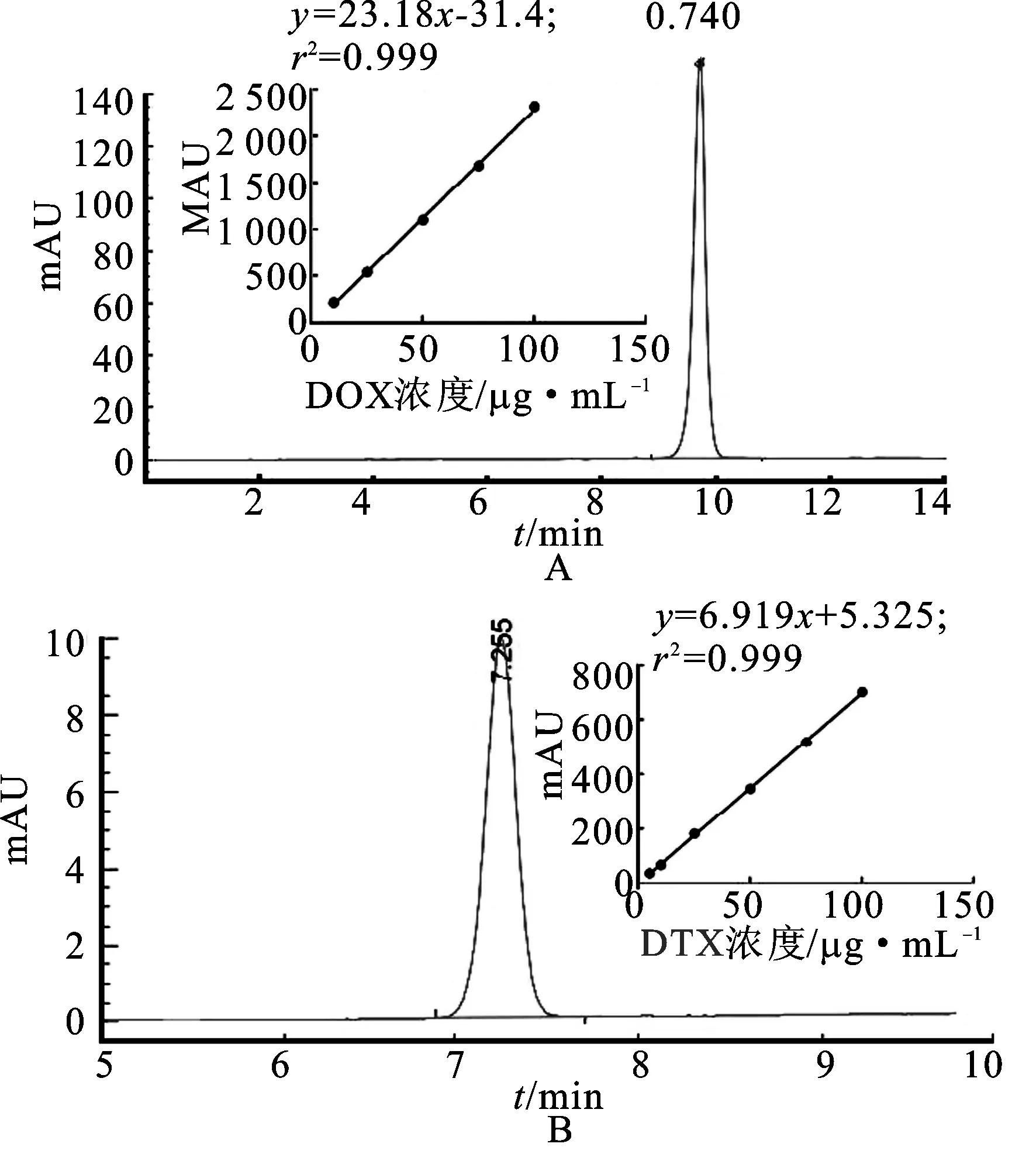
图3DOX(A)与DTX(B)的高效液相图谱及对应标准曲线
Fig.3 The HPLC chromatograms and the standard curve of DOX and DTX
2.4PMLA-DOX/DTX胶束的制备 称取不同质量的PMLA-DOX/DTX溶于去离子水中(终质量浓度为2,1,0.5,0.1和0.05 mg·mL-1),搅匀,各取1 mL,缓慢滴入20 mL DMSO,搅拌4 h,再移至相对分子质量为7 kDa的透析袋中,用去离子水透析24 h,37 ℃下放置2 h,动态光散射粒度分析仪测其水合粒径。通过透射电子显微镜,观察其形态与表面特征。不同质量浓度的聚合物制备胶束时,质量浓度为1 mg·mL-1的聚合物所制得的胶束均一性更好,粒径在150 nm左右,多分散性指数为0.14,见图4。

图4PMLA-DOX/DTX胶束的粒径与透射电镜图
Fig.4 The particle size and transmission electron microscope image of micelle
2.5体外释药 称取10 mg PMLA-DOX/DTX溶于透析袋内,分别以50 mL pH值为5.0和7.4的缓冲液为释放介质,在透析袋内加入300 U的组织蛋白酶B与0.25 U的猪肝酯酶,37 ℃,100 r·min-1搅拌。分别在1,2,4,6,8,10,12,24,36,48 和72 h取出200 μL,同时补进同体积的相应缓冲溶液。用HPLC分别在波长254与227 nm处测定,计算DOX与DTX的质量浓度。共聚物体外释药曲线见图5,由于酯键的水解较酰胺键的水解速度更快,DTX的释放速率较快。在释放前4 h内,pH值为7.4的缓冲液中DOX与DTX的释放率分别为8.5%与17.6%,而此后DOX的释放速率逐渐降低,DTX一直保持较DOX快的释放速率。上述释放特点能在早期实现两药的序贯释放和对肿瘤细胞的快速杀伤作用。

图5PMLA-DOX/DTX在37℃PBS缓冲液中累积释药曲线
Fig.5 Theinvitroaccumulate release profile of PMLA-DOX/DTX in PBS buffer at 37 ℃
2.6细胞毒性研究 将对数生长期的乳腺癌细胞 MDA-MB-231接种到96 孔板中,每孔1×104个,置于37 ℃、体积分数为5%的CO2孵育箱中培养。待细胞长至80%,弃去原有培基,给药总质量浓度为1.5 μg·mL-1,检测两药(DOX/DTX)在不同摩尔比(20∶1,10∶1,2∶1,1∶1,5∶1,1∶2,1∶7)时的细胞活性。每孔加入10 μL CCK-8溶液,继续培养4 h,用酶联免疫检测仪测定各孔的吸光度值A,测定波长为490 nm,计算细胞的存活率。细胞存活率计算公式:
见图6。由图6 B可知,两药(DOX/DTX)摩尔比为10∶1时,对MDA-MB-231细胞的协同效果最好。加入同摩尔比的PMLA-DOX/DTX(1,5,10,20和40 μg·mL-1)处理细胞48 h,各质量浓度设5个复孔,并设空白对照组计算半数抑制质量浓度(IC50)。由图6 A可知,PMLA-DOX/DTX的IC50为9.21 μg·mL-1。
2.7细胞内摄作用 将对数生长期的乳腺癌MDA-MB-231细胞接种至激光共聚焦培养皿,使细胞悬浮液中细胞数为每毫升1×104个,铺板完成后,置于37 ℃孵箱中培育24 h,待细胞贴壁后,弃去旧培养液,加入含药培养基(DOX质量浓度为1.3 μg·mL-1),继续培养4 h使细胞充分摄取药物,固定染色,激光共聚焦观察药物入胞。用激光共聚焦显微镜观察细胞对不同药物的摄取,见图7。由图7可知(红色为DOX,蓝色为细胞核染料DAPI),4 h后所有样品中均有DOX入细胞核。其中PMLA-DOX/DTX的阿霉素荧光强度最高,说明该组药物入胞最多。
图6共聚物PMLA-DOX/DTX的细胞毒实验
A.细胞生长抑制曲线;B.2种药物不同比例对MDA-MB-231细胞的毒性作用。*P<0.05,**P<0.01。
Fig.6 The cytotoxicity of PMLA-DOX/DTX in MDA-MB-231
A.the growth-inhibitory curve of PMLA-DOX/DTX;B.the influence of different drug ratios on the cytotoxicity to MDA-MB-231 cells.*P<0.05,**P<0.01.
图7激光共聚焦观察PMLA-DOX/DTX的入胞(比例尺为50μm)
A.游离药物DOX;B.PMLA-DOX;C.PMLA-DOX/DTX在37 ℃与MDA-MB-231细胞共孵育4 h。
Fig.7 Cell internalization of PMLA-DOX/DTX observed by confocal laser scanning microscopy (scale bar was 50 μm)
A.free DOX;B.PMLA-DOX;C.PMLA-DOX/DTX incubated with MDA-MB-231 cell for 4 h under 37 ℃.
3 讨论
本实验选用PMLA作为载体,以“一锅煮”法分别通过酰胺键与酯键连接DOX与DTX。DOX和DTX载药率分别为21.5%±1.2%和11.03%±1.51%。进一步考察2种药物体外释药,组织蛋白酶B[16]是一种在肿瘤组织中高表达的水解酶,弱酸性环境中易被活化,可促进DOX在酸性环境中的释放。因此,DOX在组织蛋白酶B催化作用后,在pH值为5.0的释放率增加,且释放表现酸依赖性。相反,猪肝酯酶在pH值为7.4比pH值为5.0时活性更高,因而DTX在中性条件比酸性条件释放更多。此法合成步骤简单,具有载药率高、减少药物泄露等优点。Ma Y等[17]利用壳聚糖为载体,制备了2种药物共载的聚合物胶束,先用酸敏键连接DOX,再与普朗尼克F127形成胶束物理包封紫杉醇。结果表明,多步反应的载药率最高仅为15.94%(阿霉素)与9.01%(紫杉醇),且2种药物的体外释药无明显的酸依赖性。聚合物药物共聚物透析法制备胶束,形成的纳米粒为规整均一的球形,粒径为150 nm,多分散性指数为0.14。根据多个纳米研究团队对纳米粒粒径的研究[18-20],纳米粒(≥100 nm)具有长循环特性,纳米粒(≤50 nm)具有强的肿瘤组织穿透及渗透能力。说明纳米共聚物制备成胶束具备体内长循环特性,并可通过肿瘤富集与渗透效应实现在肿瘤组织中的高效富集。因此,PMLA作为载体材料既可多功能修饰也可制备成合适粒径大小的纳米粒。细胞抑制实验和细胞摄取实验中聚合物药物共聚物对MDA-MB-231细胞的抑制率和入胞明显优于游离药物组,这是因为聚合物药物共聚物改变了药物入胞的方式,促进了药物入胞,提高了药物的细胞毒性。
综上所述,这种以聚合物载体连接多种药物协同杀伤肿瘤细胞的方式,既改善了药物的水溶性,也有助于减少游离药物的用量。本研究为构建基于PMLA的联合递药体系奠定了重要基础。
参考文献:
[1] Devita V T Jr,Young R C,Can ellas G P.Combination versus single agent chemotherapy:a review of the basis for selection of drug treatment of cancer[J].Cancer,1975,35(1):98-110.
[2] R Jahanban-Esfahlan,K Seidi,Banimohamad-shotorbani B,et al.Combination of nanotechnology with vascular targeting agents for effective cancer therapy[J].J Cell Physiol,2018,233(4):2982-2992.
[3] Ljubimova J Y,Sun T,Mashouf L,et al.Covalent nano delivery systems for selective imaging and treatment of brain tumors[J].Adv Drug Deliv Rev,2017,113:177-200.
[4] Du C,Qian J,Zhou L,et al.Biopolymer-drug conjugate nanotheranostics for multimodal imaging-guided synergistic cancer photothermal-chemotherapy[J].ACS Appl Mater Interfaces,2017,9(37):31576-31588.
[5] Jacobs C,Clemons M,Mazzarello S,et al.Enhancing accrual to chemotherapy trials for patients with early stage triple-negative breast cancer:a survey of physicians and patients[J].Support Care Cancer,2017,(25):1881-1886.
[6] Mavroudis D,Saloustros E,Boukovinas I,et al.Sequential vs concurrent epirubicin and docetaxel as adjuvant chemotherapy for high-risk, node-negative, early breast cancer:an interim analysis of a randomised phase III study from the Hellenic Oncology Research Group[J].Br J Cancer,2017,117(2):164-170.
[7] Joensuu H,Kellokumpu-Lehtinen P L,Huovinen R,et al.Adjuvant Capecitabine in Combination With Docetaxel,Epirubicin,and Cyclophosphamide for Early Breast Cancer:The Randomized Clinical FinXX Trial[J].JAMA Oncol,2017,3(6):793-800.
[8] Bao Y,Yin M,Hu X,et al.A safe,simple and efficient doxorubicin prodrug hybrid micelle for overcoming tumor multidrug resistance and targeting delivery[J].Journal of Controlled Release,2016,235:182-194.
[9] Khandare J,Minko T.Polymer-drug conjugates:Progress in polymeric prodrugs[J].Progress in Polymer Science,2006,31(4):359-397.
[10]Pendri A,Conover C D,Greenwald R B.Antitumor activity of paclitaxel-2′-glycinate conjugated to poly(ethylene glycol):a water-soluble prodrug[J].Anticancer Drug Des,1998,13(5):387-395.
[11]Huynh L,Leroux J,Allen C.Enhancement of docetaxel solubility via conjugation of formulation-compatible moieties[J].Organic & Biomolecular Chemistry,2009,7(17):3437.
[12]Sandrine Cammas,Isabelle Renard,Valerie Langlois,et al.Poly(β-malic acid):obtaining high molecular weights by improvement of the synthesis route[J].Polymer,1996,37(18):4215-4220.
[13]Qiao Y,Duan X,Fan L,et al.Synthesis of controlled molecular weight poly (β-malic acid) and conjugation with HCPT as a polymeric drug carrier[J].Journal of Polymer Research,2014,21(4):397.
[14]郭松岩,崔明凤,周青,等.PMLA-PEG-TAT 纳米接枝物的合成和生物活性研究[J].西北药学杂志,2015,30(2):176-181.
[15]李伟,段晓,范黎,等.叶酸介导的聚乙二醇-聚苹果酸-喜树碱聚合物前药的制备和性质初探[J].西北药学杂志,2013,28(4):396-399.
[16]Kurtoglu Y E,Mishra M K,Kannan S,et al.Drug release characteristics of PAMAM dendrimer-drug conjugates with different linkers[J].International Journal of Pharmaceutics,2010,384(1/2):189-194.
[17]Ma Y,Fan X,Li L.pH-sensitive polymeric micelles formed by doxorubicin conjugated prodrugs for co-delivery of doxorubicin and paclitaxel[J].Carbohydr Polym,2016,137:19-29.
[18]Tang L,Yang X,Yin Q,et al.Investigating the optimal size of anticancer nanomedicine[J].Proc Natl Acad Sci U S A,2014,111(43):15344-15349.
[19]Hoshyar N,Gray S,Han H,et al.The effect of nanoparticle size oninvivopharmacokinetics and cellular interaction[J].Nanomedicine (Lond),2016,11(6):673-692.
[20]Tang L,Gabrielson N P,Uckun F M,et al.Size-dependent tumor penetration andinvivoefficacy of monodisperse drug-silica nanoconjugates[J].Mol Pharm,2013,10(3):883-892.
