致心律不齐性右心室型心肌病患者右心室室壁脂肪浸润或纤维化程度与右心室功能及容积的相关性
2018-05-18李国忠王福海陆敏杰
李国忠,庞 军*,王福海,陆敏杰
(1.沧州市人民医院磁共振科,河北 沧州 061000;2.国家心血管病中心 中国医学科学院阜外医院磁共振影像科,北京 100037)
致心律不齐性右心室型心肌病(arrhythmogenic right ventricular cardiomyopathy, ARVC)以右心室心肌进行性脂肪或纤维脂肪组织替代为特征,其右心室形态与功能异常表现,伴发心脏电生理及遗传性特征改变[1];本病发病率较低,主要见于青年,多20~40岁发病,临床主要表现为心悸、晕厥、心律失常及心源性猝死等[2]。ARVC起病隐匿,早期右心室改变轻微,易误漏诊[3]。MRI可反映心脏形态、结构、功能、心肌活性等,心肌延迟增强(lated gadolinium enhancement, LGE)可反映ARVC患者心肌纤维化程度[4-5]。本研究探讨ARVC患者右心室室壁脂肪浸润或纤维化与右心室功能及容积的相关性。
1 资料与方法
1.1 一般资料 2012年2月—2017年5月连续收集沧州市人民医院20例ARVC患者,男11例,女9例,年龄22~70岁,平均(44.9±14.1)岁;胸闷9例、憋气8例、心悸15例,5例有晕厥病史,3例有家族史;24 h动态心电图(Holter)/12导联标准心电图提示室性早搏源于右心室19例,源于双心室1例;不完全右束支传导阻滞7例,ST-T改变6例,完全性右束支传导阻滞3例。纳入标准:24 h Holter/12导联标准心电图示右心室来源频发早搏、多源早搏,或经心脏电生理检查确诊;右心扩大并整体或局部收缩功能减低;符合欧洲心脏病协会2010年修订标准[6];常规X线胸片、心电图及经胸超声心动图检查资料齐全。排除冠心病、瓣膜病、先天性心脏病等右心室受累疾患。
1.2 仪器与方法 采用Siemens Magnetom Avanto 1.5T超导型MR仪,梯度场强50 mT/m,梯度切换率200 T/m/s。采用头先进仰卧位和屏气法,相控阵表面线圈和无线矢量心电门控扫描。
对心律齐者行轴位和矢状位黑血准备半傅里叶快速自旋回波(half-Fourier acquisition single-shot turbo fast spin echo, HASTE)序列(14~16层,层厚8 mm,FOV 320 mm×320 mm)扫描,对病变典型层面采用黑血TSE序列结合脂肪抑制及水脂分离序列(T1W、T2W、脂肪抑制T1W和T2W);以回顾性心电门控真实稳态自由进动梯度回波(true fast imaging with steady-state free precession, True FISP)序列检查左右心功能,扫描层面主要包括标准左心室长轴四腔心、两腔心,并在标准左心室长轴两腔心及四腔心切面电影基础上行6~8层左心室短轴电影,层厚6 mm,层间距2~3 mm,TR 39.15 ms,TE 1.10 ms,翻转角70°,FOV 320 mm×320 mm~380 mm×380 mm,矩阵256×150~256×180。对心律不齐者采用时间调整敏感编码(time-adaptive sensitivity encoding, TSENSE)技术。
增强扫描:采用双筒Medrad高压注射器,经肘静脉注入对比剂Gd-DTPA,剂量0.2 mmol/kg体质量,10~15 min后行LGE扫描。对心律齐者采用相位敏感反转恢复(phase-sensitiveinversion recovery, PSIR)序列,心律不齐者采用运动伪影矫正(motion correction, MOCO)True FISP PSIR延迟增强技术;层厚6 mm,层间距1~2 mm,TR 5.1 ms,TE 2.5 ms,翻转角15°,FOV 320 mm×320 mm,矩阵256×150~256×256。
1.3 图像分析 由2名放射科资深医师单独评价MRI后再讨论后确定。于True FISP电影序列左心室短轴最大径切面(一般乳头肌层面)测量最大左、右心室舒张末横径(end-diastolic dimension, EDD),于右心室流出道电影序列测量右心室流出道横径[7]。
以2D黑血TSE序列结合水脂分离成像及对比剂延迟增强成像评价心肌脂肪浸润或纤维化程度。右心室室壁脂肪浸润或心肌纤维化指数=脂肪浸润或纤维化节段数/总节段数×100%。采用美国心脏学会(American Heart Association, AHA)左心室17节段分析法,将水脂分离及延迟增强图像分为正常心肌或心肌高信号;将右心室划分为前壁/游离壁、下壁、心尖、流出道4个节段。观察右心腔EDD、心肌内脂肪浸润区、右心室流出道径线、心肌灌注延迟显像的强化带,记录病变大小、程度、范围和分布。
采用心功能专用分析软件(Syngca VBIOB,syngo V 49B.Argus© VA60C,Erlangen)评价左心室短轴电影图像,分别计算左右心室射血分数(ejection fraction, EF)、舒张末容积指数(end-diastolic volume index, EDVI)、收缩末容积指数(end-systolic volume index, ESVI)、心输出量指数(cardiac output index, CI)和右心室心肌质量指数(myocardial mass index, MASSI)等心功能参数。
1.4 统计学分析 采用SPSS 20.0统计分析软件。计量资料以±s表示,计数资料以绝对数及百分率表示,采用线性相关分析评价脂肪或纤维脂肪浸润与右心功能及右心室容积的关系,P<0.05为差异有统计学意义。
2 结果
ARVC患者典型表现为右心房、右心室扩大,以后者为著,右心室流出道横径(52.42±11.80)mm,见图1A、1B;右心壁变薄,以右心室前壁(n=20)、右心室流出道(n=15)、心尖部(n=14)最常见;11例心包下脂肪与心肌边界不清(图1C~1F),2例合并左心室腔增大。
右心室EDD、EF、EDVI、ESVI、CI、MASSI分别为(50.13±8.71)mm、(18.13±6.71)%、(169.13±72.11)ml/m2、(117.01±67.31)ml/m2、(1.81±0.20)L/(min·m2)、(17.62±1.80)g/m2。左心室EDD、EF、EDVI、ESVI、CI分别为(47.62±6.31)mm、(55.82±7.50)%、(66.82±27.41)ml/m2、(32.83±16.21)ml/m2、(2.41±0.40)L/(min·m2)。2例合并左心室受累。 T1WI及T2WI表现为局部右心室心肌与心外膜下脂肪分界不清、延迟强化受累心肌壁呈条样明显高信号,部分近乎透壁,呈“室壁瘤样扩张”(图1G、1H)。20例(20/20,100%)右心室游离壁/前壁均受累,10例(10/20,50.00%)下壁受累,14例(14/20,70.00%)心尖部受累,15例(15/20,75.00%)右心室流出道受累。20例均有不同程度右心室脂肪或纤维脂肪浸润,右心室室壁脂肪浸润或纤维化指数为(70.00±22.33)%。右心室室壁脂肪浸润或纤维化指数与右心室EF呈负相关(r=-0.627,P=0.003;图2A),与右心室EDVI(r=0.695,P=0.001)及ESVI均呈正相关(r=0.676,P=0.001),见图2B、2C。
3 讨论
本组ARVC典型表现为心律不齐起源于右心室,包括室性早搏、室性心动过速、传导阻滞等;形态学改变主要表现为右心室明显增大,部分合并左心室增大;右心室部分或大部室壁被脂肪或纤维脂肪替代,相应节段变薄且运动功能减弱,甚至形成室壁瘤或瘤样扩张[3],以右心室流出道、心尖部和下壁为好发部位,与既往研究[1]结果一致。
Sen-Chowdhry等[8]将ARVC表现形式分为3种:①经典型,单纯右心室受累或右心室损害为主并伴左心室受累;②左心室型,左心室受累表现为主,右心室受累相对较轻;③双心室型,左右心室受累程度几乎相同。Ma等[9]认为可将MRI检出右心室形态功能异常作为预测ARVC患者猝死的指标。
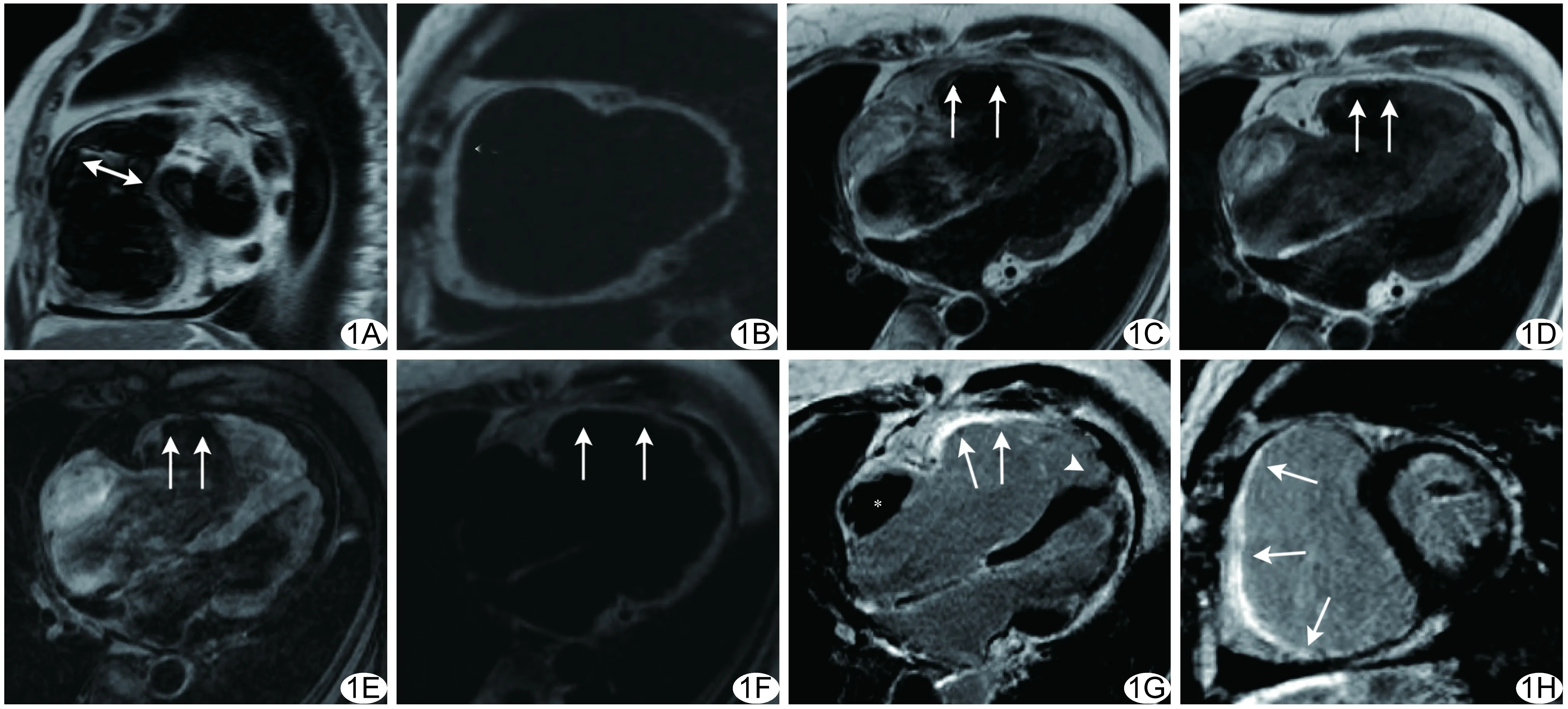
图1 患者女,45岁,典型致心律不齐性右心室型心肌病 A.黑血序列右心室流出道层面示右心室流出道明显增宽,室壁变薄(双向箭); B.心室短轴位水脂分离脂相图; C~F.四腔心T2WI(C)、T1WI(D)、T1WI脂肪抑制序列(E)、水脂分离脂相图(F)示右心室流出道及游离壁室壁变薄,与心外膜下脂肪分界不清,几乎均为脂肪样高信号(箭),其高信号可被脂肪抑制序列抑制;边缘毛糙,局部呈“室壁瘤样扩张”; G、H.四腔心(G)及心室短轴面(H)延迟强化示右心室游离壁、下壁、右心室流出道明显异常强化,近乎透壁(箭),右心室心尖部心内膜下条样强化(箭头),右心房内可见附壁血栓(*)
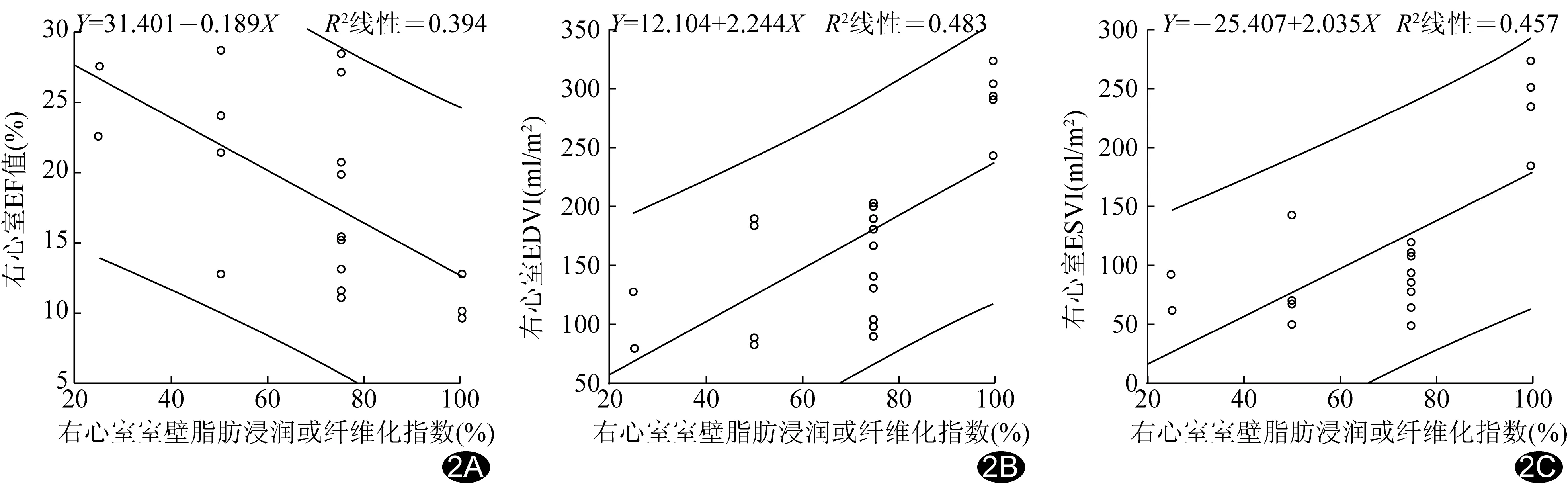
图2 右心室室壁脂肪浸润或纤维化指数与右心室EF(A)、EDVI(B)及ESVI(C)相关性散点图
ARVC患者右心室心肌脂肪及纤维脂肪浸润可导致频发室性早搏,甚至室性心动过速、心室颤动等恶性心律失常[4]。本组ARVC临床表现以非特异性胸闷、心悸、晕厥等为主,电生理检查提示ARVC室性早搏源于右心室心肌,且常合并左束支传导阻滞,提示对于心悸、心慌等快速性室性心律失常患者,临床需注意鉴别室性心律失常的异位兴奋点来源,如来源于右心室,则应警惕ARVC。
ARVC的MRI表现以右心室室壁脂肪及纤维脂肪浸润为特征,受累节段收缩功能减低,左心室则仅ARVC晚期(双心室受累期)受累,右心室形态及功能改变多较左心室更显著[10]。本组MR延迟增强扫描可清晰显示ARVC心室壁心肌纤维化部位、程度及受累节段数,从而可靠地反映右心室容积、射血分数、心指数等功能情况。
研究[11]发现致心律不齐性左心室型心肌病主要表现为左心室不同程度脂肪或纤维脂肪浸润,而右心室几乎不受累,无典型脂肪或纤维脂肪浸润,亦无局部或整体的右心功能异常。而ARVC以右心室受累为主,增大明显,合并左心室受累时(双心室受累)主要表现为左心室脂肪或纤维脂肪浸润[12-13],一般在显著右心扩张及功能减弱基础上发生左心结构及功能异常,本组2例合并左心室受累。
有学者[14-15]探讨心肌纤维化与各种心血管疾病诊断、预后的关系,认为心肌纤维化及其严重程度与不良预后相关。目前MRI空间分辨率尚不足以完全区分心外膜下脂肪与早期心肌内纤维脂肪,脂肪或纤维组织在心肌延迟显像均表现为高信号[1],故本研究采用右心室室壁脂肪浸润或纤维化指数评价右心室心功能与容积的相关性。
ARVC患者右心室心功能是临床最为关注的指标。本组右心室EF、EDVI、ESVI、CI均较既往研究[7]减低,右心室EDD较既往研究[7]增大;右心室室壁脂肪浸润或纤维化指数与右心室EF呈负相关,与右心室EDVI和ESVI均呈正相关,提示影响患者右心室收缩功能者主要为右心室室壁脂肪浸润或纤维化程度,可影响右心室重构,间接反映心脏功能变化。ARVC患者右心室压力一般增高,因受力不均、长期损伤可继发纤维化改变[16]。
本研究局限性:以影像学为参考诊断ARVC,多数未能进行心肌活检;缺乏基因学资料;患者合作欠佳或心律不齐等因素可能降低MR图像分辨率,心包周围脂肪组织及心腔内较缓慢血流信号可影响判断室壁厚度,进而影响准确评价心功能;样本数较少,且未进行随访观察。
[参考文献]
[1] 赵世华,蒋世良,陆敏杰.心血管病磁共振诊断学.北京:人民军医出版社,2011:119-124.
[2] Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) Endorsed by: Association for European Paediatric and ongenital Cardiology (AEPC). Eur Heart J, 2015,36(41):2793-2867.
[3] Corrado D, Basso C, Thiene G. Arrhythmogenic right ventricular cardiomyopathy: Diagnosis, prognosis, and treatment. Heart, 2000,83(5):588-595.
[4] Tandri H, Saranathan M, Rodriguez ER, et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am Coll Cardiol, 2005,45(1):98-103.
[5] Iles LM, Ellims AH, Llewellyn H, et al. Histological validation of cardiac magnetic resonance analysis of regional and diffuse interstitial myocardial fibrodsis. Eur Heart J Cardiovasc Imaging, 2015,16(1):14-22.
[6] McKenna WJ, Thiene G, Nava A. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology. Br Heart J, 1994,71(3):215-218
[7] 陆敏杰,赵世华,蒋世良,等.中国人心脏房室腔内径及左右心室功能正常参数的MRI研究.中华放射学杂志,2011,45(10):924-928.
[8] Sen-Chowdhry S, Syrris P, Ward D, et al. Clinical and geneticcharacterization of families with arrhythmogenic right ventricular dysplasia/cardiomyopathy provides novel in sights into patterns of disease expression. Circulation, 2007,115(13):1710-1720.
[9] Ma N, Cheng H, Lu M, et al. Cardiac magnetic resonanceimaging in arrhythmogenic right ventricular cardiomyopathy: Correlation to the QRS dispersion. Magn Reson Imaging, 2012,30(10):1454-1460.
[10] 陆敏杰,赵世华,蒋世良,等.磁共振成像在致心律不齐性右心室型心肌病的诊断价值.中华心血管病杂志,2006,34(12):1077-1080.
[11] 李国忠,赵世华,陆敏杰,等.致心律失常性左心室心肌病的临床及MRI研究.中华放射学杂志,2016,50(2):95-100.
[12] Lindström L, Nylander E, Larsson H, et al. Left ventricularinvolvement in arrhythmogenic right ventricular cardiomyopathy: A scintigraphic and echocardiographicstudy. Clin Physiol Funct Imaging, 2005,25(3):171-177.
[13] McCrohon JA, John AS, Lorenz CH, et al. Images incardiovascular medicine. Left ventricular involvement in arrhythmogenic right ventricular cardiomyopathy. Circulation, 2002,105(11):1394.
[14] 马小海,赵蕾,李松南,等.磁共振T1 mapping成像评价肥厚型和扩张型心肌病弥漫性心肌纤维化.中国医学影像技术,2016,32(1):52-56.
[15] Ling LH, Taylor AJ, Ellims AH, et al. Sinus rhythm restores ventricular function in patients with cardiomyopathy and no late Gadolinium enhancement on cardiac magnetic resonance imaging who undergo catheter ablation for atrial fibrillation. Heart Rhythm, 2013,10(9):1334-1339.
[16] Shehata ML, Lossnitzer D, Skrok J, et al. Myocardial delayed en-hancement in pulmonary hypertension: Pulmonary hemodynamics, right ventricular function, and remodeling. AJR Am J Roentgenol, 2011,196(1):87-94.
