簇状锐钛矿/金红石纳米线修饰纯钛表面的体外活性研究
2018-05-17高岩刘影徐淑兰周磊
高岩 刘影 徐淑兰 周磊
南方医科大学口腔医院(广东省口腔医院)1种植中心,2牙体牙髓科(广州510280)
纳米技术已经成为现在生物材料研究方面比较热门的一个领域。很多纳米的表面证实具有较好的理化特性及生物活性,如纳米管,纳米线等[1⁃3]。研究细胞与纳米材料的直接接触反应可以让我们更深入的探索细胞反应的早期过程[4⁃6]。近年来,大量的体外实验已经证实纳米线可以作为较好的靶向运输体,还可以传递生物信息[7⁃9]。纳米线在生物医学领域的应用需要前期大量基础的研究。纳米线的生物相容性和细胞的反应仍然存在争议,其形貌、化学组成、表面结构或表面功能基团等均会对细胞的早期反应起重要作用[10-11]。理解细胞与钛生物材料之间的相互作用,有利于促进生物材料的迅速发展。目前大量基础研究重点是为了增强细胞与材料之间的整合,这有利于临床口腔种植体的长期成功。
二氧化钛作为优良的半导体广泛应用于光化学领域。二氧化钛包含3种不同晶型,锐钛矿、金红石和非晶态钛。实验证实[12⁃16],锐钛矿和金红石具有优良的生物活性,可以促进细胞早期的黏附增殖等反应。本研究拟在纯钛表面制备出独特的金红石/锐钛矿纳米线,并通过实验证实其体外生物活性。
1 材料与方法
1.1 锐钛矿/金红石纳米线(AR@NWs)的制备利用数控机床将四级纯钛板切割成钛片(直径15 mm,厚度1.5 mm),再利用250、400、600、1 000目SiC砂纸逐级打磨抛光钛片,继将钛片用无水丙酮、无水乙醇、去离子水依次超声清洗2次,15 min/次,待用。(1)将备用的钛片呈一定角度倾斜立于25 mL容积的聚四氟乙烯内衬里,继将10 mL 1 mol/L NaOH溶液倒入容积25 mL的聚四氟乙烯内衬里,使NaOH溶液浸没钛片,然后置于高压反应釜内密封,再置于220℃烘箱中加热8 h。散热后取出钛片,去离子水清洗钛片表面,置于50℃烘箱充分干燥;(2)进一步将处理过的钛片置于0.02 mol/L的稀盐酸溶液中1 h,再用去离子水清洗表面,彻底去除Na+;(3)最后置于马弗炉中,600℃煅烧1 h,散热后取出最终得到AR@NWs。通过碱热处理在钛片上制备出AR@NWs,期间生成STi@NWs,HTi@NWs和AR@NWs三种不同晶型的纳米线。因此,本实验分光滑钛片组(PT)、STi@NWs、HTi@NWs和AR@NWs四组。
1.2 锐钛矿/金红石纳米线表面特征检测 采用场发射扫描电镜(FESEM,JSM⁃6330F,JEOL,Japan)在高真空环境下,设置加速电压20.0 kV,分别在500×和10 000×扫描电镜下观察各组钛片表面纳米线形貌。刮取钛片表面纳米线并分散于无水乙醇中,然后采用透射电镜(TEM,JEM⁃2010,JE⁃OL,Japan)在真空环境下,200 kV加速电压,观察纳米线表面形貌。X射线衍射仪(XRD,D8 AD⁃VANCE,Bruker,Germany)检测表面晶型组成。
1.3 细胞免疫荧光染色行细胞计数及细胞形态观察 复苏冻存的MG63细胞株,接种至含1%双抗和10%胎牛血清的DMEM培养基的培养瓶中,然后置于细胞培养箱(37℃、5%CO2浓度)中培养,24 h后换液,去除未黏附的细胞,再加入培养基,每48 h换液,当细胞密度达到约80%时,PBS清洗后再用0.25%胰酶消化,然后加入DMEM培养基终止消化,进而进行传代。传代3~5次,当细胞生长状态良好时,0.25%胰酶消化后加入培养基制备细胞悬液,待用。
将各组钛片置于24孔细胞培养板内,利用细胞计数板进行计数统计,按照1×104/cm2细胞密度将细胞接种至细胞培养板内各组钛片表面,在培养1、2、4 h时,吸出各孔内培养基,并将钛片移至新的培养板内。先用PBS清洗,去除尚未充分黏附的细胞;再用细胞固定液3.7%多聚甲醛行细胞固定20 min;然后用0.1%Triton X⁃100行细胞通透5 min,再用PBS清洗去除多余Triton;然后用1%BSA封闭30 min;最后用Hoechst 33342(10 μg/mL)行细胞核染色10 min,PBS清洗后再用1∶40稀释的Alexa Flu⁃or® 635 phalloidin对细胞骨架肌动蛋白F⁃actin进行染色30 min,最后置于荧光显微镜下观察。
将各组钛片置于荧光显微镜下,在100×放大倍数下拍摄照片。每组设置3个样本,每个钛片样本显微镜下随机选择4个视野进行摄片,再用Image⁃Pro Plus 6.0图像分析软件计数,按照下面公式计算细胞黏附率,行统计学分析。
黏附率(%)=细胞黏附量/接种细胞量 ×100%
进一步在400×放大倍率下观察培养4 h的细胞形态。显微镜下分别对Hoechst 33342细胞核染色和Alexa Fluor® 635 phalloidin细胞肌动蛋白F⁃ac⁃tin染色的各组钛片表面进行摄片,再用Image⁃Pro Plus 6.0软件进行图像的合成,分析细胞生长情况。
1.4 统计学方法 采用统计学软件SPSS 17.0进行统计学分析,数值结果以±s表示。细胞黏附实验采用析因设计分析,进一步采用单因素方差进行组间分析,Levene′s test检验方差齐性,方差齐则采用Bonferroni检验对组间结果进行两两比较,方差不齐则采用Welch方法进行方差分析,Dunnett′s T3检验对组间结果进行两两比较。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 钛片表面形貌观察 图1为电镜下钛片表面形貌。图1A和1B为光滑钛片PT扫描电镜下表面形貌,可见明显呈方向一致的细小划痕。本实验通过碱热法经三步成功制备出成簇状的棒状纳米线(图1C、1D),各阶段生产的纳米线表面形貌均无明显差异。透射电镜25 000×下可见纳米线直径约200 nm(图1F)。
2.2 钛片表面晶相检测 图2为四组钛片表面晶相衍射图,即在碱热合成AR@NWs过程中的不同阶段生成的不同纳米线的表面晶型检测结果。如图2a仅有唯一图2b可以检测到由TiO6正八面体组成的二维正交晶系的钛酸钠 Na2Ti2O5·H2O晶型,图2c可以检测到由TiO6正八面体组成的二维正交晶系的 H2Ti2O5·H2O 晶型[17⁃19]。图 2d 即为 AR@NWs纳米线的晶相,可见有锐钛矿和金红石的峰出现。

图1 扫描电镜和透射电镜下光滑钛片和纳米线表面形貌Fig.1 The surface typical topography of PT and NWs using SEM and TEM
2.3 细胞免疫荧光染色下细胞粘附率计算及细胞形态观察 图3为四组钛片表面细胞培养1、2和4 h细胞黏附率比较。总体上看,四组纳米线钛片表面细胞黏附数量随孵育时间延长呈递增趋势,每个时间点组间差异具有统计学意义(P<0.05)。PT和AR@NWs表面细胞黏附率各时间点差异无统计学意义(P>0.05),但明显高于STi@NWs和HTi@NWs组(P< 0.05)。图4示四组钛片表面细胞培养4 h后免疫荧光染色下细胞形态结合图3,可发现100倍放大倍率下各组钛片表面均有大量细胞生长,较STi@NWs组(图4B)和HTi@NWs(图4C)组,PT组(图4A)和AR@NWs(图4D)表面细胞数量相对较多(P<0.05)。钛片表面细胞孵育4 h后,各组细胞开始伸展,部分细胞伸出伪足。400倍下可见PT组(图4E)表面细胞伸展方向与钛片表面细小斜痕相一致,AR@NWs组(图4H)可见细胞间伪足相互接触,建立联系,而STi@NWs组(图4F)和HTi@NWs组(图4G)表面细胞生长状态较差,只有个别细胞伸出伪足。
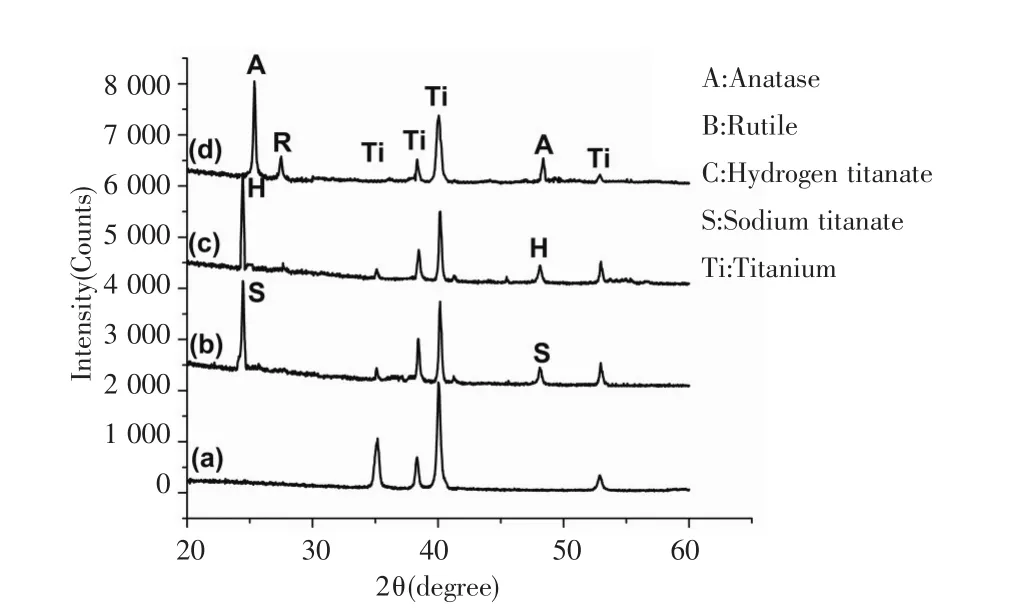
图2 各组纯钛表面晶相检测Fig.2 The crystal of different titanium surface
3 讨论
在过去的几十年,大量的纳米结构表面被制备出。一围的纳米线被认为是极好的靶向或生物分子输送载体[7⁃9]和可持续能源[20]。本实验通过碱热处理在钛片表面制备出独特的直径约200 nm簇状锐钛矿/金红石纳米线。
制备二氧化钛纳米线有很多方法,其中自组装法是目前制备纳米材料研究的热点方法,主要包括气象沉积法和水热处理法。此方法是利用分子、离子之间的某些作用力较强的化学键或物质特有的晶体结构的相互作用,使材料在一维方向上生长。水热处理法因容易操作,方法简单,成为目前制备二氧化钛纳米线最常用的科研研究方法。据报道将二氧化钛纳米粒与双氧水和盐酸的混合液在高温下处理3~12 h,可以得到长度10~80 μm的金红石二氧化钛纳米线[21]。
大量研究证实[12⁃16],表面晶型结构作为重要的表面化学特性,利于材料表面成骨,而锐钛矿和金红石同时存在的表面较单一的晶型结构可以更加明显地促进早期骨整合地建立。因此本实验中制备的锐钛矿/金红石纳米线理论上利于早期的成骨细胞反应。
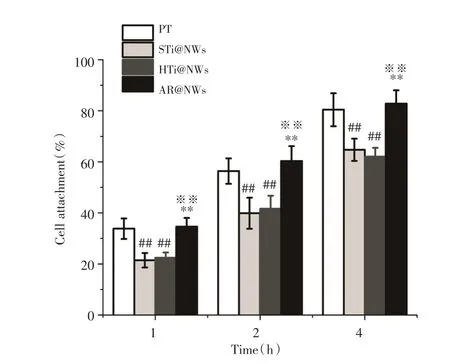
图3 各组钛片表面细胞培养1、2、4 h后细胞黏附率Fig.3 The rate of osteoblasts attached to the titanium surfaces after 1,2 h and 4 h of incubation
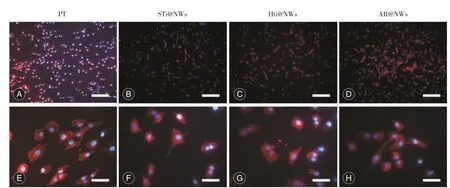
图4 各组钛片表面细胞培养4 h后免疫荧光染色下细胞形态Fig.4 The cell morphology of different groups of titanium surfaces after 4 h incubation using immunofluorescent staining
理解细胞和生物材料间的相互作用有利于促进生物医学的发展。研究表明[22],纯钛生物材料植入人体后,首先与周围的血液及体液相接触,促进蛋白在材料表面吸附,进而促使成骨细胞向材料表面迁移和黏附,随之引导细胞在材料表面的伸展和成长,最终表现为增殖分化成骨。本实验中在4 h内随着细胞孵育时间的延长,各组表面细胞黏附率增加。相对于光滑钛片组,只有AR@NWs组表面细胞黏附率无明显差异,STi@NWs和HTi@NWs组一定程度上抑制了细胞的黏附,然而三组纳米线组表面细胞黏附率水平又存在显著性差异。目前,纳米线的细胞相容性及生物活性研究相对复杂,存在一定的争议。本实验中,3种表面形貌相同但化学成分不同的纳米线阵列,一定程度上可以抑制细胞的黏附,原因可能与纳米线结构可以破坏细胞黏着斑的组装有关。而且,表面的纳米结构使纳米线产生细胞排斥性[23]。另有研究报道[24],纳米线结构可以穿入细胞内部从而影响细胞活力,最终导致细胞凋亡。AR@NWs组相对于STi@NWs和HTi@NWs组表面细胞并没有明显抑制细胞的黏附,可能归因于表面化学结构的不同,即表面化学成分和表面晶型结构在一定程度上补偿了纳米线的细胞排斥性。细胞胞体骨架在材料表面的伸展、延伸和生长是细胞行使后续生物学性能和细胞间信号传导至关重要的起始步骤[25]。在本实验中,相对于 STi@NWs和 HTi@NWs组,PT组和AR@NWs组表面细胞呈长条形或多边形的体积增大,并有较粗长的伪足伸出,细胞间突触接触建立联系。细胞间突触相互接触可以进一步促进细胞间的信号转导,利于细胞的进一步生长[22]。
目前,生物材料和细胞间的相互作用仍是一个具有争议而且复杂的问题。材料表面碳氢化合物等污染物、亲水性、表面电荷和表面Ti⁃OH的存在等均可能起到影响外,材料表面的物理化学特性包括表面晶型、表面粗糙度、表面能等等可能也会起到一定的作用。本实验中制备的簇状锐钛矿/金红石纳米线因表面化学成分和晶型结构的不同,在一定程度上补偿了纳米线的细胞排斥性,为材料表面纳米结构的研究提供理论基础。
参考文献
[1] MAO C,WANG Y,JIAO W,et al.Integrating zeolite⁃type chal⁃cogenide with titanium dioxide nanowires for enhanced photoelec⁃trochemical activity[J].Langmuir,2017,33(47):13634⁃13639.
[2] BO A,ALARCO J,ZHU H,et al.Nanojoint formation between ceramic titanate nanowires and spot melting of metal nanowires with electron beam[J].ACS Appl Mater Interfaces,2017,9(10):9143⁃9151.
[3] WANG G,XIAO X,LI W,et al.Significantly enhanced visible light photoelectrochemical activity in TiO nanowire arrays by ni⁃trogen implantation[J].Nano Lett,2015,15(7):4692⁃4698.
[4] MCKNIGHT T E,MELECHKO A V,HENSLEY D K,et al.Tracking gene expression after DNA delivery using spatially in⁃dexed nanofiber arrays[J].Nano Lett,2004,4(7):1213⁃1219.
[5] CAI D,MATARAZA J M,QIN Z H,et al.Highly efficient mo⁃lecular delivery into mammalian cells using carbon nanotube spearing[J].Nat Methods,2005,2(6):449⁃454.
[6] 钟江龙,范松,陈伟良,等.纳米碳混悬液示踪早期舌鳞癌前哨淋巴结的临床研究[J].口腔疾病防治,2016,24(2):101⁃104.
[7] FISCHER K E,NAGARAJ G,HUGH DANIELS R,et al.Hier⁃archical nanoengineered surfaces for enhanced cytoadhesion and drug delivery[J].Biomaterials,2011,32(13):3499⁃3506.
[8] FISCHER K E,ALWMÁN B J,TAO S L,et al.Biomimetic nanowire coatings for next generation adhesive drug delivery sys⁃tems[J].Nano Lett,2009 ,9(2):716⁃720.
[9] KWON N H,BEAUX M F,EBERT C,et al.Nanowire⁃based delivery of Escherichia coli O157 shiga toxin 1 A subunit into hu⁃man and bovine cells[J].Nano Lett,2007 ,7(9):2718⁃2723.
[10] JULIEN D C,RICHARDSON C C,BEAUX M F,et al.In vitroproliferating cell models to study cytotoxicity of silica nanowires[J].Nanomedicine,2010 ,6(1):84⁃92.
[11] LANONE S,BOCZKOWSKI J.Biomedical applications and po⁃tential health risks of nanomaterials:molecular mechanisms[J].Curr Mol Med,2006,6(6):651⁃653.
[12] YOUNG T S,CARINA J,ANN W,et al.Optimum surface prop⁃erties of oxidized implants for reinforcement of osseointegration:surface chemistry,oxide thickness,porosity,roughness,and crystal structure[J].Int J Oral Maxillofac Implants,2005,20(3):349⁃359.
[13] SUL Y T,JOHANSSON C,BYON E,et al.The bone response of oxidized bioactive and non ⁃bioactive titanium implants[J].Biomaterials,2005,26(33):6720⁃6730.
[14] SUL Y T,BYON E,WENNERBERG A.Surface charcteristics of electrochemically oxidized implants and acid⁃etched im⁃plants:surface chemistry,morphology,pore configurations,ox⁃ide thickness,crystal structure,and roughness[J].Int J Oral Maxillofac Implants,2008,23(4):631⁃640.
[15] XIE L,YIN G F,YAN D H,et al.Structure,morphology and fi⁃broblasts adhesion of surface⁃porous titanium via anodic oxidation[J].J Mater Sci Mater Med,2010,21(1):259⁃266.
[16] GAO Y,LIU Y,ZHOU L,et al.The Effects of Different Wave⁃length UV Photofunctionalization on Micro⁃Arc Oxidized Titani⁃um[J].Plos One,2013,8(7):e68086.
[17] LIU B,KHARE A,AYDIL E S.TiO2⁃B/anatase core⁃shell het⁃erojunction nanowires for photocatalysis[J].ACS Appl Mater In⁃terfaces,2011,3(11):4444⁃4450.
[18] LIU B,BOERCKER J E,AYDIL E S.Oriented single crystal⁃line titanium dioxide nanowires[J].Nanotechnology,2008,19(50):505604.
[19] BOERCKER J E,ENACHE⁃POMMER E,AYDIL E S.Growth mechanism of titanium dioxide nanowires for dye⁃sensitized solar cells[J].Nanotechnology,2008,19(9):095604.
[20] TIAN B,ZHENG X,KEMPA T J,et al.Coaxial silicon nanow⁃ires as solar cells and nanoelectronic power sources[J].Nature,2007,449(7164):885⁃889.
[21] LIU Y,WANG H,LI H,et al.Length⁃controlled synthesis of oriented single⁃crystal rutile TiO2 nanowire arrays[J].J Colloid Interface Sci,2011,363(2):504⁃510.
[22] AITA H,HORI N,TAKEUCHI M,et al.The effect of ultravio⁃let functionalization of titanium on integration with bone[J].Bio⁃materials,2009,30(6):1015⁃1025.
[23] ZHAO L Z,HU L S,HUO K F,et al.Mechanism of cell repel⁃lence on quasi⁃aligned nanowire arrays on Ti alloy[J].Biomateri⁃als,2010,31(32):8341⁃8349.
[24] KIM W,NG J K,KUNITAKE M E,et al.Interfacing silicon nanowires with mammalian cells[J].J Am Chem Soc,2007,129(23):7228⁃7229.
[25] HORI N,UENO T,SUZUKI T,et al.Ultraviolet light treatment for the restoration of age⁃related degradation of titanium bioactivi⁃ty[J].Int J Oral Maxillofac Implants,2010,25(1):49⁃62.
