白念珠菌ORF19.6012-MYC融合菌株的构建及鉴定
2018-05-17鲁仁义张晓龙阎澜姜远英
鲁仁义 张晓龙 阎澜 姜远英
(中国人民解放军第二军医大学药学院新药研究中心,上海 200433)
白念珠菌是最常见的机会致病真菌,当机体免疫功能正常时,与机体共生,而当机体免疫功能低下时,则会侵袭机体致病[1-2]。白念珠菌对机体的侵袭与其自身的生物学性质及多种毒力因子密切相关,例如菌丝形成、生物被膜形成以及粘附蛋白的合成及蛋白酶的分泌等[3-5],这涉及到细胞内蛋白质功能的正常发挥以及复杂的信号转导通路,大量的分子机制有待进一步研究阐明。其中,蛋白质水平的研究能够直接阐明细胞内分子作用机制,因此也尤为重要。然而由于没有抗白念珠菌蛋白质的成熟商业化抗体,若要进行蛋白质水平的研究,必须添加蛋白质标签。因此,本研究构建蛋白质标签融合菌株将为后续蛋白质水平研究奠定基础。蛋白质标签技术作为蛋白质功能研究的有力辅助手段,已经被广泛使用,本研究在前期研究基础上选择白念珠菌ORF19.6012为目标蛋白质,为进一步研究该蛋白的作用,利用同源重组的策略将MYC标签添加于目标蛋白质C末端,构建ORF19.6012-MYC菌株。
1 材料和方法
1.1 材料
菌株和质粒 白念珠菌SN152 (基因型为arg4Δ/arg4Δleu2Δ/leu2Δhis1Δ/his1ΔURA3/ura3Δ::imm434IRO1/iro1Δ::imm434),由Suzanne Nobel教授惠赠;含有13×MYC标签和诺尔斯菌素 (nourseothricin, NAT)筛选标记的质粒pSR316-Myc由中国科学院巴斯德研究所陈昌斌教授惠赠;用于构建插入片段的质粒是pFA-Arg4,由Jurgen Wendland教授惠赠。
培养基 YPD培养基:酵母浸膏10 g,蛋白胨20 g,葡萄糖20 g,三蒸水定容至1 L,高温高压灭菌后于4℃保存备用。RPMI 1640培养基:RPMI 1640 10 g,NaHCO32 g,吗啉丙磺酸 (MOPS)34.5 g,调节pH至7.0,三蒸水定容至1 L,0.22 μm微孔滤膜过滤除菌,4℃保存备用。Spider培养基:营养肉汤10 g,甘露醇10 g,磷酸氢二钾2 g,调节pH至7.2,三蒸水定容至1 L,高温高压灭菌后4℃保存备用。LB培养基:胰蛋白胨10 g,酵母浸膏5 g,NaCl 10 g,调节pH至7.0,三蒸水定容至1 L,高温高压灭菌后4℃保存备用。
主要试剂 限制性内切酶BamH I及SacI购自Thermo Fisher;In-Fusion试剂盒、DNA Marker DL2000、DNA Marker DL10000购自Takara,YeaStar Genomic DNA kit购自Zymo research,氨苄西林、质粒小量抽提试剂盒购自生工生物,KOD-Plus购自东洋纺,Yeast Transformation System 2购于Clontech,诺尔斯菌素购自北京中诚瑾念,PVDF膜、Anti-Myc Tag Antibody (05-724)购自Millipore,Goat Anti-Mouse IgG (H&L) IRDye 800CW Conjugated Antibody购自Rockland。
仪器 ABI Veriti 96孔梯度PCR仪,震荡破碎仪,多功能酶标仪,EOVS倒置显微镜,Oddessey近红外成像系统。
1.2 方法
白念珠菌ORF19.6012-MYC融合菌的构建及鉴定 插入片段的构建。pFA-Arg4 (见图1a)用BamH I及SacI双酶切后,得到带有Ampicillin抗性长度为2 466 bp的片段作为连接的载体 (Vector);以SN152基因组DNA为模板,用引物1-F、1-R和3-F、3-R进行PCR得到ORF19.6012基因C末端片段1 (354 bp)及基因下游片段3 (323 bp);以pSR316-Myc为模板,用引物2-F、2-R进行PCR得到带有MYC标签及NAT筛选标记片段2 (4 748 bp)。按照In-Fusion试剂盒操作说明,将三个片段 (1,2,3)及载体 (Vector)与In-Fusion HD Enzyme混合后于50℃孵育15 min,酶连完成后 (见图1b)转染至大肠杆菌中,涂布于Ampicillin平板上,待长出克隆后挑取单克隆提取质粒进行PCR验证,并对阳性克隆进行测序验证。
目的片段同源重组至基因组中。以验证连接正确的质粒为模板,用引物In-Fusion-F、In-Fusion-R进行PCR得到大量含有MYC标签和NAT筛选标记的目的片段。采用醋酸锂转染法将目的片段同源重组到白念珠菌SN152基因组中,使得MYC标签序列添加于ORF19.6012基因ORF的C末端,涂布于诺尔斯菌素 (200 μg/mL)选择性培养基,待长出克隆后挑取单克隆抽提基因组进行PCR验证。
用于菌株构建及鉴定的引物序列见表1。

表1 本研究使用的引物及其序列
提取PCR验证为阳性的单克隆蛋白质进行Western blotting (WB)验证。提取白念珠菌总蛋白后,BCA定量法测定蛋白浓度,取100 μg总蛋白进行SDS-PAGE (80 V,30 min;120 V,1 h),电泳结束后用半干法 (250 mA,1 h)将蛋白质转移至PVDF膜上,5%脱脂奶粉封闭2 h,PBST洗涤3次,4℃孵育Anti-Myc (1∶1 000)抗体过夜,在一抗孵育结束后,PBST洗涤3次,加入Anti-Mouse IgG (1∶10 000)二抗,室温避光孵育2 h,PBST洗涤3次,用Odyssey近红外双色激光成像系统扫膜拍照。
生长曲线 活化菌株,使真菌处于指数生长期后期,用PBS洗涤3次后以YPD培养液稀释并调整菌液浓度至OD630=0.01各5 mL。30℃,200 r/min继续振荡培养,分别于0、2、4、6、8、10、12、16、20、24、30和36 h时间点取样100 μL,用酶标仪测定OD630值,绘制菌株生长曲线。
菌丝诱导实验 活化菌株,使真菌处于指数生长期后期,用PBS洗涤3次后以液体菌丝诱导培养基 (spider、RPMI 1640和YPD+10%FBS)重悬,以1∶1 000稀释至1 mL相应的新鲜培养基中,置于12孔细胞培养板中37℃静置培养3 h,培养结束后用显微镜观察拍照。
2 结 果
2.1 白念珠菌ORF19.6012-MYC融合菌的构建及鉴定
三个PCR片段用In-Fusion试剂盒连接后转化至感受态大肠杆菌,再以LB+Ampicillin (100 μg/mL)选择培养基进行筛选,挑取单克隆菌落提取质粒作为模板,进行PCR验证,结果显示三个片段成功连接至载体质粒中 (见图1c)。
将PCR获得的融合目的片段转染至白念珠菌SN152后 (见图2a),挑取诺尔斯菌素筛选平板上的单克隆,用试剂盒提取基因组DNA进行PCR验证,结果显示目的片段成功转染至白念珠菌基因组内 (见图2b)。
提取PCR验证为阳性的白念珠菌的总蛋白,进行WB验证,结果显示: MYC蛋白标签成功添加至白念珠菌内并稳定表达,ORF19.6012蛋白大小为146 KD,添加于其C末端的13×MYC标签大小为21 KD,所以融合蛋白的大小约为167 KD (见图2c)。
2.2 生长曲线
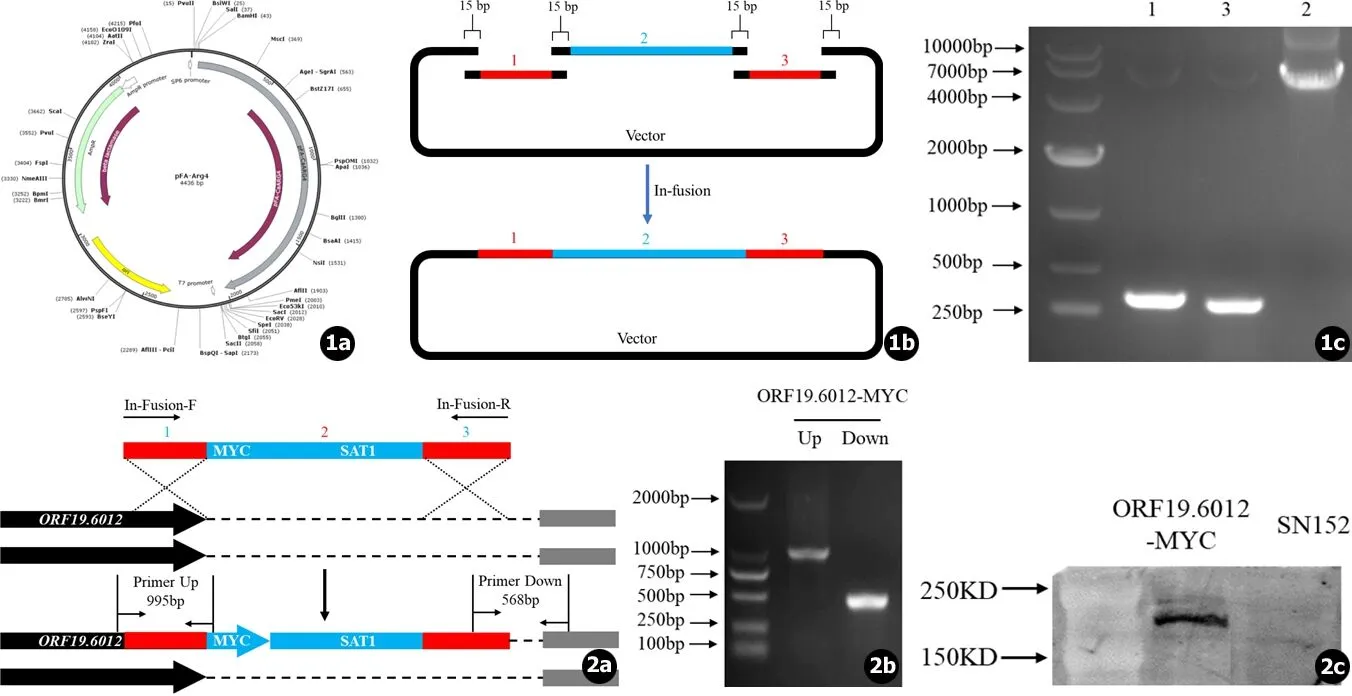
图1插入片段构建示意图及PCR验证结果:a.作为载体 (Vector)使用的pFA-Arg4质粒图谱;b.In-Fusion策略连接三个插入片段示意图;c.PCR验证结果 (1是ORF19.6012基因C末端片段,3是ORF19.6012基因下游片段,2是含MYC标签及SAT1筛选标记片段)图2白念珠菌ORF19.6012-MYC菌株构建示意图及验证结果:a.ORF19.6012-MYC菌株构建及验证引物设计示意图;B.PCR验证结果;C.Western blotting验证结果
Fig.1The construction of the inserted fragment and PCR verification results:a.Map of pFA-Arg4 plasmid;b.Ligation of the three fragments by In-Fusion Kit;c.PCR verification results of the three fragments in the positiveE.colicolony (1 is the C-terminal fragment ofORF19.6012, 3 is the downstream fragment ofORF19.6012, 2 is the fragment containing MYC tag and SAT1 marker)Fig.2ORF19.6012-MYC strain construction and validation results:a.Schematic illustration of ORF19.6012-MYC strain construction and verification primers;b.PCR verification of the positiveC.albicansstrain;c.Western blotting verification result of the positiveC.albicansstrain
亲本菌SN152以及ORF19.6012-MYC菌株时间生长曲线如图3所示:ORF19.6012-MYC与亲本菌SN152生长速度一致,说明添加MYC标签后不会影响菌株正常的生长增殖能力。
2.3 菌丝诱导
亲本菌SN152以及ORF19.6012-MYC菌株液体菌丝诱导的结果如图4所示:SN152及ORF19.6012-MYC在spider、RPMI 1640以及YPD+10%FBS中均能正常形成菌丝,菌丝形成长度适中,且ORF19.6012-MYC菌丝生长情况与SN152相比并无差异,说明添加MYC标签后不会影响菌株的液体菌丝形成能力。
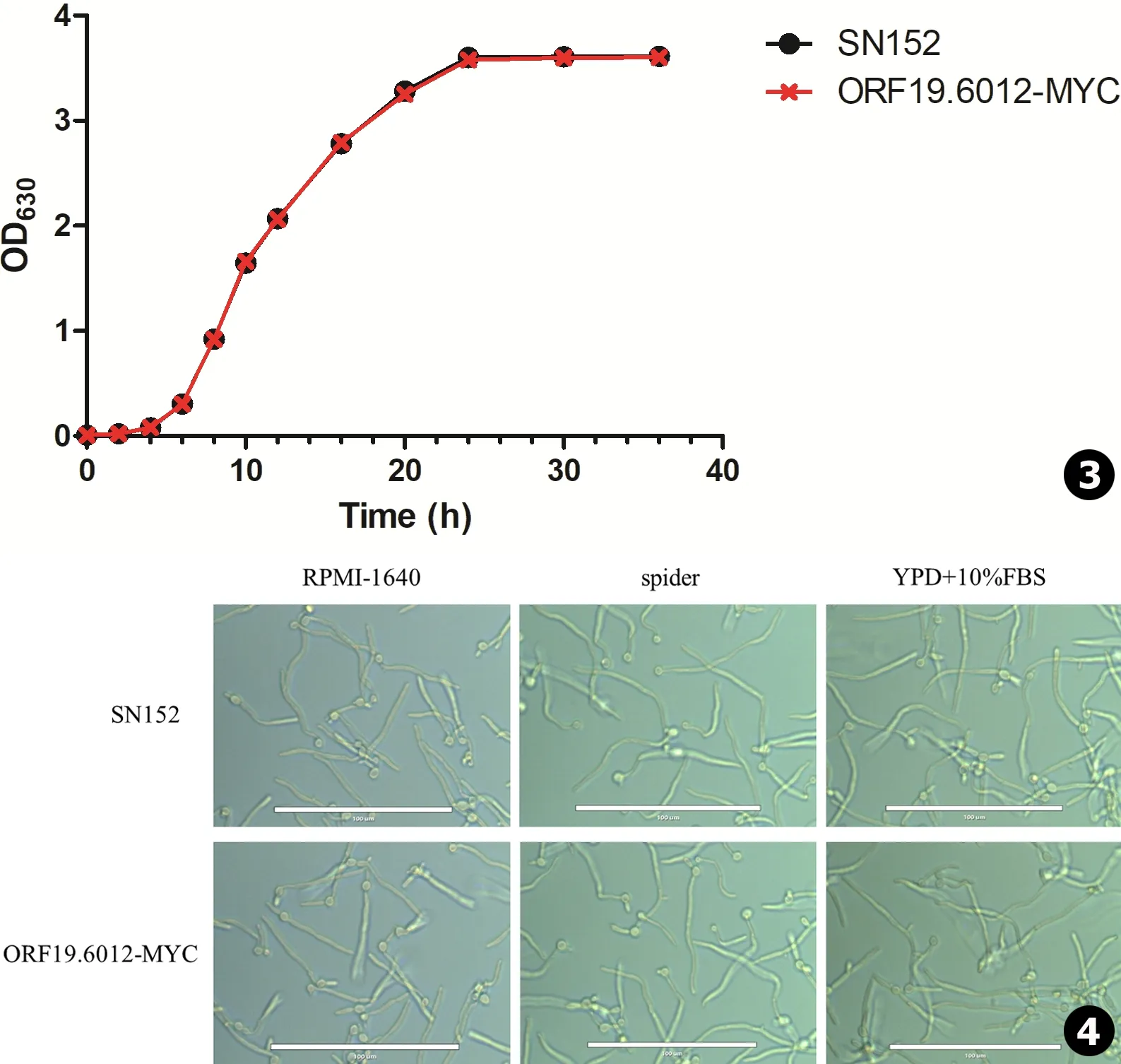
图3添加MYC标签后不影响融合菌株的生长增殖图4添加MYC标签后不影响融合菌株液体菌丝形成能力
Fig.3Addition of MYC tag did not affect growth and proliferation of the strainFig.4Addition of MYC tag did not affect the hyphal formation ability of the strain
3 讨 论
蛋白质标签技术已广泛应用于分子生物学领域,应用范围包括蛋白质的纯化和检测、改变蛋白质溶解性、蛋白质细胞内定位等,常用的蛋白质标签有MYC、HA、His×6、GST以及GFP等[6-7];在此基础上,可以利用酵母双杂交以及免疫共沉淀或者亲和层析技术进一步进行蛋白质相互作用以及分子通路的研究[8]。
本研究中首先利用In-Fusion克隆方法将三个目的片段首尾相连并且连接于载体上,然后以连接正确的质粒为模板,PCR扩增得到大量插入片段,之后用醋酸锂转染法根据同源重组的原理将插入片段导入白念珠菌SN152中,使得MYC标签添加于ORF19.6012的C末端,经过诺尔斯菌素选择性培养基的筛选后,最后经过PCR以及Western blotting验证确定得到蛋白质标签插入正确的菌株。以亲本菌SN152为对照,测定ORF19.6012-MYC融合菌株的生长曲线以及进行液体菌丝诱导实验,考察MYC标签的添加是否会影响菌株基本的生长繁殖以及形态转换能力,结果显示两者之间无明显差异。综上所述,MYC标签添加后,能够连接于目的蛋白的C末端正常表达,并且不改变菌株的基本性质,所构建的菌株可以用于后续蛋白质功能的研究,能够成为分子生物学功能研究的重要技术工具。
本研究利用In-Fusion策略构建标签融合片段,成功构建了蛋白质标签融合菌株,并提供了一种新的稳定的构建标签融合菌株的方法,可为类似研究提供参考和借鉴。
[1] KIM J, SUDBERY P.Candidaalbicans, a major human fungal pathogen[J]. J Microbiol, 2011, 49(2): 171-177.
[2] KULLBERG BJ, ARENDRUP MC. Invasive candidiasis[J]. N Engl J Med, 2015, 373(15): 1445-1456.
[3] MAYER FL, WILSON D, HUBE B.Candidaalbicanspathogenicity mechanisms[J]. Virulence, 2013, 4(2): 119-128.
[4] NAGLIK JR, CHALLACOMBE SJ, HUBE B.Candidaalbicanssecreted aspartyl proteinases in virulence and pathogenesis[J]. Microbiol Mol Biol Rev, 2003, 67(3): 400-428.
[5] DA SILVA DANTAS A, LEE KK, RAZIUNAITE I, et al. Cell biology ofCandidaalbicans-host interactions[J]. Curr Opin Microbiol, 2016, 34: 111-118.
[6] TERPE K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems[J]. Appl Microbiol Biotechnol, 2003, 60(5): 523-533.
[7] ARNAU J, LAURITZEN C, PETERSEN GE, et al. Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins[J]. Protein Expr Purif, 2006, 48(1): 1-13.
[8] PUIG O, CASPARY F, RIGAUT G, et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification[J]. Methods, 2001, 24(3): 218-229.
