抗生素相关脑病:发生机制及处置
2018-05-16龚源
龚源
摘 要 抗生素相关脑病(antibiotic-associated encephalopathy,AAE)是在抗生素治疗过程中发生的一系列神经精神症状,包括头晕、嗜睡、抽搐、昏迷,甚至癫痫或精神病发作等。AAE的发生机制是抗生素直接作用于中枢神经系统,干扰抑制性突触传导,造成中枢兴奋毒性。抗生素也可通过影响抗癫痫药和抗精神病药的吸收、分布、代谢和排泄,干扰治疗效果,诱导癫痫或精神病发作。临床上一旦怀疑AAE,首先要停止抗生素治疗。头颅影像学检查及生化检查有助于排除脑血管意外、低糖血症或电解质紊乱。肝肾功能检查有利于AAE的诊断。对于症状比较严重的患者,除对症治疗外,给予利尿剂或进行血液透析或置换,可有效缓解AAE症状。
关键词 脑病;抗生素;机制;治疗
中图分类号:R595.3 文献标志码:A 文章编号:1006-1533(2018)06-0003-04
Antibiotic-associated encephalopathy: mechanism and treatment
GONG Yuan
(Department of Pharmacy, Jinshan Hospital affiliated to Fudan University, Shanghai 201508, China)
ABSTRACT Antibiotic-associated encephalopathy(AAE) is a series of neuropsychiatric symptoms including dizzyness, drowsy, lethargy, convulsion, coma and onset of epilepsy or psychosis in the treatment of antibiotics. The mechanism of AAE is that the antibiotics directly effect on the central nervous system, interfere in inhibitory synaptic transmission and induce central excitatory toxicity. Antibiotics can also disturb the efficacy during the treatment by interfering in the absorption , distribution, metabolism and excretion of antiepileptic or antipsychotics drugs to induce onset of epileptic or psychotics. Once AAE suspected clinically, the immediate termination of antibiotic therapy should be the initial treat to AAE. The head imaging and biochemical examination can help to exclude the incidence of cerebrovascular accident, hypoglycemia or electrolyte disturbance. The examination of liver and renal function is beneficial to the diagnosis of AAE. Besides symptomatic treatment, diuretics administration or hemodialysis or blood replacement can effectively alleviate symptoms of AAE for patients with serious conditions.
KEY WORDS antibiotic-associated encephalopathy; mechanism; treatment
抗生素相關脑病(antibiotic-associated encephalopathy,AAE)是抗生素使用过程中由于抗生素的直接神经毒性或与其他药物相互作用诱发的一系列神经精神功能障碍[1],临床表现为头晕、反应迟钝、兴奋多语、幻觉等,重者有躁狂、肢体震颤、腱反射亢进、抽搐、昏迷、嗜睡等,甚至诱导癫痫或精神病发作[2]。AAE广泛发生于β-内酰胺类、喹诺酮类、大环内酯类、硝基咪唑类等抗生素的使用中[3-6],属于抗生素药源性疾病。AAE的发生,既有药物本身的因素,也不能忽视患者的个体因素,长期患病、肝肾功能不全易导致抗生素在体内蓄积[7-8];重症感染患者的血脑屏障可能受到一定程度的破坏,药物更易进入中枢,引发毒性反应;部分患者本身即患有神经系统疾病,是AAE的易感因素。
由于重症住院患者大多有数种并发症,AAE往往容易被误诊为原患疾病恶化、脑血管事件,或与其他类型神经精神疾病混淆,是一种比较隐蔽的威胁。本文拟从AAE的临床表现、发生机制、预防和临床处置等方面进行讨论,希望为临床合理使用抗生素提供参考。
1 临床表现
严重AAE的临床表现包括幻觉、妄想、肌阵挛、癫痫发作等症状,小脑功能障碍为甲硝唑相关脑病所特有,主要表现为共济失调或辩距障碍[9],其他种类抗生素罕有该症状的报道。语言功能障碍在AAE中并不多见,但头孢吡肟相关脑病失语症的报道较多[2]。
对于怀疑AAE的患者,头颅影像学检查是必要的,尤其在部分中枢或心血管疾病患者中,影像学检查有助于神经系统器质性疾患,如脑血管意外的鉴别诊断。AAE患者的头颅CT或磁共振成像(MRI)检查可无异常表现[10],也可有脑萎缩、白质变性或腔隙性梗死等变化[11],脑电图检查可见低频波增多[12]。
生化检查对于AAE的判断不可缺少,尽管抗生素或相关药物的血药浓度检查是AAE最直观的标准,但多数医疗机构缺乏相关检查能力。建议对怀疑AAE的患者行常规血糖、电解质、血红蛋白、肝功能、肾功能等检查,尤其是后两者有助于判断肝肾功能,对于肝肾功能不全或急剧下降患者,AAE的发生风险显著增加,而血糖、电解质检查有助于排除因低血糖、电解质紊乱诱发的症状[11]。
2 发生机制
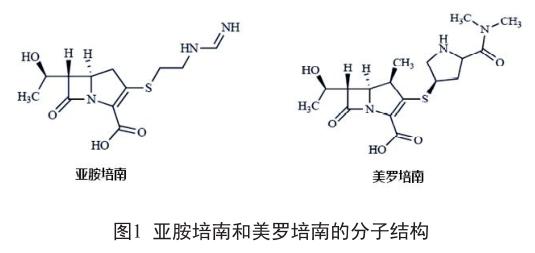
目前认为AAE的发生与中枢神经系统多种受体功能有关,涉及γ-氨基丁酸(γ-aminobutyric acid,GABA)受体、谷氨酸受体、多巴胺受体等。GABAA型受体(GABAAR)激活触发氯离子细胞内流,产生抑制性突触后电位,调控兴奋性突触传导。β-内酰胺类可通过非竞争性(青霉素类)或竞争性(头孢菌素类)结合GABAAR干扰该机制[13-14]。在动物实验中,直接在大脑皮质给予青霉素,可降低抑制性突触后电位,导致兴奋性神经元活动增加[15]。β-内酰胺类的GABAAR神经毒性可能与药物结构相关,β-内酰胺酶破坏β-内酰胺环后,其神经兴奋毒性也随之消失。化学结构不同的β-内酰胺类药物的神经毒性也不尽相同,如亚胺培南C2位置上的侧链含亚胺基结构,可能是其比美罗培南神经兴奋毒性更强的原因[16],见图1。
喹诺酮类药物可阻断GABAR介导的抑制性突触传导,增加中枢神经兴奋性。有研究发现,在小鼠大脑直接注射不同剂量氧氟沙星或其左旋异构体——左氧氟沙星,可诱发惊厥,当与GABAR抑制剂4-联苯基乙酸联用时,对GABA門控氯离子电流的抑制作用增强,从而显著增加了惊厥的发生概率[17],针对环丙沙星的研究结果也相似[18]。GABAR功能与多种其他受体功能密切相关,与谷氨酸受体共同调节细胞离子电流,N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体是离子型谷氨酸受体的一种亚型。有报道给予离体大鼠海马切片以0.5或4 μmol/L的喹诺酮类药物(与喹诺酮类的治疗血药浓度相当),可增加神经元的兴奋幅度,而这种变化可被NMDA受体的选择性拮抗剂AP-5、AP-7所阻断[19]。喹诺酮类与多巴胺受体作用的研究更为有限,目前仅有少数个案报道,使用氧氟沙星、斯帕沙星导致抽动秽语样反应,而该类反应一般认为由多巴胺系统介导[20-21],对其机制尚缺乏深入研究。
大环内酯类抗生素的神经系统毒性报道较β-内酰胺类、喹诺酮类为少,罗红霉素、克拉霉素、阿奇霉素神经系统不良反应均有报道[22-23],而对其发生机制目前缺乏研究。有学者认为克拉霉素的神经系统不良反应与其脂溶性代谢产物14-羟基克拉霉素有关,可能涉及了GABA、谷氨酸受体功能[24-26]。
甲硝唑引起的神经系统不良反应常表现为小脑综合征、癫痫发作、自主神经病变[27]、震颤、共济失调、运动障碍, MRI可发现异常[28-29]。甲硝唑引起AAE的机制目前缺乏比较深入的研究。有动物研究发现,甲硝唑连续给药导致实验犬累积中毒,给予地西泮可显著促进甲硝唑导致的中枢神经反应缓解。考虑到地西泮对GABAA受体的激动作用,甲硝唑引起的脑病机制可能与小脑的GABAA受体有关[30]。
除直接作用于中枢神经系统,抗生素与某些药物的相互作用也是AAE发生的潜在机制。临床常用的多种抗生素可诱导或抑制肝药酶CYP450的活性。大环内酯类经CYP3A4代谢的产物与CYP3A4形成共价结合,导致CYP3A4失活;抗真菌药酮康唑、氟康唑、伏立康唑、特比萘芬都是肝药酶抑制剂。
当患者本身伴有神经精神疾病,正在进行药物治疗时,使用不合适的抗生素可间接影响抗癫痫药、抗精神病药等的代谢,导致癫痫或精神分裂发作。大环内酯类抗生素克拉霉素、红霉素与抗癫痫药卡马西平联用,可抑制卡马西平代谢,导致卡马西平血药浓度升高,诱发卡马西平中毒,表现为头晕、嗜睡、视物模糊、语言不清[31]。碳青霉稀类与丙戊酸联用能显著降低丙戊酸的血药浓度,从而导致患者癫痫发作,其机制包括影响丙戊酸肝肠循环,干扰丙戊酸在血液内的分布,干扰丙戊酸在肝脏的代谢以及在肾脏的排泄[32]。红霉素、克拉霉素、诺氟沙星等抑制CYP3A4,氟喹诺酮类抑制CYP1A2,均会升高抗精神病药氯氮平的血药浓度,导致神志不清、激惹等精神病症状[33-34]。抗结核药利福平是CYP2C9、2C16、3A4诱导剂,诱导多种抗精神病药物的代谢,使用氯氮平、利培酮、喹硫平控制精神病的患者,联合应用利福平可显著增加抗精神病药物的代谢,导致精神病发作[35]。
3 AAE的预防
分析已有的大量案例,AAE常发生在伴有慢性肝肾功能不全的患者[8,12],以β-内酰胺类抗生素报道最多,该类抗生素在正常机体内大部分以原型从肾脏排泄,尿毒症患者体内药物排泄速率减慢,血浆半衰期延长,如按正常剂量给药,药物在体内蓄积浓度越来越高,发生药物不良反应概率大大增加,而且慢性肾功能不全或尿毒症患者的血浆蛋白水平较低,抗生素的血浆蛋白结合降低,游离型增多,再加上该类患者血脑屏障及细胞膜通透性异常,药物易在中枢神经系统蓄积。需要注意的是,某些肝肾双通道清除的β-内酰胺类也有AAE的报道,提醒医务工作者临床用药的复杂性[36]。
因此,对于肝肾功能不全、老年、长期患病身体功能较差的患者,选择合适的抗生素种类、剂量和疗程,加强肝肾功能监护,是预防AAE发生的重要方法;对于患癫痫或精神病正在用药控制的患者,如因病情特殊无法更换抗生素品种,进行抗癫痫药或抗精神病药的血药浓度监测,也是预防AAE的必要途径。
4 临床处置
影像学检查:虽然,MRI或脑电图检查并不能帮助确诊AAE,但对于发生脑病的患者,影像学检查可排除癫痫、精神病发作等神经精神疾病,以及脑卒中等脑血管事件。
停藥或调整剂量:一旦怀疑为AAE,停药是首要的处置措施,症状在停药后一般可逆转,即使患者原有的感染仍未得到充分控制,机体累积的抗生素仍可发挥抗感染效果,随着抗生素的逐渐清除,AAE症状消退,结合感染程度,换用其他种类抗生素或原用抗生素调整剂量继续抗感染治疗是可行的[37]。
利尿剂:对于病情严重的患者,需给予利尿剂促进药物清除,保持尿路通畅,在病情允许下,鼓励患者多饮水,多排尿,达到生理性冲洗的目的[38]。
透析:对伴有中重度肾功能不全的患者给予血液透析,对于已在进行维持性透析的尿毒症患者加强透析,可较快缓解AAE症状,阻止病情恶化。此外,目前含舒巴坦的复方制剂使用广泛,舒巴坦的血浆蛋白结合率为80%~90%,80%以上经肾脏排泄,血液透析难以清除,对于由其诱发的严重AAE患者,可能需要血液置换[12]。
对症处理:给予抗癫痫药丙戊酸钠或镇静催眠药地西泮等缓解症状[11]。
参考文献
[1] Grill MF, Maganti RK. Neurotoxic effects associated with antibiotic use: management considerations[J]. Br J Clin Pharmacol, 2011, 72(3): 381-393.
[2] Bhattacharyya S, Darby RR, Raibagkar P, et al. Antibioticassociated encephalopathy[J]. Neurology, 2016, 87(11): 1188-1189.
[3] 金嘉慧, 孙艺宁, 孙玉冰, 等. 青霉素脑病1例报告[J]. 中风与神经疾病, 2015, 32(2): 183.
[4] 李建华, 赵世军, 殷玉水, 等. 头孢拉定致头孢脑病[J]. 药物不良反应杂志, 2001, 3(1): 9.
[5] 刘桂萍, 张国领, 冯慧, 等. 阿奇霉素用量过大致婴儿脑瘫分析[EB/OL]. [2011-10-13]. (2018-02-02). http:// journal.9med.net/html/qikan/lcyx/zhxdlcyxzz/2011898/ ywylc/20111014093902424_559873.html.
[6] 吴妍雯, 胡振红, 郭珩. 盐酸莫西沙星致癫痫发作2例[J].药物流行病学杂志, 2010, 19(10): 592-593.
[7] 李新伦, 李晓梅, 黄进, 等. 维持性血液透析患者头孢菌素脑病7例临床分析[J]. 药物流行病学杂志, 2014, 23(12): 734-736.
[8] 周兰. 尿毒症患者应用左氧氟沙星并发脑病15例分析[J].临床肾脏病杂志, 2009, 9(10): 254.
[9] Agarwal A, Kanekar S , Sabat S , et al. Metronidazoleinduced cerebellar toxicity[J]. Neurol Int, 2016, 8(1):6365-6367.
[10] 吴慧芳, 马兰. 抗生素脑病临床治疗探讨[J]. 长江大学学报:自科版, 2010, 07(3): 31-32.
[11] 缪世梅, 徐学康, 钱桐荪. 尿毒症患者并发抗生素脑病10例[J]. 临床荟萃, 2006, 21(19): 1419-1420.
[12] 薛兰芬, 张国欣. 尿毒症患者抗生素脑病35例临床分析[J]. 疑难病杂志, 2008, 7(3): 169-170.
[13] Lindquist C, Dalziel JE, Cromer BA , et al. Penicillin blocks human alpha 1 beta 1 and alpha 1 beta 1 gamma 2S GABAA channels that open spontaneously[J]. European J Pharmacol,2004, 496(1-3): 23-32.
[14] Sugimoto M, Fukami S, Kayakiri H, et al. The betalactam antibiotics, penicillin-G and cefoselis have different mechanisms and sites of action at GABA(A) receptors[J]. Br J Pharmacol, 2002, 135(2): 427-432.
[15] Davidoff RA. Penicillin and inhibition in the cat spinal cord[J]. Brain Res, 1972, 45(2): 638-642.
[16] Sunagawa M, Matsumura H, Sumita Y, et al. Structural features resulting in convulsive activity of carbapenem compounds: effect of C-2 side chain[J]. J Antibiot(Tokyo),,1995, 48(5): 408-416.
[17] Akahane K, Tsutomi Y, Kimura Y, et al. Levofloxacin, an optical isomer of ofloxacin, has attenuated epileptogenic activity in mice and inhibitory potency in GABA receptor binding[J]. Chemotherapy, 1994, 40(6): 412-427.
[18] Marchand S, Pariat C, Bouquet S, et al. Pharmacokineticpharmacodynamic modelling of the convulsant interaction between norfloxacin and biphenyl acetic acid in rats[J]. Br J Pharmacol, 2000, 129(8): 1609-1616.
[19] Schmuck G, Schürmann A, Schlüter G. Determination of the excitatory potencies of fluoroquinolones in the central nervous system by an in vitro model[J]. Antimicrob Agents Chemother 1998, 42(7): 1831-1836.
[20] Brar KS, Kumar V, Johri S. Association of a Tourettelike Syndrome with Sparfloxacin[J]. Med J Armed Forces India, 2006, 62(4): 381-382.
[21] Thomas RJ, Reagan DR. Association of a Tourette-like syndrome with ofloxacin[J]. Ann Pharmacother, 1996, 30(2): 138-141.
[22] 成咏. 罗红霉素、克拉霉素及阿奇霉素药物的不良反应分析[J]. 临床合理用药杂志, 2015, 8(3A): 130-131.
[23] 金跃, 施玲玲, 陈素芹, 等. 国内罗红霉素、克拉霉素、阿奇霉素药物不良反应回顾性分析[J]. 中国新药与临床杂志, 2006, 25(8): 590-595.
[24] Prime K, French P. Neuropsychiatric reaction induced by clarithromycin in a patient on highly active antiretroviral therapy (HAART)[J]. Sex Transm Infect, 2001, 77(4): 297-298.
[25] Abouesh A, Stone C, Hobbs WR. Antimicrobial-induced mania (antibiomania): a review of spontaneous reports[J]. J Clin Psychopharmacol, 2002, 22(1): 71-81.
[26] Ozsoylar G, Sayin A, Bolay H. Clarithromycin monotherapyinduced delirium[J]. J Antimicrob Chemother, 2007, 59(2): 331.
[27] Woodruff BK, Wijdicks EF, Marshall WF. Reversible metronidazole-induced lesions of the cerebellar dentate nuclei[J]. N Engl J Med, 2002, 346(1): 68-69.
[28] Kumari P, Porwal YC, Arora A, et al. Metronidazole induced neurotoxicity in a case of liver abscess[J]. Int J Hepatobiliary Pancreat Dis, 2016, 6(2): 96-99.
[29] Yamamoto T, Abe K, Anjiki H, et al. Metronidazole-Induced Neurotoxicity Developed in Liver Cirrhosis[J]. Journal of Clinical Medicine Research, 2012, 4(4): 295-298.
[30] Evans J, Levesque D, Knowles K, et al. Diazepam as a treatment for metronidazole toxicosis in dogs: a retrospective study of 21 cases[J]. J Vet Intern Med, 2003, 17(3): 304-310.
[31] 鄭国雄, 张寄青. 红霉素诱发卡马西平毒性反应1例报告[J]. 中国实用儿科杂志, 1996, 11(3): 185-185.
[32] 刘晓东, 刘美, 何晓静. 丙戊酸和碳青霉烯类抗菌药的相互作用研究进展[J]. 中国药学杂志, 2015, 50(3): 201-204.
[33] 汪志良, 寻知元. 氯氮平药物相互作用研究新进展[J]. 中华精神科杂志, 2012, 45(1): 55-58.
[34] Kendall J, Papich MG. Ciprofloxacin/clozapine/smoking interaction: Confusion, irritability and myocarditis: case report[J]. Am J Vet Res, 2004, 76(5): 454-459.
[35] Parker C. Prescribing clozapine and rifampicin: clinical impact of their interaction[J]. B J Psych Bull, 2016, 40(3): 153-155.
[36] 罗承志. 抗菌药物致抗生素脑病7例分析[J]. 现代医药卫生, 2007, 23(10): 1514.
[37] 李娟, 郭志勇, 梅小斌, 等. 慢性肾脏病并发抗生素脑病的防治分析[J]. 中国全科医学, 2011, 14(11): 1237-1239.
[38] 徐深秋, 邵长山. 急性梗阻性肾衰抗生素脑病诊治体会并相关文献复习[J]. 数理医药学杂志, 2017, 30(3): 453-454.
