莫西沙星对脂多糖诱导小鼠腹腔巨噬细胞炎性反应的影响
2018-05-16刘雅琴张秀冰李美欣袁红霞邱振宇
李 娜,刘雅琴,张秀冰,李美欣,袁红霞,邱振宇*
(1.锦州医科大学第一临床学院 临床医学系, 辽宁 锦州 121001;2.锦州医科大学附属第一医院感染性疾病科,辽宁 锦州 121001)
巨噬细胞(macrophage,Mφ)是脓毒症中机体的第一道防线[1]。Mφ上的Toll样受体- 4(toll- like receptors- 4,TLR4)为脂多糖(LPS)刺激的主要受体[2],可通过一系列反应激活核因子 (nuclear factor-κB,NF-κB)信号传导通路[3]。近年发现鞘氨醇激酶1(sphingosine-1-phosphate,SPHK1)参与其中的多个环节,并起到关键的调节作用[4]。故目前认为TLR4及SPHK1可能是脓毒症休克和多器官功能衰竭等疾病发生发展的关键因子。
某些喹诺酮类(quinolones,QNs)具有免疫调节活性[5]。莫西沙星(moxifloxacin,MXF)为四代喹诺酮,目前认为其对免疫系统有激活与抑制的双向调节作用[6],而对其在巨噬细胞炎性反应的影响研究较少。
故本实验拟采用不同浓度MXF对LPS刺激下的小鼠腹腔巨噬细胞进行作用,观察其对TLR4、SPHK1、NF-κBmRNA和蛋白的表达水平,及细胞上清液TNF-α和IL- 1的分泌水平的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SPF级昆明小鼠,雄性,6~8 周龄,体质量(18 ± 0.5) g,锦州医科大学实验动物中心提供[SCXK(辽)2014- 0004]。每只小鼠笼中放喂3只,实验前饥饿3 d。
1.1.2 主要试剂:1640培养基(Gibco公司);胎牛血清(Hyclone公司);TLR4和NF-κB p65(博奥森生物有限公司);SPHK1(Abgent公司);盐酸莫西沙星标准品(拜耳公司);Super M-MLV反转录酶、高纯总RNA快速提取试剂盒(BioTeke公司);RNase固相清除剂(北京天恩泽基因科技有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);TNF-α和IL- 1ELISA试剂盒(云克隆生物科技有限公司)。
1.2 方法
1.2.1 巨噬细胞的分离与纯化及培养:按参考文献[7]报道的方法,提取、分离培养及纯化小鼠腹腔巨噬细胞后,再加入RPMI1640 完全培养基置37 ℃、5%CO2培养箱中继续培养24 h。施加处理因素。
1.2.2 实验分组及给药方法:实验分6组:A组:对照组;B组:500 ng/mL LPS 处理组;C、D、E及F组:分别用8、16、32、64 mg/L MXF 干预组。
将细胞接种于6孔板中和铺有细胞爬片的12孔培养板中,每孔细胞量均为2×105个。将各组细胞置于37 ℃、5% CO2的培养箱内培养2 h。收集6孔板中各组细胞进行基因和蛋白的相关指标检测。12孔板中各组细胞4%多聚甲醛固定20 min,免疫荧光相关指标检测。
1.2.3 Real-time PCR检测TLR4、SPHK1、NF-κB p65的mRNA表达:方法按说明书处理,引物信息如表1。
以参照基因为标准进行相对定量,即Livak法,表达比率=2-△△Ct。△△Ct=(实验组目的基因CT-内参CT)-(对照组目的基因CT-内参CT)。
1.2.4 Western blot检测TLR4、SPHK1的蛋白水平:具体操作按说明书,各组巨噬细胞在LPS刺激后24 h收上清。
1.2.5 ELISA试剂盒检测TNF-α、IL- 1的表达:具体操作按说明书。
1.3 统计学分析


表1 引物设计序列Table 1 Primer sequence
F.forword; R.reverse.
2 结果
2.1 小鼠腹腔巨噬细胞的培养和鉴定
接种小鼠腹腔细胞4 h后巨噬细胞贴壁。分别于4、8、12和24 h后倒置显微镜下可见细胞主要为圆形或椭圆形,折光度好。应用LPS刺激24 h即可见很多细胞出现明显的伪足或变为梭形(图1,2)。

图1 正常培养巨噬细胞Fig 1 Normal culture macrophages (×100)

图2 LPS刺激24 h巨噬细胞Fig 2 Macrophage induced by LPS for 24 h ours(×100)
2.2 Real-time PCR检测TLR4、SPHK1、NF-κB p65 mRNA表达
正常小鼠腹腔巨噬细胞表达TLR4、SPHK1和NF-κB mRNA的量均较低,LPS刺激后TLR4、SPHK1、NF-κB mRNA表达明显升高(P<0.001)。和LPS组比较16 mg/L MXF干预组上述指标明显回降(P<0.001), 而32和64 mg/L MXF组上述指标较LPS组进一步升高(P<0.001;P<0.05)(图3)。
2.3 Western blot法检测不同浓度MXF作用后LPS刺激下巨噬细胞内TLR4、SPHK1和NF-κB的表达
与对照组相比,LPS组及MXF+LPS组巨噬细胞TLR4、SHPK1、NF-κB蛋白表达明显增加(P<0.0001)。和LPS组比较MXF 8、16 mg/L组的TLR4、SHPK1蛋白表达显著降低(分别为P<0.01,P<0.0001),和LPS组比较MXF 8、16 mg/L的NF-κB蛋白表达显著降低(P<0.01,P<0.001),MXF 64 mg/L组NF-κB蛋白表达高于LPS组(P<0.01)。MXF 16 mg/L组对3种蛋白表达的抑制最明显,与其他MXF组比较有显著性差异(P<0.001,P<0.01)。
2.4 ELISA检测细胞因子
与对照组相比,LPS组及C、D、E、F组巨噬细胞TNF-α、IL- 1分泌明显增加(P<0.001)。和LPS组比较MXF 16 mg/L的TNF-α、IL- 1分泌显著受抑制(P<0.01)。
3 讨论
巨噬细胞是机体固有免疫的重要执行者, 在机体抗感染中处于第一道防线。巨噬细胞表面TLR4 是主要的 LPS 识别受体[8]。TLR4激活后通过一系列级联反应,最终使NF-κB 等活化。SPHK是一种鞘磷脂代谢酶,其中SPHK1及其产物S1P广泛涉炎性介质反应及免疫细胞的功能。研究发现,细胞外的LPS和细菌脂蛋白(bacterial lipoproteins,BLP)显著上调SPHK1的表达[4]。SPHK1通过第二信使S1P的作用,参与TLR4信号传导途径,活化3-磷酸肌醇激酶(phosphoinositide3-kinase,PI3K)/AKT和NF-κB等信号传导[9- 10],NF-κB 激活后启动免疫和炎性反应相关基因的转录,导致炎性过程升级失控表达大量炎性因子如 TNF-α、IL- 1、IL- 6、IL- 8及黏附分子等[11],参与内毒素血症、休克和多器官功能性衰竭的发生[12- 13]。

*P<0.000 1 compared with control group;◆P<0.05,▲P<0.001,#P<0.0001 compared with LPS group图3 各组TLR4、SPHK1、NF-κB mRNA的表达Fig 3 TLR4, SPHK1, NF-kappa B mRNA

groupTLR4 SHPK1 NF-κB control0.42±0.020.32±0.010.29±0.02LPS1.77±0.11*1.12±0.05*1.02±0.06*8mgMXF+LPS1.21±0.11*▲0.88±0.03*▲0.83±0.01*▲16mgMXF+LPS0.75±0.03*▲0.87±0.02*▲0.57±0.03*▲32mgMXF+LPS1.28±0.09*▲1.08±0.03*0.90±0.07*64mgMXF+LPS1.81±0.17*1.50±0.04*▲1.31±0.09*▲
*P<0.000 1 compared with control group;▲P<0.01 compared with LPS group.
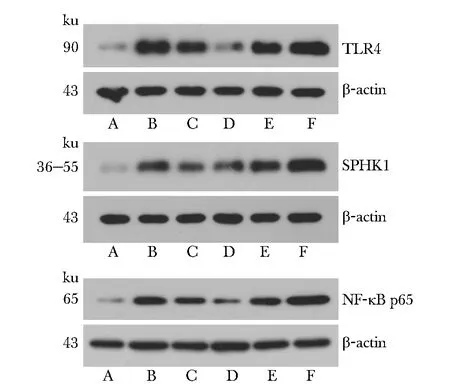
A.control; B.LPS; C.MKF 8 mg/L; D.MXF 16 mg/L; E.MXF 32 mg/L; F.MXF 64 mg/L图4 各组TLR4、SHPK1和NF-κB蛋白的表达Fig 4 Protein expression of TLR4, SHPK1,NF-κB

groupTNF-αIL-1control20.9±7.6#29.0±9.6#LPS398.0±15.0*168.9±8.6*8mgMXF+LPS329.2±23.3*#121.3±7.3*#16mgMXF+LPS160.8±25.0*#78.8±10.5*#32mgMXF+LPS423.1±37.1*173.2±12.7*64mgMXF+LPS509.8±21.3*#220.3±9.6*#
*P<0.000 1 compared with control group;#BHP<0.01 compared with LPS group.
理论上推断QNs类抗菌药作用于转录因子的方式是药物可能直接作用于细胞膜、细胞受体或真核细胞的核或各种传导通路中的激酶。研究表明,QNs可以提高致死性脂多糖所造的严重脓毒症模型小鼠的生存率。药物结构分析认为某些QNs喹啉环N1位上连接的环丙烷是调节细胞因子的合成活性基团[14]。MXF、环丙沙星、加替沙星、司帕沙星等均有该结构,在治疗剂量就能影响TNF-α、IL- 1、IL- 6 和趋化因子等细胞因子的合成,有抑制促炎细胞因子的作用。Purswani等研究表明,MXF能够通过下调TNF-α或IL- 12,或通过上调IL- 10,调节肺泡巨噬细胞和外周血单核细胞的炎性反应[14]。 但目前很少有证据说明药物可以直接与相应细胞受体(如TLR4)发生作用或直接作用于各种激酶。
在本实验中,不同浓度MXF作用细胞后,对TLR4和SPHK1的表达有不同的影响,在低中等浓度(16 mg/L)时对TLR4和SPHK1的表达有明显抑制作用,而在高浓度(32 mg/L)时则对其表达影响不大,当浓度达到更高(64 mg/L)时对TLR4、SPHK1的表达有一定的刺激作用,对细胞分泌促炎因子TNF-α、IL- 6的影响也是同样,与报道MXF有双向免疫调节作用相符[15]。抗菌药在临床的应用十分广泛,随着对抗菌药物的免疫调节作用研究的不断深入,如果抗菌药不仅限于抗菌治疗,还能有助于重症感染性疾病免疫功能的改善,在临床上将起到事半功倍的效果。
参考文献:
[1] Gordon S. The macrophage: past, present and future[J]. Eur J Immunol,2007, 37 Suppl 1: S9- 17.
[2] Zou H, Wang WK, Liu YL,etal. Toll-like receptors in hepatocellular carcinoma: potential novel targets for pharmacological intervention[J]. Expert Opin Ther Targets, 2016, 20:1127- 1136.
[3] Brubaker SW, Bonham KS, Zanoni I,etal. Innate immune pattern recognition: a cell biological perspective[J]. Ann Rev Immunol,2015,33: 257- 290.
[4] Puneet P, Yap CT, Wong L,etal. SphK1 regulates proinflammatory responses associated with endotoxin and polymicrobial sepsis[J]. Science,2010,328: 1290- 1294.
[5] Badal S, Her YF, Maher LJ,etal. Nonantibiotic effects of fluoroquinolones in mammalian cells[J].J Biol Chem, 2015,290: 22287- 22297.
[6] Shukla P, Verma AK, Dwivedi P,etal. Moxifloxacin-loaded nanoemulsions having tocopheryl succinate as the integral component improves pharmacokinetics and enha-nces survival inE.coli-induced complicated intra-abdominal infection[J].Mol Pharm,2014,11:4314- 4326.
[7] 范仕郡, 刘鑫, 黄敏,等. 小鼠腹腔巨噬细胞的快速提取及培养[J]. 局解手术学杂志, 2015:130- 131.
[8] Pahwa R, Devaraj S, Jialal I. The effect of the accessory proteins, soluble CD14 and lipopolysaccharide-binding protein on Toll-like receptor 4 activity in human monocytes and adipocytes[J]. Int J obesity, 2016, 40:907- 911.
[9] Tao T, Zhao Y, Qian H,etal. n- 3 Polyunsaturated fatty acids improve inflammation via inhibiting sphingosine kinase 1 in a rat model of parenteral nutrition and CLP-induced sepsis[J]. Lipids, 2016, 51:271- 278.
[10] Sanllehí P, Abad JL, Casas J,etal. Inhibitors of sphingosine- 1-phosphate metabolism (sphingosine kinases and sphingosine-1-phosphate lyase)[J]. Chem Phy Lipids, 2015, 197:69- 81.
[11] Zhao H, Zheng Q, Hu X,etal. Betulin attenuates kidney injury in septic rats through inhibiting TLR4/NF-κB signaling pathway[J]. Life Sci, 2015, 144:185- 193.
[12] Lee AS, Jin Jung YU, Thanh TN,etal. Paricalcitol attenuates lipopolysaccharide-induced myocardial inflamma-tion by regulating the NF-κB signaling pathway[J]. Int J of Mol Med, 2016, 37:1023- 1029.
[13] Cardenas H, Arango D, Nicholas C,etal. Dietary apig-enin exerts immune-regulatory activityin vivoby reducing NF-κB activity, halting leukocyte infiltration and restoring normal metabolic function[J]. Int J Mol Sci, 2016, 17:323- 340.
[14] Purswani MU, Eckert SJ, Arora HK,etal. Effect of ciprofloxacin on lethal and sublethal challenge with endotoxin and on early cytokine responses in a murine in vivo model[J]. J Antimicrob Chemother, 2002, 50:51- 58.
[15] Kim A, Lim KS, Lee H,etal. A thorough QT study to evaluate the QTc prolongation potential of two neuropsychiatric drugs, quetiapine and escitalopram, in healthy volunteers[J]. Int Clin Psychopharmacol, 2016, 31:210- 217.
