Zika病毒NS3具有依赖于ATP水解的dsDNA解链活性
2018-05-16王蕾杰
徐 杉,王蕾杰,石 磊
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京100005)
Zika病毒为黄病毒属、单股正链的RNA病毒。近几年,Zika病毒的爆发严重危害了人类健康。研究发现,孕妇感染Zika病毒与新生儿小头症的发病率升高密切相关[1]。此外,Zika病毒会损害小鼠睾丸的发育[2],从而影响生殖系统。因此,Zika病毒成为威胁人类健康的重大挑战。Zika病毒侵入细胞后,其基因组RNA通过翻译产生3种结构蛋白(C蛋白、prM蛋白和E蛋白)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[3]。结构蛋白作为病毒结构的组成部分,参与病毒组装;非结构蛋白的协调作用在病毒蛋白成熟、基因组复制及病毒组装中起着重要作用。
Zika病毒进入细胞后,病毒基因组(+)RNA首先在NS5 RNA聚合酶的作用下复制形成双链RNA,该双链RNA随后被NS3解旋形成单链,NS5以(-)RNA为模板继续进行复制,产生(+)RNA[4]。因此,研究Zika病毒NS3的ATP水解和核酸解链功能有助于阐明病毒复制机制,为抑制Zika病毒感染提供新的药物设计思路。
1 材料与方法
1.1 材料
1.1.1 菌株:trans5α感受态细胞(全式金生物技术公司);BL21感受态细胞(自制)。
1.1.2 试剂:卡那霉素、IPTG、DTT和ATP(Amresco公司);RNaseA(TaKaRa公司);DNaseI(北京瑞达恒辉科技发展有限公司);His抗体(EMAR公司);ATPase检测试剂盒(Bioassay Systems公司);合成标记的DNA(cy3-GCGTCTTTACGGTGCTTAAAACAAA ACAAAACAAAACAAAA和AGCACCGTAAAGACG C-BHQ2)(梓熙生物技术有限公司);PCR引物(北京擎科生物科技有限公司);quick-change体系(Phanta公司);质粒小提试剂盒和胶回收试剂盒(天根生化科技有限公司);限制性内切酶、CIP和T4 DNA连接酶(NEB公司);Ni琼脂糖珠子(Qiagen公司)。
1.2 方法
1.2.1 Zika NS3表达载体的构建:50 μL PCR体系:模板100 ng,10 μmol/L引物1.5 μL,DNA聚合酶1 μL,dNTPs 4 μL,5×缓冲液10 μL,ddH2O补齐体积。NS3引物序列:上游为5′-CGGAATTCGGTGGC AGCGAGAACTTGTATTTCCAGGGAGGTGGTAGTGGA GCTCTATGGGATGTGC-3′,下游为5′-CCGCTCGAGT TACAGATCCTCTTCAGAGATGAGTTTCTGCTCTCTTT TCCCAGCGGCA-3′。PCR扩增程序为:95 ℃变性4 min,1个循环;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃继续延伸5 min,1个循环。反应结束后,PCR产物利用胶回收试剂盒回收。回收的产物与pET-28a载体均用EcoRⅠ和XhoⅠ双酶切过夜。载体酶切后加入1 μL CIP酶,置于37 ℃消化1 h,然后进行电泳及胶回收;PCR产物酶切后直接回收。回收后的载体和片段利用T4 DNA连接酶进行连接。连接产物转化trans5α感受态中,挑取单克隆菌落接菌,提取质粒后测序。
1.2.2 NS3蛋白诱导表达:将NS3表达载体转入BL21,挑取单克隆菌落于5 mL LB培养基中培养,过夜后转入1 L LB中,培养至OD600=1,加入终浓度为0.4 mmol/L 的IPTG。然后将菌置于16 ℃,150 r/min条件下继续培养24 h。诱导结束后,6 000 r/min,离心10 min收集菌体,-20 ℃保存。
1.2.3 NS3蛋白纯化:使用30 mL裂解缓冲液(500 mmol/L NaCl,20 mmol/L Tris-HCl pH 8.0,0.5% Triton X- 100,20 mg/L RNaseA,20 mg/L DNaseI,10%甘油,1 mmol/L DTT,2 mmol/L PMSF,1 mg/L leupeptin,1 mg/L pepstatin,1 mg/L aprotinin)重悬菌体。冰上超声裂解,总功率200 W,超声5 s,停7 s,共超声20 min。超声结束后,4 ℃18 000 r/min离心45 min。取上清,加入Ni琼脂糖珠子,4 ℃结合4 h后,离心后弃上清,将珠子转移至柱子中,用含30 mmol/L咪唑的洗涤缓冲液(500 mmol/L NaCl,20 mmol/L Tris-HCl pH 8.0,0.4 mmol/L DTT,30 mmol/L咪唑)洗2次,再用含60 mmol/L咪唑的洗涤缓冲液洗2次,然后加入洗脱缓冲液(500 mmol/L NaCl,20 mmol/L Tris-HCl pH 8.0,10%甘油,500 mmol/L咪唑,1 mmol/L DTT)洗脱。最后,蛋白用2 L透析缓冲液(100 mmol/L NaCl,20 mmol/L Tris-HCl pH 8.0,10%甘油,1 mmol/L DTT)透析过夜。
1.2.4 ATPase活性检测:使用无色透明96孔板,参照试剂盒说明书进行实验。先配制标准磷酸根溶液,用于制作标准曲线。然后将NS3用透析缓冲液稀释成200 nmol/L,将ATP分别稀释成2、1、0.4、0.32和0.2 mmol/L。实验组反应体系为:20 μL反应缓冲液,10 μL酶,10 μL ATP,对照组用透析缓冲液代替酶。反应30 min后,每孔加入200 μL显色液,30 min后使用酶标仪检测A620。
1.2.5 核酸解链实验:将合成的ssDNA用退火缓冲液(100 mmol/L KCl,20 mmol/L Tris-HCl pH 7.4,2 mmol/L MgCl2)溶解,配成10 μmol/L母液。配制600 μL退火体系:30 μL cy3标记的核酸,30 μL BHQ2标记的核酸,退火缓冲液补齐。将体系避光放于95 ℃水浴中加热5 min后,自然冷却至室温,即得到dsDNA。每个解链反应体系为100 μL,包含50 nmol/L退火产物,20 mmol/L Tris-HCl pH 7.4,10 mmol/L NaCl,0.1 g/L BSA,5 mmol/L MgCl2, 500 nmol/L NS3,混匀后加入全白不透明96孔板中。用酶标仪检测溶液的荧光值[酶标仪参数:激发光550 nm,发射光620 nm,临界值(cutoff值)610 nm],待荧光值稳定后,每孔加入终浓度为5 mmol/L的ATP以及500 nmol/L的竞争剂(GCG TCTTTACGGTG CT),检测荧光值的动力学变化。
1.2.6 利用quick-change获得NS3 G198A表达载体:20 μL反应体系如下:模板200 ng,10 μmol/L引物1.5 μL(上游引物序列:5′-CTTGCATCCTGGAGCT GCAAAAACCAGGAGAGTTC-3′;下游引物序列:5′-G AACTCTCCTGGTTTTTGCAGCTCCAGGATGCAAG-3′),phanta DNA聚合酶1 μL,dNTPs 1 μL,2×缓冲液10 μL,加ddH2O补齐体积。PCR程序为:95 ℃变性4 min,1个循环;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸7 min,18个循环;72 ℃继续延伸10 min,1个循环。反应结束后,加入DpnⅠ酶消化模板。然后将反应产物转化trans5α。挑取单克隆,摇菌培养,提质粒后测序。
2 结果
2.1 Zika NS3蛋白的表达和纯化
Zika NS3原核表达克隆构建成功后,转化大肠杆菌BL21菌株,利用Western blot检测Zika NS3蛋白在大肠杆菌的表达(图1A)。然后用Ni琼脂糖珠子对蛋白进行亲和纯化,得到较纯的Zika NS3全长蛋白,其分子质量约为80 ku,与理论计算的NS3分子量相符(图1B)。
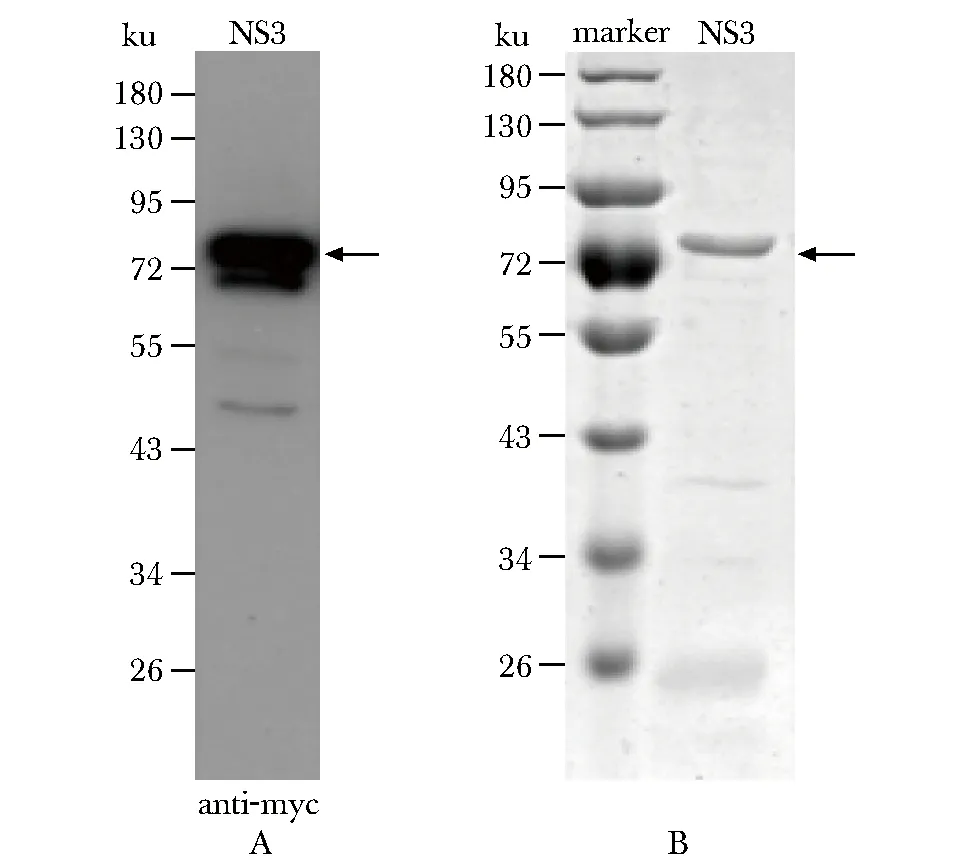
A.Western blot;B.Coomassie blue staining图1 Zika NS3在大肠杆菌中的表达纯化Fig 1 Expression and purification of Zika NS3 in E. coli
2.2 Zika NS3在体外具有ATP水解活性
Zika NS3水解ATP的结果以双倒数曲线方程的形式呈现(图2)。在该反应条件下,Zika NS3具有ATPase活性,其对ATP水解的最大反应速率为2.76 μmol/(L·min),Km值为0.11 mmol/L。
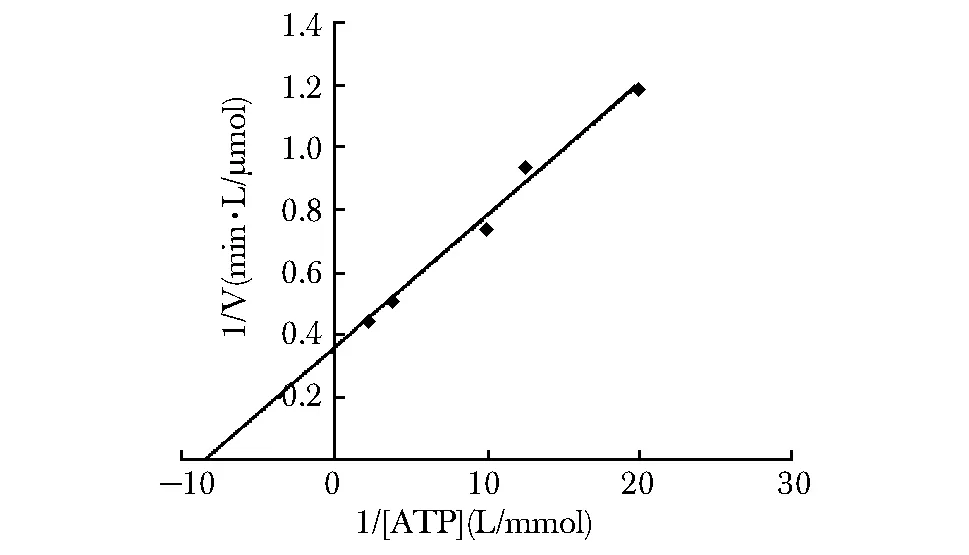
图2 Zika NS3在体外对ATP的水解活性Fig 2 ATP hydrolysis activity of Zika NS3 in vitro
2.3 Zika NS3在体外具有对dsDNA的解链活性
核酸解链系统利用FRET原理(图3A),将核酸单链末端分别带上Cy3荧光基团和BHQ2淬灭基团,当二者退火形成双链时,Cy3荧光被BHQ2吸收;当双链被解开后,Cy3荧光被检测到。实验发现,相比不加蛋白的对照组,加入Zika NS3的实验组随着反应时间延长,Cy3荧光值显著增加,解链发生(图3B)。
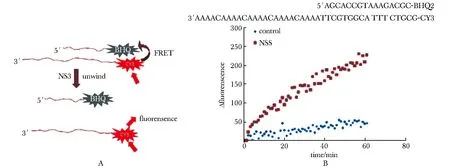
A.system principle;B.dsDNA unwinding图3 Zika NS3在体外对dsDNA的解链活性Fig 3 dsDNA unwinding activity of Zika NS3 in vitro
2.4 Zika NS3 G198A表达纯化
Zika NS3 G198A突变体在大肠杆菌BL21中可以被较好的诱导表达。通过Ni柱亲和纯化可以得到较纯的G198A蛋白(图4)。

图4 Zika NS3 G198A表达纯化Fig 4 Expression and purification of Zika NS3 G198A
2.5 Zika NS3 G198A水解ATP的活性显著降低
使用等量的Zika NS3野生型(WT)和G198A进行ATP水解反应,结果发现G198A对ATP的水解速率显著低于NS3 WT(图5)。
2.6 Zika NS3 G198A对dsDNA的解链活性降低
使用等量的Zika NS3 WT和G198A进行dsDNA解链实验,结果发现G198A对dsDNA的解链速率明显低于NS3 WT(图6)。
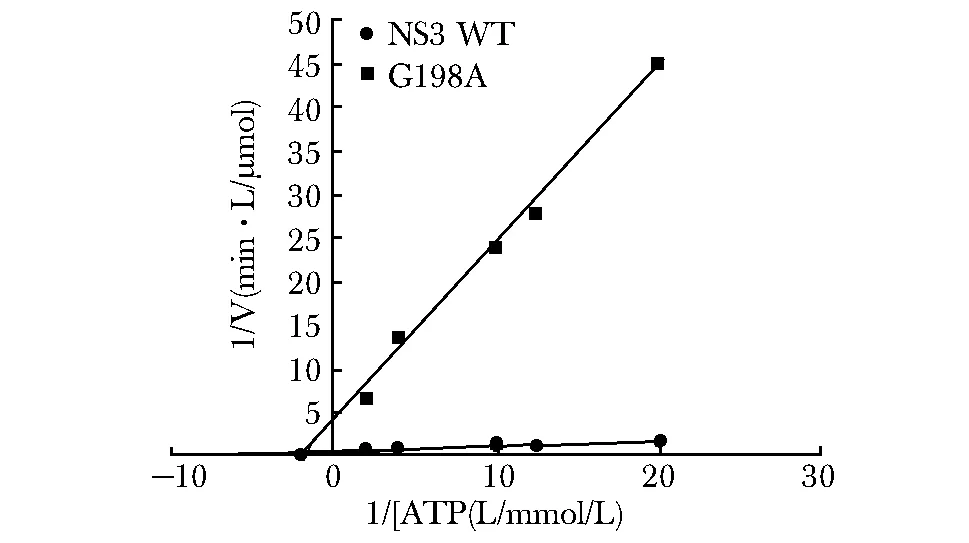
图5 Zika NS3WT与G198A对ATP水解活性比较Fig 5 Comparision of ATP hydrolysis activity between Zika NS3 WT and G198A
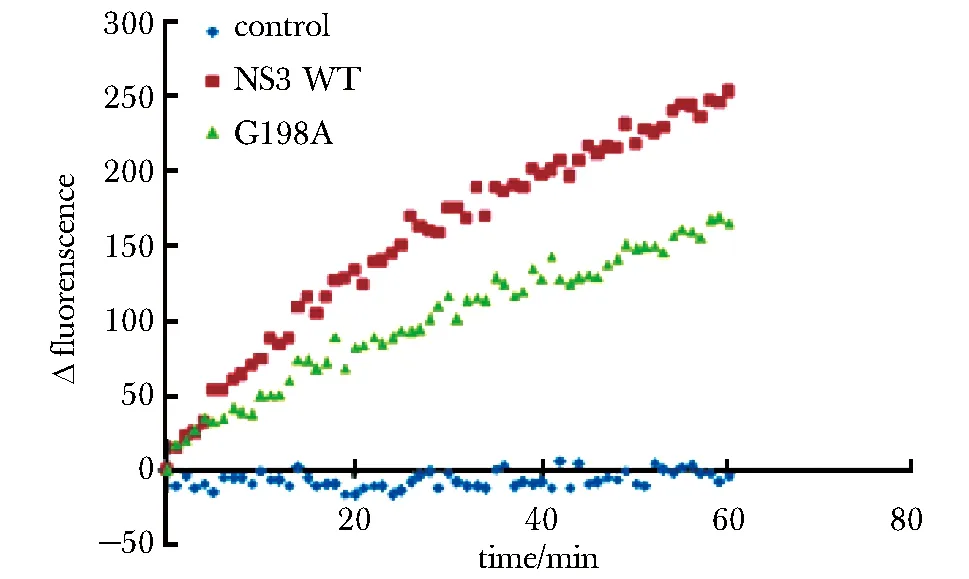
图6 Zika NS3 WT与G198A对dsDNA解链活性比较Fig 6 Comparision of dsDNA unwinding activity between Zika NS3 WT and G198A
3 讨论
除了Zika病毒,黄病毒还包括登革热病毒和乙型脑炎病毒等。经过长期研究,这些黄病毒NS3蛋白的结构和功能已被广泛熟知[5]。NS3蛋白N端蛋白酶(protease)结构域主要发挥蛋白酶功能,通过切割病毒自身蛋白,帮助病毒成熟,此外还能切割宿主细胞免疫相关因子,帮助病毒存活[6- 7]。C端解旋酶(helicase)结构域通过水解ATP供能,解旋双链核酸[8]。NS3与NS5相互配合,共同实现病毒基因组的复制。但目前,对于Zika病毒NS3的研究主要局限在结构方面,而对其功能的研究少有报道[9]。
在本研究中,首先通过大肠杆菌表达和亲和纯化,得到了Zika NS3蛋白。然后对Zika NS3本身的ATP水解活性和dsDNA的解旋活性进行了检测。结果发现,Zika NS3同其他黄病毒NS3一样[6],在体外均具有ATP水解活性和dsDNA解旋活性,可以水解ATP并解链dsDNA。
黄病毒NS3对核酸的解链需要ATP水解供能。因此抑制NS3的ATP水解活性可以抑制其核酸解旋活性。已有研究发现,登革热病毒NS3 G198A突变体的ATP水解活性和核酸解旋活性,相比野生型NS3均明显减弱[10]。通过序列比对,将Zika NS3蛋白的该位点进行突变,得到Zika NS3 G198A突变体,并对其酶活性进行研究。结果发现,同登革热病毒NS3一样,Zika NS3 G198A的ATP水解活性以及dsDNA的解旋活性均受到明显抑制。经分析,NS3 G198A通过抑制ATP水解进而抑制了dsDNA解链。之所以G198A对核酸解链的抑制效果低于对ATP水解的抑制效果,可能是由于实验所用dsDNA双链长度较短,只需要较少的ATP供能,便可以达到解链效果。
综上所述,Zika NS3蛋白在体外具有ATP水解活性和dsDNA解旋活性,且NS3 G198A突变体通过影响NS3的ATP水解活性影响其对dsDNA的解链活性。该结果有助于阐明Zika病毒复制机制,为抑制Zika病毒感染提供新的思路。
参考文献:
[1] Li C, Xu D, Ye Q,etal.Zika virus disrupts neural progenitor development and leads to microcephaly in mice[J].Cell Stem Cell, 2016,19:120- 126.
[2] Govero J, Esakky P, Scheaffer SM,etal. Zika virus infection damages the testes in mice[J]. Nature, 2016,540:438- 442.
[3] Apte-Sengupta S, Sirohi D, Kuhn RJ. Coupling of replication and assembly in flaviviruses[J]. Curr Opin Virol, 2014,9:134- 142.
[4] Klema VJ, Padmanabhan R, Choi KH. Flaviviral replication complex: coordination between RNA synthesis and 5′-RNA capping[J]. Viruses,2015,7:4640- 4656.
[5] Luo D, Vasudevan SG, Lescar J. The flavivirus NS2B-NS3 protease-helicase as a target for antiviral drug development[J]. Antiviral Res,2015,118:148- 158.
[6] Li XD, Sun L, Seth RB,etal. Hepatitis C virus protease NS3/4A cleaves mitochondrial antiviral signaling protein off the mitochondria to evade innate immunity[J]. Proc Natl Acad Sci U S A,2005,102:17717- 17722.
[7] Bera AK, Kuhn RJ, Smith JL. Functional characterization of cis and trans activity of the Flavivirus NS2B-NS3 protease[J]. J Biol Chem,2007,282:12883- 12892.
[8] Pang PS, Jankowsky E, Planet PJ,etal. The hepatitis C viral NS3 protein is a processive DNA helicase with cofactor enhanced RNA unwinding[J]. EMBO J,2002,21:1168- 1176.
[9] Jain R, Coloma J, Garcia-Sastre A,etal. Structure of the NS3 helicase from Zika virus[J]. Nat Struct Mol Biol,2016,23:752- 754.
[10] Matusan AE, Pryor MJ, Davidson AD,etal. Mutagenesis of the Dengue virus type 2 NS3 protein within and outside helicase motifs: effects on enzyme activity and virus replication[J]. J Virol,2001,75:9633- 9643.
