黄芩苷协同头孢他啶对金黄色葡萄球菌生物膜的影响
2018-05-16杜仲业刘唐娟陈一强
闭 关 罗 劲 杜仲业 刘唐娟 陈一强
(广西医科大学第一附属医院呼吸与危重症医学科,广西 南宁,530021)
金黄色葡萄球菌(Staphylococcus aureus,S.a)是临床常见的重要致病菌,可引起肺炎、脑膜炎和心内膜炎,甚至脓毒血症、金黄色葡萄球菌烫伤样综合征等全身感染[1]。金黄色葡萄球菌慢性感染迁延难愈的重要原因之一是细菌生物膜的形成;生物膜能协助细菌逃避免疫识别和免疫清除,降低抗生素的渗透能力,从而增强细菌的耐药性[2]。大环内酯类抗生素能与其他抗生素协同作用,抑制细菌生物膜形成,增强抗生素杀菌效力[3-4],本研究以克拉霉素作阳性对照,探讨黄芩苷与头孢他啶联合作用后,对早期形成的金黄色葡萄球菌生物膜形成是否起抑制作用,以求从传统中药宝库中寻求新的抗感染研究方向。
1 材料与方法
1.1 实验材料
1.1.1 菌株:实验菌株为临床分离株,经耐药谱及蛋白A基因(spa)分型,编号为17546(t037)。质控菌株为ATCC25923;均由我院临床微生物检验中心提供。
1.1.2 载体:规格为1 cm×1 cm的医用聚氯乙烯薄片(上海景年医疗器械有限公司),高压蒸汽灭菌30 min后作为BF载体备用。
1.1.3 主要试剂:标准品黄芩苷由中国食品药品鉴定研究院购入,标准品头孢他啶和克拉霉素由中国药品生物制品检定所购入。M-H肉汤、胰蛋白胨大豆肉汤(中国陆桥技术责任有限公司);LB琼脂、胰蛋白大豆琼脂(TSA)(中国陆桥技术责任有限公司)。
1.2 方法
1.2.1 制备金黄色葡萄球菌生物膜体外模型:复壮金黄色葡萄球菌实验菌株,取单菌落接种于含1%葡萄糖的TSB溶液20 mL中,37 ℃,200 r/min恒温摇床摇晃培养18~20 h后,换新鲜TSB将细菌悬液稀释到OD600=0.1,此吸光度下对应细菌数量约为4.75×108CFU/mL,将细菌悬液加入无菌24孔板中,每孔2 mL,再置入灭菌的BF载体,37 ℃恒温培养,隔天换新鲜TSB培养液,3 d后于载体表面可形成早期生物膜。
1.2.2 结晶紫染色法半定量细菌生物膜:把载体放入无菌生理盐水中轻轻漂洗后晾干,以除去浮游菌;将晾干的载体用0.1%结晶紫进行染色,染色时间约15 min;待充分染色后,再将载体用无菌生理盐水漂洗至液体清亮,以洗去结晶紫。晾干载体后,取95%乙醇1 mL将附着于载体上的结晶紫溶出,作用时间约5 min;最后取200 μL乙醇结晶紫溶液置于96孔板内,于分光光度计下测定OD570值。
1.2.3 MIC测定:依据2015年版CLSI,以试管2倍稀释法测定上述药物对实验菌、质控菌的MIC和MBC。
1.2.4 药物对细菌生物膜的影响:将各组载体分入空白对照组、克拉霉素组、黄芩苷组、头孢他啶组、黄芩苷+头孢他啶组、克拉霉素+头孢他啶组,黄芩苷、克拉霉素和头孢他啶的最终浓度分别为512 μg/L、32 μg/L和256 μg/L;;各组载体经无菌生理盐水漂洗后,于建模3 d后,置入各组TSB中,每组TSB分别含上述相应浓度药物,于37 ℃细菌孵育箱内孵育,分别在实验的第4、8、16和24小时后取出载体,将载体置入2 mL无菌生理盐水内,经超声震荡(15 min)与旋涡震荡仪振荡(5 min,3000 r/min),将生物膜及生物膜内的金黄色葡萄球菌震荡脱落,形成菌悬液,将菌悬液以连续稀释法行活菌计数,各组在各时间点均计数6份标本,菌落计数结果用±s表示。每次测定均重复3次并取平均值。
1.3 统计学方法:OD570值及悬浮液活菌计数值用SPSS20.0统计软件进行单因素方差分析(ANOVA分析)。
2 结 果
2.1 黄芩苷、头孢他啶、克拉霉素对金黄色葡萄球菌的MIC及MBC测定结果:黄芩苷、头孢他啶、克拉霉素对实验菌株(S.a-17546)的MIC分别为2048 μg/L、64 μg/L、128 μg/L,头孢他啶对实验菌株的MBC为256 μg/L。
2.2 不同药物组中细菌生物膜内活菌计数结果:24 h内空白对照组的BF内活菌数无明显变化(P>0.05),且单药组(黄芩苷组ā克拉霉素组和头孢他啶组)细菌生物膜内活菌数与空白对照组比较,差异均无统计学意义(P>0.05)。联用组(黄芩苷联合头孢他啶组、克拉霉素联合头孢他啶组)与空白对照组相比,第8、16、24小时生物膜内活菌计数均明显降低(P<0.01),且黄芩苷联合头孢他啶组于第24小时活菌数低于克拉霉素联合头孢他啶组(P<0.05),见表1。
表1 空白对照组、单药组和联用组中细菌生物膜内活菌计数结果(±s,lgCFU/mL)

表1 空白对照组、单药组和联用组中细菌生物膜内活菌计数结果(±s,lgCFU/mL)
注a:与空白对照组相比,P<0.01;b:黄芩苷联合头孢他啶组与克拉霉素联合头孢他啶组相比,P<0.05
空白对照组 7.871±0.201 7.598±0.391 7.844±0.288 7.860±0.335黄芩苷组 7.892±0.174 7.750±0.307 7.715±0.371 7.705±0.432克拉霉素组 7.902±0.240 7.739±0.397 7.723±0.357 7.812±0.349头孢他啶组 7.858±0.140 7.436±0.554 7.514±0.381 7.557±0.531黄芩苷+头孢他啶组 7.913±0.131 6.901±0.180a 6.303±0.507a 5.882±0.321a,b克拉霉素+头孢他啶组 7.897±0.177 6.749±0.245a 6.437±0.419a 6.305±0.471a,b
表2 空白对照组、单药组和联用组细菌生物膜结晶紫半定量测定结果(±s)
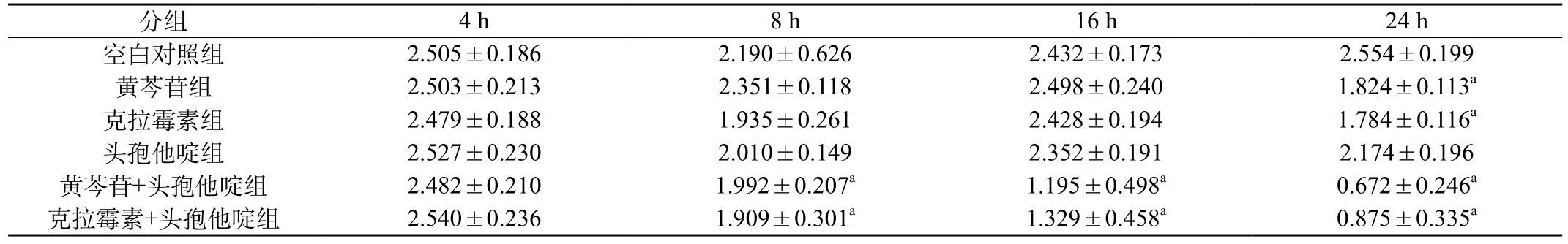
表2 空白对照组、单药组和联用组细菌生物膜结晶紫半定量测定结果(±s)
注a:与空白对照组相比,P<0.01
空白对照组 2.505±0.186 2.190±0.626 2.432±0.173 2.554±0.199黄芩苷组 2.503±0.213 2.351±0.118 2.498±0.240 1.824±0.113a克拉霉素组 2.479±0.188 1.935±0.261 2.428±0.194 1.784±0.116a头孢他啶组 2.527±0.230 2.010±0.149 2.352±0.191 2.174±0.196黄芩苷+头孢他啶组 2.482±0.210 1.992±0.207a 1.195±0.498a 0.672±0.246a克拉霉素+头孢他啶组 2.540±0.236 1.909±0.301a 1.329±0.458a 0.875±0.335a
2.3 细菌生物膜经结晶紫染色半定量法测定结果:空白对照组在各时间点内吸光度值无明显变化(P>0.05);在单药组中,头孢他啶组与空白对照组吸光度值相比,差别无统计学意义(P>0.05);黄芩苷组和克拉霉素组吸光度值于第24小时低于空白对照组(P<0.05)。在联用组(黄芩苷+头孢他啶组ā克拉霉素+头孢他啶组)中,两组吸光度均从16 h开始低于空白对照组(P<0.01),见表2。
3 讨 论
S.a是临床常见致病菌,近年来随着医源性植入物及侵入性操作的增多,S.a引起的细菌生物膜相关性感染也日益增多。细菌生物膜是指细菌黏附于植入物或黏膜表面后,与细菌自身分泌的多糖、脂蛋白,以及机体产生的纤维蛋白等相互粘连聚集,最终形成的膜状物。其形成、发展与成熟受密度感应系统(QS)调控,主要的两种QS系统为agr系统和sar系统,agr系统通过影响胞间多糖黏附素(PIA)的生成来调控细菌间相互黏附能力,进而影响生物膜形成。而sar系统一方面可以调控agr系统的表达,影响PIA形成,也能独立发挥作用[5]。
我国具有丰富中草药资源,祖国传统医药在治疗感染方面为国内外众多学者开拓了新的思路,希望能从天然药物中开发出抗菌效果好、不良反应低的中药[6],黄芩苷是中药黄芩的主要有效成分,本课题组前期已经证实黄芩活性成分可在体外及体内抑制生物膜的形成[7-8],推测其机制可能与黄芩苷抑制细菌QS系统有关。
本研究中,黄芩苷与克拉霉素终浓度均未达其MIC,不表现出抑菌或杀菌作用,故黄芩苷组与克拉霉素组中BF载体,其活菌计数与空白对照组无明显差别(P<0.05),而24 h后结晶紫半定量法测定的吸光度值均小于空白对照组(P<0.01),提示黄芩苷或克拉霉素在该浓度下虽不能直接杀灭细菌,但能影响生物膜的形成。
在黄芩苷或克拉霉素与头孢他啶联合应用后,联合应用组的结晶紫半定量法测定的吸光度值在16 h、24 h均低于空白对照组(P<0.01),而活菌计数值则在第8 h便低于空白对照组,且延长作用时间,在16 h、24 h时,黄芩苷联合头孢他啶组的活菌计数值不仅低于空白对照组,也低于头孢他啶联合克拉霉素组。说明黄芩苷和克拉霉素均能在远低于其MIC的浓度下,早期破坏金黄色葡萄球菌生物膜,为头孢他啶清除细菌提供了条件。且黄芩苷随着作用时间延长,其对头孢他啶的增效作用更加明显。
本实验中头孢他啶组,其浓度等于其MBC,但其活菌计数值与结晶紫半定量法所测定的吸光度值,与空白对照组无显著统计学差异,提示在该浓度下,细菌生物膜的合成未受影响。本结果与药敏实验的差异,推测与细菌生物膜的存在有很大关系,这可能也是临床工作中,对头孢他啶药敏实验表现为敏感的金黄色葡萄球菌菌株,在临床应用中效果不佳的缘故。
以上研究结果表明,黄芩苷可以在低浓度下破坏金黄色葡萄球菌生物膜,与头孢他啶有协同增效作用,且增效作用随着时间延长而增强,可能对未来开发新的抗菌药物提供新思路。
参考文献
[1] Chessa D,Ganau G,Mazzarello V.An overview of Staphylococcus epidermidis and Staphylococcus aureus with a focus on developing countries[J].J Infect Dev Ctries,2015,9(6):547-550.
[2] 管程程,于美美,李倩,等.金黄色葡萄球菌的致病和耐药机制研究进展[J].实验与检验医学,2017,35(1):1-4.
[3] Nichols DP,Caceres S,Caverly L,et al.Effects of azithromycin in Pseudomonas aeruginosa burn wound infection[J].J Surg Res,2013,183(2):767-776.
[4] Fujimura S,Sato T,Kikuchi T,et al.Efficacy of clarithromycin plus vancomycin in mice with implant-related infection caused by biofilm-forming Staphylococcus aureus[J].J Orthop Sci,2009,14(5):658-661.
[5] Rahimi F,Katouli M,Karimi S.Biofilm production among methicillinresistant Staphylococcus aureus strains isolated from catheterized patients with urinary infection[J].Microb Pathol,2016,98(1):69-76.
[6] 崔新杰,夏瑾,尤金彪,等.24味中药对金黄色葡萄球菌生物膜作用的研究[J].时珍国医国药,2017,28(5):1079-1081.
[7] 岑艳灵,李亚楠,孔晋亮,等.黄芩苷联合美罗培南对小鼠腹腔铜绿假单胞菌早期生物被膜的体内影响[J].中华医院感染学杂志,2017,27(1):39-42.
[8] 董必英,陈一强,孔晋亮,等.黄芩苷联合头孢哌酮/舒巴坦对铜绿假单胞菌生物膜破坏作用的体外研究[J].中国现代医药杂志,2016,18(1):1-4.
