急性髓系白血病患者外周血WT1基因的表达水平及其与血清IL6、C3、C4的关系
2018-05-16何玲吴红卫谭大为
何玲,吴红卫,谭大为
1成都医学院第一附属医院风湿免疫血液科,成都 610500
2贵州医科大学附属医院血液科,贵州 贵阳 5500040
急性髓系白血病是造血系统的髓系原始细胞克隆性恶性增殖性疾病,是由正常髓系细胞分化发育过程中造血祖细胞的恶性转变引起的[1],具体的发病机制尚未完全明确。急性髓系白血病患者体内白细胞质量差,因此会引发多种并发症,临床表现主要以感染、持续性发热、皮肤黏膜出血、贫血为主[2]。化疗是临床治疗急性髓系白血病的有效手段,但化疗耐药和缓解后微小残留病变的根除是临床治疗的棘手问题[3]。因此,寻找急性髓系白血病的血清标志物是临床治疗的关键。研究表明,WT1基因在多种恶性血液疾病中异常表达,其表达水平已成为临床检测急性髓系白血病的主要评判指标[4-5]。然而,WT1基因与白细胞介素-6(interleukin-6,IL-6)、补体C3及C4表达水平的相关性尚未见报道。本研究选择48例急性髓系白血病初治患者、25例急性髓系白血病缓解患者、29例急性髓系白血病复发患者和19例健康体检者为研究对象,探讨急性髓系白血病患者外周血WT1基因和血清IL-6、C3、C4的表达水平,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年3月至2017年3月于成都医学院第一附属医院和贵州医科大学附属医院治疗的102例急性髓系白血病患者。所有患者均行血常规、免疫学、骨髓形态学、组织化学染色及染色体核型分析,均符合急性髓系白血病的诊断标准,确诊为急性髓系白血病。急性髓系白血病初治患者48例,其中男26例,女22例;年龄24~36岁,平均(28.23±4.12)岁。急性髓系白血病缓解患者25例,其中男13例,女12例;年龄22~37岁,平均(27.36±4.22)岁。急性髓系白血病复发患者29例,其中男16例,女13例;年龄25~36岁,平均(27.82±4.06)岁。选取同期健康体检者19例为对照组,其中男11例,女 8例;年龄 22~33岁,平均(26.92±4.06)岁。所有患者及家属均对本研究知情并签署知情同意书。4组研究对象的年龄、性别比较,差异均无统计学意义(P﹥0.05),具有可比性。
1.2 诊断标准
急性髓系白血病的诊断标准:①符合英法美协作组(FAB协作组)及世界卫生组织(WHO)对急性髓系白血病的诊断标准[6];②符合《血液病诊断及疗效分析》对急性髓系白血病的诊断标准[7]。纳入标准:①骨髓原始细胞数≥20%;②伴有特殊染色体类型。排除标准:①伴有t(15;17)和t(8;21)等染色体易位的急性髓系白血病患者;②治疗相关性急性髓系白血病患者;③骨髓增生异常综合征(myelodysplastic syndrome,MDS)或骨髓增殖性疾病(myeloproliferative disorders,MPD)转化而来的急性髓系白血病患者。
1.3 主要试剂及仪器
RNA提取试剂盒和反转录试剂盒均购自天根生化科技(北京)有限公司;TaqDNA聚合酶购自北京NEB公司;IL-6、C3、C4酶联免疫试剂盒均购自上海赛默生物科技发展有限公司;Applied Biosystems荧光定量PCR系统购自美国Thermo Fisher Scientific公司;3K15超低温离心机购自德国Sigma公司。
1.4 方法
1.4.1 采集受试者静脉血 采集受试者空腹静脉血3~5 ml至无菌的EDTA抗凝管中,置于-80℃冰箱内保存备用。
1.4.2 实时荧光定量PCR(qRT-PCR)检测受试者外周血WT1 mRNA表达水平 取1.4.1中采集的静脉血,应用RNA提取试剂盒提取总RNA,应用反转录试剂盒将RNA反转录成cDNA,操作步骤严格按照试剂盒说明书进行。根据美国国立生物技术信息中心(NCBI)基因库中WT1的cDNA序列设计引物,WT1上游引物为5′-CAGGCTGCAATAAGAGATATTTTAAGCT-3′,下 游 引 物 为 5′-GAAGTCACACTGGTATGGTTTCTCA-3′;GAPDH上 游 引 物 为 5′-CGTTGGCTTCCCAGAACATCAT-3′,下 游 引 物 为 5′-CATCGGACACATTGGGGGTAG-3′,以GAPDH为内参,行进qRT-PCR。PCR反应体系(50 μl):5×PCR缓冲液10 μl,TaqDNA聚合酶 1 μl,上游引物 2 μl,下游引物 2 μl,10 mmol/L dNTP mix 1 μl,cDNA 1 μl,ddH2O 33 μl。PCR 反应条件:95℃、5 min预变性,95℃、30 s变性,64℃、15 s延伸,共40个循环。采用最大二阶导数法(2-△△Ct)对数据进行统计,计算WT1的相对表达量。△△Ct=(实验组目的基因Ct平均值-实验组内参基因Ct平均值)-(对照组目的基因Ct平均值-对照组内参基因Ct平均值)。
1.4.3 酶联免疫吸附试验(ELISA)检测受试者血清IL-6、C3、C4表达水平 将1.4.1中采集的静脉血置于超低温离心机,3000 r/min离心5 min,收集上清液,分别用IL-6、C3、C4酶联免疫试剂盒检测血清IL-6、C3、C4的表达水平,操作步骤严格按照试剂盒说明书进行。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验;相关性分析采用Pearson直线相关分析。以P﹤0.05为差异有统计学意义。
2 结果
2.1 外周血WT1 mRNA表达水平的比较
急性髓系白血病初治组患者的WT1 mRNA表达水平高于对照组,急性髓系白血病缓解组患者的WT1 mRNA表达水平低于急性髓系白血病初治组,急性髓系白血病复发组患者的WT1 mRNA表达水平高于急性髓系白血病初治组,差异均有统计学意义(P﹤0.05)。(表1)
2.2 血清IL-6、C3、C4表达水平的比较
急性髓系白血病初治组患者的IL-6、C3、C4表达水平均高于对照组,急性髓系白血病缓解组患者的IL-6、C3、C4表达水平均低于急性髓系白血病初治组,急性髓系白血病复发组患者的IL-6、C3、C4表达水平均高于急性髓系白血病初治组,差异均有统计学意义(P﹤0.05)。(表2)
表1 4组研究对象外周血WT1 mRNA表达水平的比较(±s)

表1 4组研究对象外周血WT1 mRNA表达水平的比较(±s)
注:a与对照组比较,P<0.05;b与急性髓系白血病初治组比较,P<0.05
WT1 mRNA 0.21±0.05 0.76±0.21a 0.54±0.07a b 0.92±0.18a b对照组(n=19)急性髓系白血病初治组(n=48)急性髓系白血病缓解组(n=25)急性髓系白血病复发组(n=29)82.440 0.000组别F值P值
表2 4组研究对象血清IL-6、C3、C4表达水平的比较(±s)
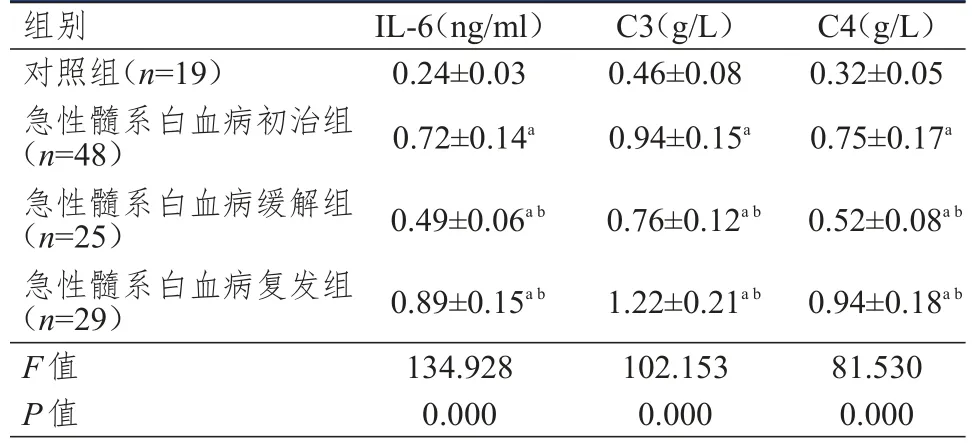
表2 4组研究对象血清IL-6、C3、C4表达水平的比较(±s)
注:a与对照组比较,P<0.05;b与急性髓系白血病初治组比较,P<0.05
组别对照组(n=19)急性髓系白血病初治组(n=48)急性髓系白血病缓解组(n=25)急性髓系白血病复发组(n=29)F值P值IL-6(ng/ml)0.24±0.03 0.72±0.14a 0.49±0.06a b 0.89±0.15a b 134.928 0.000 C3(g/L)0.46±0.08 0.94±0.15a 0.76±0.12a b 1.22±0.21a b 102.153 0.000 C4(g/L)0.32±0.05 0.75±0.17a 0.52±0.08a b 0.94±0.18a b 81.530 0.000
2.3 外周血WT1 mRNA与血清IL-6、C3、C4表达水平的相关性
急性髓系白血病初治组患者的外周血WT1mRNA与血清IL-6、C3、C4表达水平均呈正相关(P﹤0.05)。(表3)

表3 急性髓系白血病初治组患者外周血WT1 mRNA与血清IL-6、C3、C4表达水平的相关性
3 讨论
急性髓系白血病是一种非淋巴细胞来源的急性白血病,发病率和病死率较高[8]。研究表明,随着居住环境的恶化(电离辐射、化学物质等),急性髓系白血病的发病率逐年攀升[9]。有资料显示,2014年美国新发18 860例急性髓系白血病患者,其中死亡人数为10 460例,严重威胁人们的身体健康和生命安全[10]。迄今为止,造血干细胞移植和化疗是临床治疗急性髓系白血病的主要手段,但中国造血干细胞样本不足,且干细胞移植费用昂贵,化疗药物的不良反应大,化疗在杀死肿瘤细胞的同时,也会极大程度地抑制患者正常干细胞的造血功能和免疫功能[11]。随着分子生物学的发展,基因诊断和靶向治疗逐渐受到医学工作者的青睐。
WT1基因是肿瘤抑制基因,于1990年由Call等[12]从Wilms瘤细胞的染色体11p13位点分离出来。WT1基因能够编码锌指转录因子,抑制造血干细胞的增殖和分化,与恶性血液疾病的发生和发展密切相关[13-14]。WT1基因是白血病中常见的一种异常高表达的基因,但其高表达机制尚未完全明确。李凌浩等[15]研究表明,急性髓系白血病患者的WT1基因表达水平明显高于非白血病患者,提示WT1基因在急性髓系白血病的发生、发展及预后中发挥重要作用。张熔等[16]研究表明,WT1基因在急性髓系白血病复发患儿中的表达水平明显升高,提示WT1基因可以作为无染色体易位或基因融合的急性髓系白血病患儿复发的评判指标。边志磊[17]的研究表明,在急性髓系白血病患者的骨髓细胞中,WT1基因的表达水平明显高于非白血病患者;且WT1基因高表达患者的预后较WT1基因低表达患者差。本研究结果表明,急性髓系白血病初治组患者的WT1mRNA表达水平高于对照组,急性髓系白血病缓解组患者的WT1mRNA表达水平低于急性髓系白血病初治组,急性髓系白血病复发组患者的WT1mRNA表达水平高于急性髓系白血病初治组,差异均有统计学意义(P﹤0.05),与上述研究结果一致。
白细胞介素(interleukin,IL)最初在白细胞中发现,后来在多种细胞中均能检测到这一类细胞因子。目前发现的IL有38种,根据其结构的同源性分为IL-1家族、IL-6家族、IL-10家族、肿瘤坏死因子家族和造血因子家族等多个家族,IL-6基因位于人类的第7号染色体上,存在于多种细胞中,如T细胞、B细胞、内皮细胞等。IL-6是一种重要的造血调节因子,与造血干细胞和白细胞的增殖和分化密切相关。李敏敏等[18]研究表明,初诊及骨髓未达完全缓解的白血病患儿中,急性髓系白血病患儿的骨髓IL-6水平高于急性淋巴细胞白血病患儿(P﹤0.05);处于完全缓解期的不同类型白血病缓解患儿的骨髓IL-6表达水平比较,差异无统计学意义(P﹥0.05);骨髓缓解及未缓解的低、中、高危患儿的IL-6表达水平比较,差异无统计学意义(P>0.05);结果提示,IL-6在急性淋巴细胞白血病患者中的表达水平不会出现异常,但在急性髓系白血病患者中的表达水平异常升高,说明IL-6的表达水平与白血病的类型及肿瘤负荷有关。何光翠等[19]研究表明,IL-6与急性髓系白血病原始细胞的生长密切相关,可以通过调控IL-6的表达来调节急性髓系白血病原始细胞的生长。补体系统是天然免疫的重要组成部分,一直以来不少学者认为补体系统能够有效抑制肿瘤发生。但近年来有研究表明,补体能够分泌与肿瘤生成相关的生长因子,激活与肿瘤相关的信号通路,诱导肿瘤的发生和发展[20],但补体系统在急性髓系白血病患者中的作用尚未见报道。本研究结果表明,急性髓系白血病初治组患者的IL-6、C3、C4表达水平均高于对照组,急性髓系白血病缓解组患者的IL-6、C3、C4表达水平均低于急性髓系白血病初治组,急性髓系白血病复发组患者的IL-6、C3、C4表达水平均高于急性髓系白血病初治组,差异均有统计学意义(P﹤0.05),且急性髓系白血病初治患者的外周血WT1 mRNA与血清IL-6、C3、C4表达水平均呈正相关(r=0.421,P=0.032;r=0.406,P=0.021;r=0.454,P=0.001)。提示WT1 mRNA、IL-6、C3、C4与急性髓系白血病的发生和发展密切相关。
综上所述,WT1 mRNA、IL-6、C3、C4在急性髓系白血病患者中呈高表达,提示WT1、IL-6、C3、C4参与急性髓系白血病的发生和发展,可为急性髓系白血病的临床诊断及靶向治疗提供一定的理论依据。
参考文献
[1]庄立琨.腺苷酸环化酶9和IκBα蛋白剪切在急性髓系白血病中的作用[D].上海:上海交通大学,2014.
[2]王雪梅,叶远馨,杨炼,等.四川地区AML1-ETO融合基因与急性髓系白血病临床特征的相关性及预后因素分析[J].四川大学学报(医学版),2016,47(6):931-935.
[3]张青艳.CIK细胞治疗急性白血病疗效的Meta分析研究[D].武汉:华中科技大学,2014.
[4]Zhao XS,Yan CH,Liu DH,et al.Combined use of WT1 and flow cytometry monitoring can promote sensitivity of predicting relapse after allogeneic HSCT without affecting specificity[J].Ann Hematol,2013,92(8):1111-1119.
[5]Yoon JH,Kim HJ,Shin SH,et al.Serial measurement of WT1 expression and decrement ratio until hematopoietic cell transplantation as a marker of residual disease in patients with cytogenetically normal acute myelogenous leukemia[J].Biol Blood Marrow Transplant,2013,19(6):958-966.
[6]高娜.急性髓系白血病Galectin-3表达及其意义[D].济南:山东大学,2016.
[7]张之南.血液病诊断及疗效标准-2版[M].北京:科学出版社,1998.
[8]张玲.急性髓细胞白血病基因异常对生存状况的影响[D].上海:复旦大学,2013.
[9]杨秀玲.山东省某教学医院急性髓系白血病住院费用及其影响因素研究[D].济南:山东大学,2015.
[10]王英俏.急性髓系白血病发病因素及慢性髓性白血病TKIs早期疗效评估的探讨[D].济南:山东大学,2016.
[11]吴鹏强,袁凯锋,景莉.参芪扶正注射液联合化疗对急性髓系白血病患者疗效及机体免疫功能的影响[J].中草药,2015,46(3):401-404.
[12]Call KM,Glaser T,Ito CY,et al.Isolation and characterization of a zinc finger polypeptide gene at the human chromosome 11 Wilms’tumor locus[J].Cell,1990,60(3):509-520.
[13]Hewitt SM,Monares A,Kotickal L,et al.Regulation of the proncogenes bal-2 and c-myc by the Wilmsptumor supressor gene WT1[J].Cancer Res,1995,55:5386-5389.
[14]Baird PN,Simmons PJ.Expression of the Wilms’tumor gene(WT1)in normal hemopoiesis[J].Exp Hematol,1997,25(4):312-320.
[15]李凌浩,王智,陆时运,等.急性髓系白血病患者骨髓单个核细胞中WT1表达及其与疗效、预后的关系[J].山东医药,2015,55(29):36-38.
[16]张熔,杨季云,廖静,等.WT1基因和AML1-ETO融合基因表达水平在儿童急性髓细胞白血病微小残留病监测中的临床意义[J].国际输血及血液学杂志,2015,38(4):283-288.
[17]边志磊.WT1基因在急性髓系白血病中的表达与预后的关系[D].郑州:郑州大学,2014.
[18]李敏敏,邹亚伟,彭淑梅,等.白血病患儿骨髓及分离培养MSC的IL-6水平[J].中国输血杂志,2015,28(5):549-552.
[19]何光翠,邓锐,刘一岚,等.急性白血病患者血清IFN-γ、TGF-β、IL-6和IL-17水平及临床意义[J].解放军医药杂志,2017,29(6):19-21.
[20]宁昌,陈文伟,黎燕,等.补体系统与肿瘤的关系研究进展[J].国际药学研究杂志,2014,41(5):516-521.
