女贞叶的直接电离质谱研究
2018-05-15张兴磊余维芳方小伟王楠楠
张兴磊, 余维芳, 方小伟, 张 华, 王楠楠
(1.江西省质谱科学与仪器重点实验室,江西 南昌 330013;2.东莞出入境检验检疫局,广东 东莞 523000)
女贞LigustrumlucidumAit属于木犀科植物,主要分布在我国南部,是一种传统的药用植物。一般采集女贞的果实(女贞子)和叶子进行药用,女贞子的药用价值已经被广泛的开发与应用,但女贞叶的药用价值还有待于进一步的研究与开发。《中药大辞典》记载女贞叶味微苦,性平无毒,具有消炎消肿,袪风,袪瘀散结,生肌止痛及收敛防腐之功效,因此女贞叶的药用有效成分的研究对女贞叶的药学临床应用具有重要的指导意义。女贞叶的药用化学成分主要来源是女贞叶的次生代谢产物(童东锡,2013),次生代谢是植物生长和环境两者相互作用的结果,此外,不同生长阶段叶子中的次生代谢产物也存在极大的差异(段传人等,2003)。植物中次生代谢产物的差异与该植物的药用价值密切相关,因此,对女贞叶药用价值的研究也不能仅仅局限在某个生长阶段的女贞叶,而应该对多个生长阶段的女贞叶进行系统的研究。
目前主要采用浸提法对女贞叶进行预处理,并借助光度法(Zhang et al.,2013)、高效液相色谱法(Xia et al., 2011, 2012)或液质联用(Romani et al.,2000)等技术对女贞叶的浸提液进行分析。这些方法都需要复杂的样品预处理过程,无法实现女贞叶中化学成分的直接快速分析。新兴常压离子化质谱技术可以在无需样品预处理的条件下直接分析复杂基体样品,为实现复杂基体样品的简单、快速分析提供了可靠的途径(Cooks et al.,2006;Venter et al.,2008;Chen et al.,2009),如激光消融电喷雾电离质谱(LAESI-MS)利用激光直接使植物样品表面的化学物质发生烧蚀电离(Shrestha et al.,2012;Stolee et al.,2013),电喷雾内部萃取电离质谱(iEESI-MS)可以直接在植物组织样品的内部发生萃取并在样品的表面产生样品萃取液电喷雾用于质谱检测(Zhang et al.,2013a,2013b)。直接电离质谱技术(AI-MS)是一种适用于在无需样品预处理的条件下对植物叶子或较薄植物组织直接分析的新电离技术(Hu et al.,2011, 2012;Liu et al.,2012;欧阳永中等,2013)。笔者利用该直接电离质谱法对采集的新鲜女贞叶中化学成分进行初步分析研究,并比较了不同生长阶段女贞叶的化学组成,对进一步揭示女贞叶的生长代谢和药学研究提供了科学依据。
1 实验部分
1.1 仪器与试剂
LTQ-XL线性离子阱质谱仪(美国Thermo Scientific公司),配有Xcalibur数据处理系统;质谱仪设置为正离子检测模式,质量扫描范围50~1000 u,电离电压4.5 kV,离子传输管温度为150 ℃,离子透镜及检测系统由 LTQ-Tune 功能自动优化。甲醇(色谱纯,美国ROE公司),实验用水为二次蒸馏水。女贞叶采集于校园中。
1.2 实验方法
将刚采集的新鲜女贞叶用二次蒸馏水清洗干净,根据女贞叶子的形态学特征,将女贞叶分为嫩叶和老叶两组,每组包含9片大小与形态类似的女贞叶子,每片叶子作为单独的样本进行直接质谱分析。女贞叶样品的直接电离过程如下:从女贞叶面中切下一个V形样品(长边长为1.5 cm,尖角为30°),用钢夹子固定样品的末端,使V形样品尖端正对着质谱口,这样样品面与质谱仪入口处于同一平面上,V形样品尖端与质谱仪入口的距离为1.0 cm;在样品尖端表面滴加10 μL甲醇,对女贞叶中的化学物质进行萃取;电离电压直接加在固定样品的钢夹子上,在电场作用下,样品尖端产生大量承载了样品待测物的带电微小液滴,带电微小液滴进入质谱仪进行质谱检测。将扣除背景的女贞嫩叶、老叶的质谱数据导入Excel中,利用Matlab(version 7.8.0, Mathworks, Inc., Natick, MA)软件中‘princomp’函数对Excel中的质谱数据进行归一化处理及PCA 分析,并将前3个主成分方向上的得分及载荷结果通过Matlab 软件以图形化的方式显示。
2 结果与讨论
2.1 女贞叶的化学指纹质谱分析
女贞叶的化学指纹质谱图如图1所示。从女贞叶的一级谱图中可以看出,女贞叶中的化学成分被萃取电离后获得大量阳离子分子峰,如:[M]+,[M+H]+,[M+K]+等。由于女贞叶的直接电离质谱分析以甲醇作为萃取剂,女贞叶中的钾离子以[CH3OH+K]+的形式被检测到,得到高丰度的质谱信号峰m/z71。胆碱(Choline)以阳离子[M]+的形式得到m/z104质谱信号峰;糖类物质主要以[M+K]+的形式被电离得到质谱信号峰如m/z219 ([Glucose + K]+), 381 ([Sucrose +K]+),这些信号表明女贞叶中含有丰富的钾、糖等营养成分。

图1 正离子检测模式下女贞叶的质谱指纹谱图Fig.1 AI-MS spectra of Ligustrum lucidum Ait leaf acquired in the positive ion detection mode
此外,通过串联质谱分析和相关文献(Romani ey al.,2000)表明AI-MS检测到女贞叶中大量的黄酮类物质,如:芹菜素糖苷、山奈酚糖苷、槲皮素糖苷。这些黄酮类物质电离后得到三组规律性的质谱信号峰(m/z401,417,433,449,465;m/z563,579,595,611,627;m/z778,794,810,826等),这些质谱信号峰以Δ=16 u(u为原子质量单位,下同)递增。芹菜素、山奈酚、槲皮素这三种物质结构相似,分子间相差一个—O—结构,此外糖残基分别是葡萄糖苷(162 u)和鼠李糖苷(146 u,天然脱氧糖),这两个原因都会使最终得到的分子相差若干个O(16 u)原子,使质谱信号峰变得更加复杂。芹菜素单糖苷有m/z401[Apigenin rhamnoside + H]+,m/z417 [Apigenin 7-O-rhamnoside + H]+,m/z433 [Apigenin 7-O-glucoside + H]+;芹菜素双糖苷有m/z563 [Apigenin 3, 7-O-dirhamnoside + H]+,m/z579 [Apigenin 3-O-glucoside 7-O-rhamnoside+ H]+和m/z595 [Apigenin 3, 7-O-dirglucoside+ H]+。分子离子化的山奈酚单糖苷有m/z433 [Kaempferol 3-O-rhamnoside + H]+,m/z449 [Kaempferol 3-O-glucoside + H]+;山奈酚双糖苷有m/z579 [Kaempferol 3, 7-O-dirhamnoside + H]+,m/z595 [Kaempferol 3-O-glucoside 7-O-rhamnoside+ H]+和m/z611 [Kaempferol 3, 7-O-dirglucoside+ H]+。分子离子化的槲皮素单糖苷有m/z449 [Quercetin 3-O-rhamnoside + H]+,m/z465 [Quercetin 3-O-glucoside + H]+;槲皮素双糖苷有m/z595 [Kaempferol 3, 7-O-dirhamnoside + H]+,m/z611 [Kaempferol 3-O-glucoside 7-O-rhamnoside+ H]+和m/z627 [Kaempferol 3, 7-O-dirglucoside+ H]+。此外,女贞叶的指纹质谱图1中,质谱信号峰在m/z720~874间以Δ=16 u递增的主要峰(如720,736,…,842,858,874)由女贞叶中大量的双黄酮糖苷类物质离子化得到。由以上实验结果可以看出,女贞叶中总黄酮类物质的代谢是一个复杂的过程,它们结构的多样性与相似性给女贞叶中单一结构黄酮的分离与纯化带来一定难度。
2.2 不同生长阶段女贞叶进行快速质谱分析
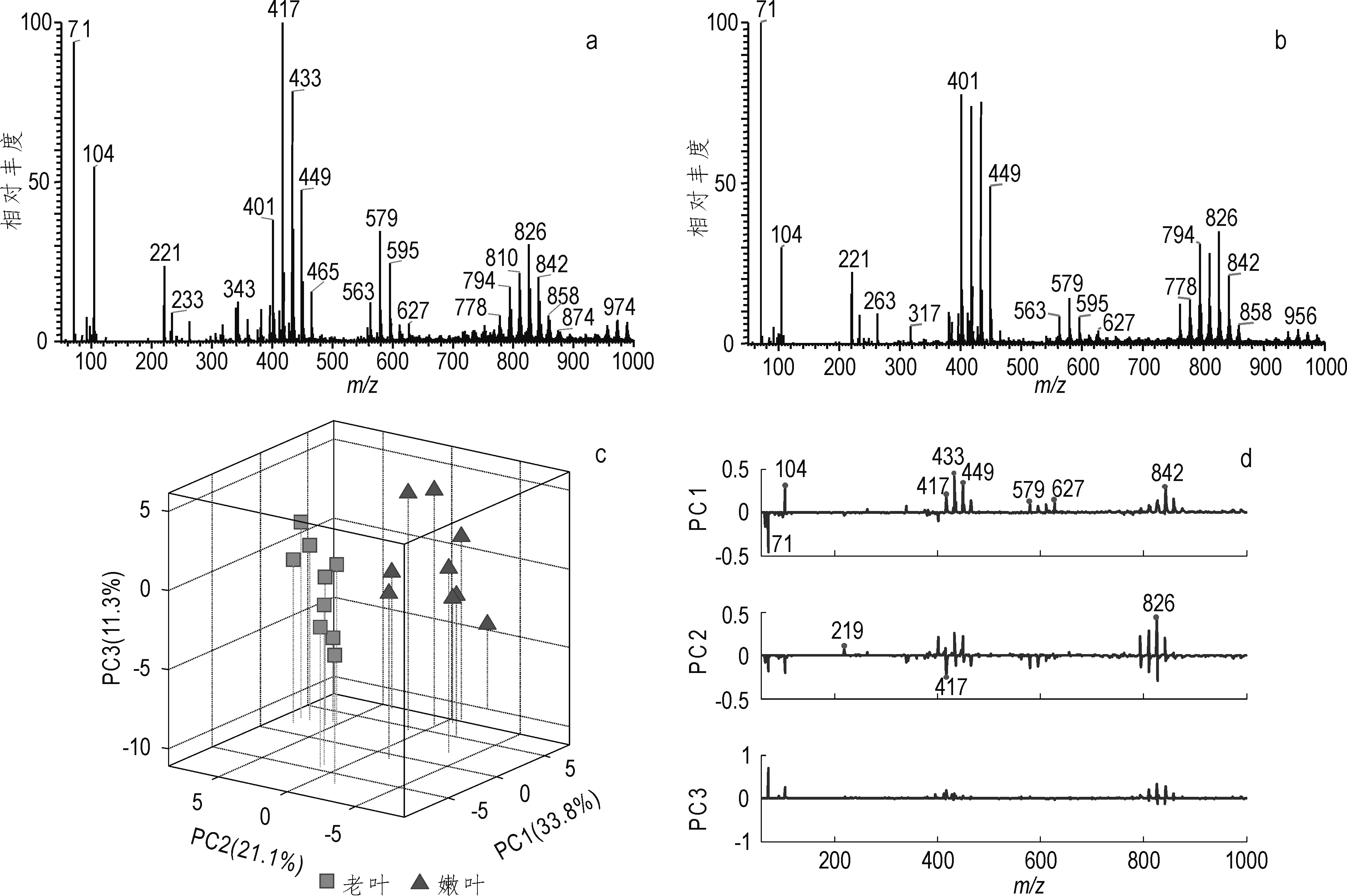
图2 不同生长阶段女贞叶的直接电离质谱分析Fig.2 AI-MS analysis of Ligustrum lucidum Ait leaves of different growth stage a. 女贞嫩叶;b. 女贞老叶;c. 三维得分图;d. 3个主成分上的PCA载荷分布图
获取不同生长阶段的女贞叶中化学物质分子层面的信息,可以进一步了解女贞叶的生长代谢情况,对女贞叶的药学研究与女贞叶药物的开发提供必要的科学依据.按照实验方法对女贞叶的老叶与嫩叶进行直接电离质谱(AI-MS)分析得到正离子检测模式下女贞叶的化学指纹质谱图,并对两类样品的质谱数据进行PCA分析(图2)。女贞嫩叶的化学指纹谱图(图2a)与老叶的化学指纹谱图(图2b)存在显著的差异:老叶中m/z417,579,595等质谱峰的丰度比嫩叶更低,但质谱信号峰在m/z720~874间以Δ=16 u递增的主要峰在老叶中的丰度更高。通过数学方法对谱图数据进行PCA分析,图2c表明两类不同生长阶段的女贞叶可以得到很好地区分。PCA中3个主成分上的载荷分布图(图2d)清晰地体现出质谱特征峰m/z104,417,433,449,579,627,794,810,826等对区分不同生长阶段的女贞叶的贡献率较高,说明双黄酮类化合物在女贞嫩叶与老叶的含量存在较大差异。可以判断在女贞叶的生长代谢过程中黄酮类物质存在聚合现象,即由单黄酮类糖苷转变成双黄酮类糖苷。
女贞在我国是一种分布广泛、适应性非常强的植物,在传统医学中用于治疗阴虚型疾患。笔者采用直接质谱分析的方法,最直接地获得了女贞叶中有关化学组分的分子信息。质谱图数据表明,女贞叶中含有丰富的钾、黄酮等营养成分.钾是生命体所需的大量元素之一,是细胞内的重要阳离子,在多种酶促反应和肌肉收缩中充当重要的作用,关系到许多重要脏器的生理功能,包括心肌的营养及代谢。正常的血钾浓度是维持心脏等脏器正常活动不可或缺的条件(Clausen,2003;Macdonald et al.,2004;Zingman et al.,2007).女贞叶同时含有丰富的钾离子、单黄酮和双黄酮类物质,而这些药物成分正是临床治疗和预防慢性心肌炎等疾患的重要组分(Middleton et al.,2000;Reed,2002;Manach et al.,2004;Moon et al.,2006;Tripoli et al.,2007)。可见,女贞叶有可能做为药用植物,在预防和治疗心肌炎方面发挥作用。
比较女贞叶嫩叶与老叶的化学指纹谱图(图2a,2b),可以判断女贞叶中黄酮类物质的代谢与女贞叶的生长存在一定的相关性关系。为了进一步了解女贞叶中黄酮类物质代谢随女贞叶生长的变化情况,实验选择4类不同生长阶段的女贞叶(从嫩叶到老叶依次标记为age 1,age 2,age 3,age 4)进行直接质谱分析,获得4类不同生长阶段的女贞叶化学指纹图谱。在不同生长阶段的女贞叶的AI-MS谱图中都可以找到黄酮类物质的前体(芹菜素、山奈酚、槲皮素),它们主要以[M+K]+或[M+Na]+的形式被质谱仪检测到,得到相对低丰度的质谱信号峰m/z293,309,325,341,但相对比较而言,这些黄酮前体在嫩叶中含量相对更高。女贞叶中低丰度的女贞前体分子对比高丰度的糖苷类黄酮类物质,说明黄酮前体物质在女贞叶细胞中是不稳定的,易与光合作用产生的单糖发生脱水聚合,形成糖苷类黄酮。对4类女贞叶中单糖苷黄酮、双糖苷黄酮、双糖苷双黄酮进行统计分析(图3)。从图3可以看出,随着女贞叶龄的增长,叶子中的单糖苷黄酮和双糖苷双黄酮的浓度不断地积累,但双糖苷黄酮的浓度却呈现下降的趋势.随着女贞叶子的生长,女贞叶的光合作用叶面积不断增加而获得更加充分的光合作用,使叶子中糖类等代谢物的合成速度更快。大量积累的糖类物质为糖苷类黄酮的大量合成提供了充足的原料;同时细胞中不稳定的黄酮前体进一步与双糖苷黄酮发生聚合作用,生成更多的双黄酮类糖苷。女贞老叶与嫩叶中黄酮类物质的差异性表明,实际生产中应该在适宜的时间对相应生长阶段的女贞叶进行采集,获得最佳品质的女贞叶药材。
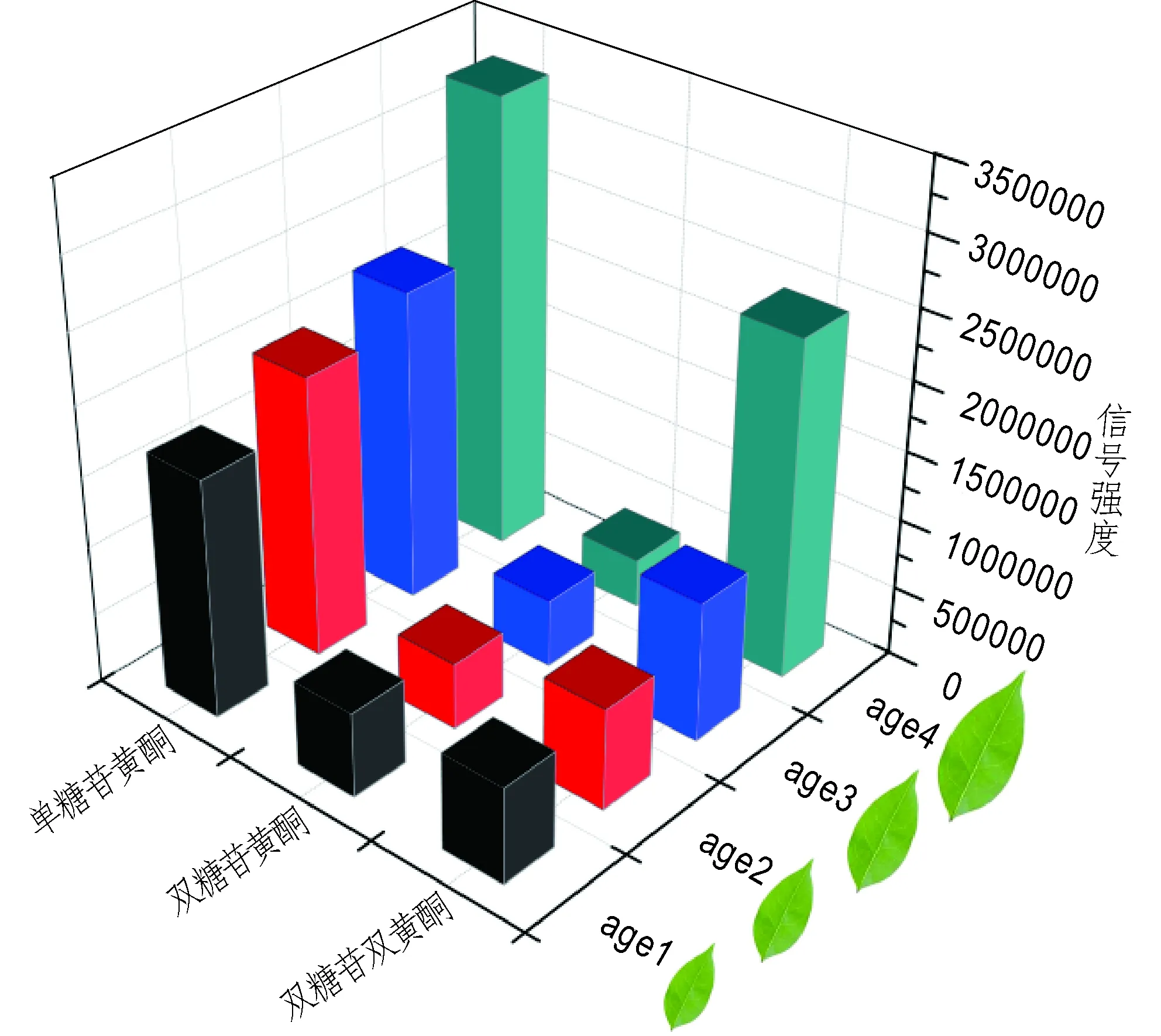
图3 不同生长阶段女贞叶黄酮类物质浓度的比较Fig.3 Concentration of the flavonoids in Ligustrum lucidum Ait leaveswith different growth stage.
3 结论
女贞在我国广泛分布,适应性强,是一种可以防治土壤沙漠化的重要植物。女贞植物的种子(女贞子)在我国有数千年的药用历史,是一种重要的营养性药材,对阴虚型疾患具有重要作用。利用新型直接质谱分析方法,首次对不同生长期内的女贞叶进行了直接质谱分析,获得了叶子中钾、黄酮、糖等有益成分的分子信息。在同一植物源中同时含有丰富钾、单黄酮、双黄酮、糖等有益成分的植物鲜见报道。这些物质的共同存在,为女贞叶这一药用植物资源的开发利用提供了物质基础。笔者所建立的质谱学分析方法能够承受叶子中复杂基质的干扰,识别不同生长阶段的女贞叶中化学成分的差异,具有无需样品预处理、操作简单、检测速度快、高能通量的特点,特别适合对植物组织样品进行原位直接分析。
参考文献
段传人,王伯初,徐世荣. 2003. 环境应力对植物次生代谢产物形成的作用[J].重庆大学学报: 自然科学版, 26(10): 67-71.
欧阳永中,李操,姜翠翠,等. 2013. 乌鸡蛋品质的电喷雾萃取电离质谱法研究[J]. 东华理工大学学报:自然科学版,36(3):344-348.
童东锡. 2013.女贞叶的研究进展[J].中国医药指南, 11(20): 76-78.
Chen H, Gamez G, Zenobi R.2009. What can we learn from ambient ionization techniques? [J]. J. Am. Soc. Mass Spectr.,20(11):1947-1963.
Clausen T.2003.Na+-K+pump regulation and skeletal muscle contractility[J]. Physiol. Rev., 83(4): 1269-1324.
Cooks R G, Ouyang Z, Takats Z, et al.2006.Ambient mass spectrometry[J]. Science,311(5767): 1566-1570.
Hu B, Lai Y H, So P K, et al.2012.Direct ionization of biological tissue for mass spectrometric analysis[J]. Analyst,137(16):3613-3619.
Hu B, So P, Chen H, et al.2011. Electrospray ionization using wooden tips[J]. Anal.Chem.,83(21):8201-8207.
Liu J, Wang H, Cooks R G, et al.2011.Leaf spray: Direct chemical analysis of plant material and living plants by mass spectrometry[J]. Anal.Chem.,83(20):7608-7613.
Macdonald J E, Struthers A D.2004.What is the optimal serum potassium level in cardiovascular patients? [J]. J. Am. Coll. Cardiol.,43(2):155-161.
Manach C, Scalbert A, Morand C, et al.2004.Polyphenols: Food sources and bioavailability[J]. Am. J. Clin. Nutr., 79(5): 727-747.
Middleton E J, Kandaswami C, Theoharides T C.2000. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer[J].Pharmacol. Rev., 52(4):673-751.
Moon Y J, Wang X D, Morris M E.2006.Dietary flavonoids: Effects on xenobiotic and carcinogen metabolism[J]. Toxicol. in Vitro,20(2):187-210.
Reed J.2002. Cranberry flavonoids, atherosclerosis and cardiovascular health[J]. Crit. Rev. Food Sci., 42(3 Suppl.):301-316.
Romani A, Pinelli P, Mulinacci N, et al.2000.Hplc analysis of flavonoids and secoiridoids in leaves ofligustrumvulgarel.(oleaceae) [J]. J. Agr. Food Chem., 48(9): 4091-4096.
Shrestha B, Sripadi P, Walsh C M, et al.2012.Rapid, non-targeted discovery of biochemical transformation and biomarker candidates in oncovirus-infected cell lines using laesi mass spectrometry[J]. Chemical Communications, 48(31): 3700-3702.
Stolee J A.Vertes A. 2013. Toward single-cell analysis by plume collimation in laser ablation electrospray ionization mass spectrometry[J]. Anal. Chem., 85(7): 3592-3598.
Tripoli E, La Guardia M, Giammanco S, et al.2007.Citrus flavonoids: Molecular structure, biological activity and nutritional properties: A review[J]. Food Chem., 104(2): 466-479.
Venter A,Nefliu M,Cooks R G.2008. Ambient desorption ionization mass spectrometry[J]. Trac-Trends in Analytical Chemistry, 27(4): 284-290.
Xia E Q, Wang B W, Xu X R, et al.2011. Microwave-assisted extraction of oleanolic acid and ursolic acid fromligustrumlucidumait[J]. International journal of molecular sciences, 12(8): 5319-5329.
Xia E Q, Yu Y Y, Xu X R, et al.2012. Ultrasound-assisted extraction of oleanolic acid and ursolic acid fromligustrumlucidumait[J]. Ultrasonics Sonochemistry, 19(4): 772-776.
Zhang H, Gu H, Yan F, et al.2013. Direct characterization of bulk samples by internal extractive electrospray ionization mass spectrometry[J]. Scientific Reports, 3: 2495.
Zhang H, Zhu L, Luo L, et al.2013.Direct assessment of phytochemicals inherent in plant tissues using extractive electrospray ionization mass spectrometry[J]. J Agr. Food Chem., 61(45): 10691-10698.
Zhang Y, Liu L, Gao J, et al.2013.New secoiridoids from the fruits ofligustrumlucidumaitwith triglyceride accumulation inhibitory effects[J]. Fitoterapia, 91:107-112.
Zingman L V, Alekseev A E, Hodgson-Zingman D M, et al.2007. Atp-sensitive potassium channels: Metabolic sensing and cardioprotection[J]. J. Appl. Physiol., 103(5): 1888-1893.
