十六烷基三甲基溴化铵柱撑膨润土的制备及其吸附刚果红特性研究
2018-05-15欧阳小兵曹小红王有群张志宾刘云海
戴 荧, 欧阳小兵, 曹小红, 王有群, 张志宾, 刘云海
(1.东华理工大学化学生物与材料科学学院,江西 南昌 310013;2.宜春市安全生产监督管理局监管二科,江西 宜春 336000)
染料广泛应用于纺织、印刷、制纸和皮革等工业中(Kertèsz et al.,2014),继而产生大量染料废水。此类废水成分复杂、难以生物降解、毒性高,若直接排入水体,可在生物链中积累,进入人体后,可导致肾功能障碍、神经系统受损等,造成不可逆转的伤害(Subash et al.,2013),因此对废水进行分离富集处理十分必要。
常见处理染料废水方法包括过滤(Nikooe et al,2017)、电化学(Hu et al.,2016)、吸附(Ozbay et al.,2015)等。在这些方法中,吸附法因操作性强、效率高、经济性高等优势而被广泛研究。农作物组织(Njoku et al.,2014)、活性炭(Li et al.,2013)、石墨烯(Fan et al.,2013)、黏土(Anirudhan et al.,2015)等均是可能的染料吸附剂。膨润土是一种以蒙脱石为主要成分的层状硅酸盐黏土,层间富含可交换的阳离子。采用插层方式改性膨润土可增加或改变膨润土吸附能力(Sreedharan et al.,2013;张志宾等,2013)。本研究利用阳离子表面活性剂对膨润土进行柱撑,用以分离水相中阴离子染料。
本研究制备了十六烷基三甲基溴化铵柱撑膨润土(CetylTrimethyl Ammonium Bromide-Bentonite,简称CTABB),采用SEM、FT-IR、XRD等手段对其形貌、物理化学结构进行了表征。以阴离子染料刚果红为污染物,考察了pH、震荡时间、温度、刚果红初始浓度等因素对CTABB吸附刚果红的影响,重点探讨了吸附动力学、等温线、热力学行为。
1 材料与方法
1.1 实验试剂与仪器
主要试剂。十六烷基三甲基溴化铵(AR)、氯乙酸(AR)、乙酸钠(AR)、刚果红(AR)、硝酸钠(AR)、盐酸(AR)、氢氧化钠(AR)等购自阿拉丁试剂公司,钠基膨润土(CEC= 100 mmol/100g)购自浙江丰虹粘土化工有限公司。
主要仪器。BSA224S型电子天平(德国Sartorius公司),PB-10型pH计(德国Sartorius公司)、721E型紫外可见分光光度计(上海光谱仪器有限公司),TG16-WS型台式高速离心机(湘仪仪器开发有限公司),D8 Advance型X射线衍射仪(德国BrukerAXS公司), NicoletTM iSTM 5型傅立叶变换红外光谱仪(美国Thermo Fisher公司),ZWYR-211D型恒温震荡箱(上海智城分析仪器制造有限公司)。
1.2 CTABB吸附剂制备
在1%钠基膨润土悬浊液中缓慢加入一定量的十六烷基三甲基溴化铵(CTAB)溶液,升温至353 K,强烈搅拌24 h后过滤、洗涤、353 K烘干、研磨过200目筛,得十六烷基三甲基溴化铵柱撑膨润土(CTABB)。
1.3 吸附实验

图1 钠基膨润土和CTABB的扫描电镜图,红外谱图和X射线衍射谱图Fig.1 SEM images, FT-IR spectra, XRD patterns of Na-Bentonite and CTABB a.钠基膨润土的扫描电镜图;b. CTABB的扫描电镜图; c.钠基膨润土和CTABB的红外谱图;d.CTABB和钠基膨润土的X射线衍射谱图
称取一定量CTABB置于25 mL一定浓度的刚果红溶液中,将混合液放入ZWYR-211D型恒温震荡箱中,震荡一定时间后,转移至TG16-WS型台式高速离心机,在8 000 r/min下离心10 min,取上清液,采用721E型紫外可见分光光度计,在497 nm下测其吸光度。计算刚果红去除率(R)和吸附量(qe):
(1)
(2)
式中,C0和Ce分别为刚果红初始浓度和平衡浓度(mg/L),m为吸附剂质量(g),V为刚果红溶液体积(L)。
2 结果与讨论
2.1 SEM,XRD,FT-IR表征
图1a和图1b分别为钠基膨润土和CTABB扫描电子显微镜图谱。钠基膨润土是表面较平整的块状结构,而CTABB是表面粗糙的片层结构,说明CTAB增大了钠基膨润土的层间距,提高分散性。
图1c为钠基膨润土和CTABB红外谱图。在1 645 cm-1处吸收峰为钠基膨润土晶格中结晶水的弯曲振动峰(Jo et al.,2015),但CTABB吸收峰强度较弱,原因是CTAB增强了膨润土的疏水性,导致O—H间缔合力减小;2 918 cm-1、2 849 cm-1处吸收峰是C—H伸缩振动峰(Pan et al.,2015),1 377 cm-1处为C—H弯曲振动峰;1 521 cm-1指认为N—H弯曲振动峰(Trivedi et al.,2016),1 468 cm-1处为RNH3+特征峰,证实了CTAB柱撑入蒙脱土层间。
图1d为CTABB和钠基膨润土的X射线衍射谱图。CTABB谱图在2θ=4.636°处存在较强的d001衍射峰,计算出CTABB层间距为1.905 nm,大于钠基膨润土的1.491 nm。
2.2 pH对吸附的影响
溶液初始pH会影响染料和吸附剂的化学性质,本研究考察了初始pH(4.0,5.0,6.0,7.0,8.0,9.0)对吸附行为的影响(图2)。当pH由4.0增加至9.0时,CTABB对刚果红的吸附率从68.28%下降至48.36%。在考察的pH范围内,CTABB的吸附能力显著高于钠基膨润土。这是因为十六烷基铵正离子通过离子交换方式进入膨润土层间,扩大了后者层间距,有利于刚果红阴离子进入层间;另一方面刚果红的磺酸根离子与CTAB中铵离子发生强静电引力,也有助于吸附。
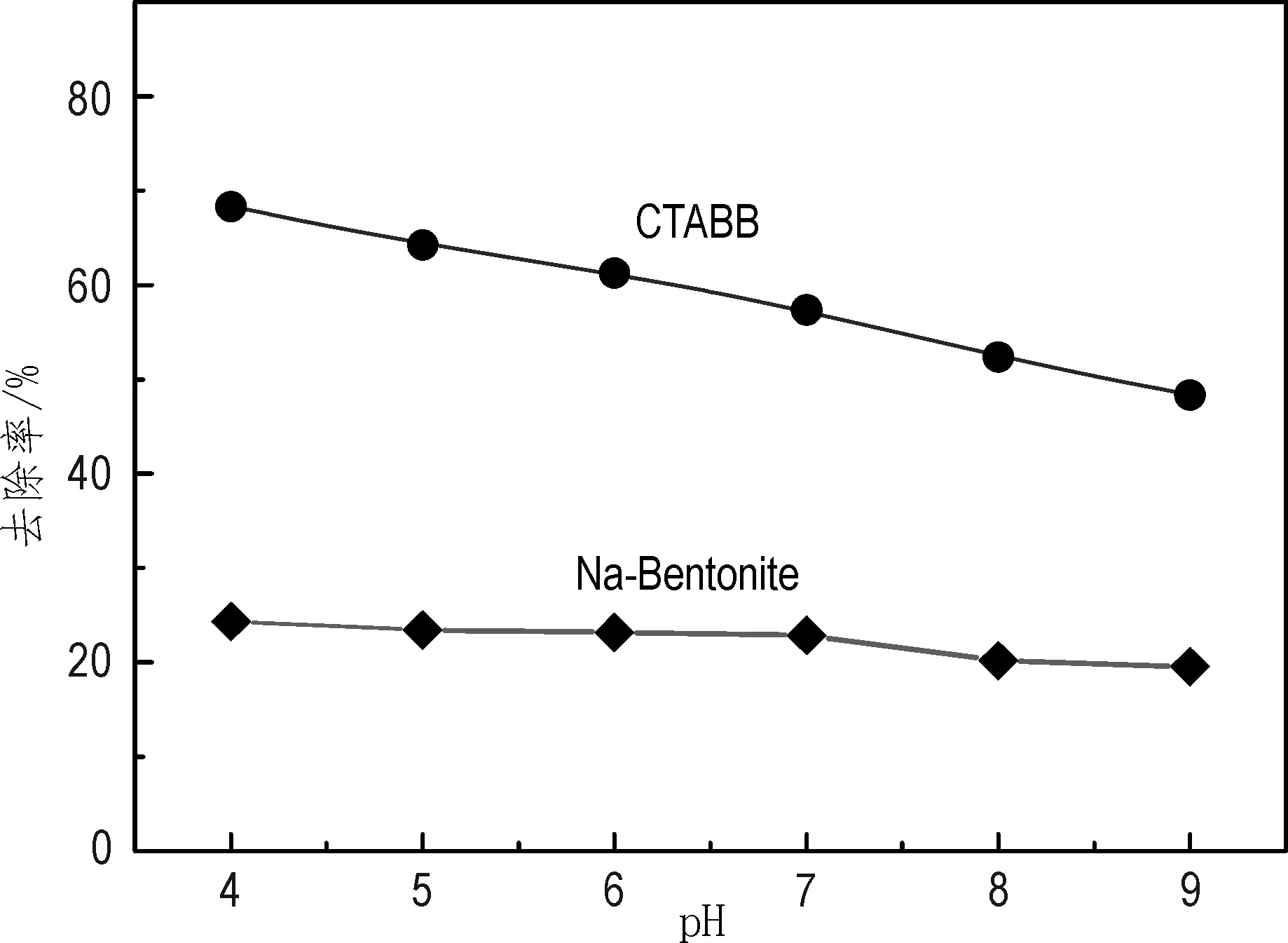
图2 pH对CTABB吸附刚果红的影响Fig.2 Effect of pH on the adsorption of congo red onto CTABBm= 0.01 g,V= 25 mL,C0= 400 mg/L,震荡时间t=600 min,T=298 K
2.3 吸附剂用量对吸附的影响
CTABB用量(10~200 mg)对刚果红去除率的影响见图3。当用量由10 mg增加至90 mg时,供刚果红吸附的位点增加,刚果红去除率从57.40%增加至99.65%;当用量继续增加,虽然总吸附位点增加,但刚果红初始浓度一定,去除率维持在99.5%附近。
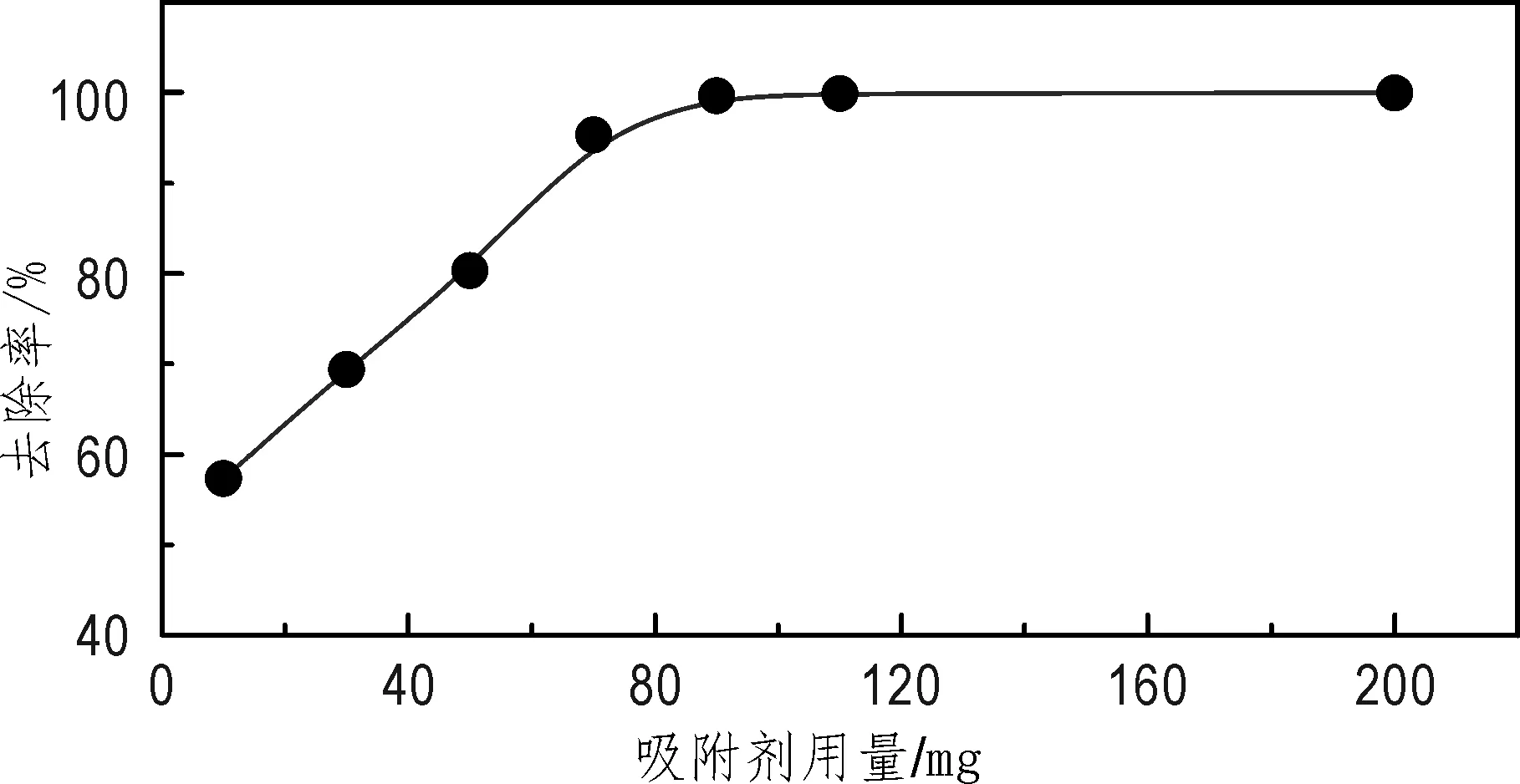
图3 CTABB用量对CTABB吸附刚果红的影响Fig.3 Effectof adsorbent dosage on the adsorption of congo red onto CTABBpH=7,V=25 mL,C0=400 mg/L,震荡时间t=600 min,T= 298 K
2.4 震荡时间对吸附的影响
震荡时间对CTABB吸附刚果红的影响结果如图4所示。随震荡时间增加,CTABB对刚果红的吸附量先快速增加,后增长速度减缓,吸附达到动态平衡。这是因为在吸附初期,CTABB吸附位点充足且固液界面处刚果红浓度梯度较大,导致吸附速率较快;随时间延长,有效吸附位点减少,且刚果红浓度梯度减小,吸附速率变慢,达到动态平衡。为阐明吸附动力学,采用准一级动力学模型(式3)和准二级动力学模型(式4)拟合实验数据(Fu et al.,2015)。
qt=qe×(1-e-k1t)
(3)
(4)
式中,k1(min-1)和k2(g·mg-1·min-1)分别为准一级动力学和准二级动力学模型的吸附速率常数;qt为t时吸附量(mg/g),qe为平衡吸附量(mg/g)。
采用非线性曲线方式拟合实验数据,计算出动力学模型参数(表1)。准二级动力学模型相关系数R2为0.988,大于准一级动力学模型,表明吸附符合准二级动力学模型,说明化学吸附控制吸附进程。准二级动力学模型初始速率常数h根据公式h=k2qe2计算为9.828 mg/(g·min)。

表1 CTABB吸附刚果红的动力学参数

图4 震荡时间对CTABB吸附刚果红的影响Fig.4 Effect of shaking time on the adsorption of congo red onto CTABBpH=7,V=25 mL,C0=400 mg/L,m=0.01 g,T=298 K
2.5 刚果红初始浓度对吸附的影响

表2 CTABB吸附刚果红等温模型参数
刚果红平衡浓度Ce与其在CTABB上平衡吸附量qe的关系见图5。随平衡浓度增加,qe快速增加后维持在811 mg/g附近。根据Gibbs溶液吸附等温线分类,CTABB吸附刚果红属于L2型等温线,可采用Langmuir和Freundlich模型进行拟合。Langmuir模型假设吸附剂表面均一,一个位点只能容纳一个吸附质(Zheng et al.,2014),公式如下:
(5)
式中,Ce是平衡时吸附质的浓度(mg/L),qe是平衡时吸附剂对吸附质的吸附量(mg/g);qm是吸附剂对吸附质的最大吸附量(mg/g),KL是Langmuir常数,指示吸附剂与吸附质的亲和力(L/mg)。
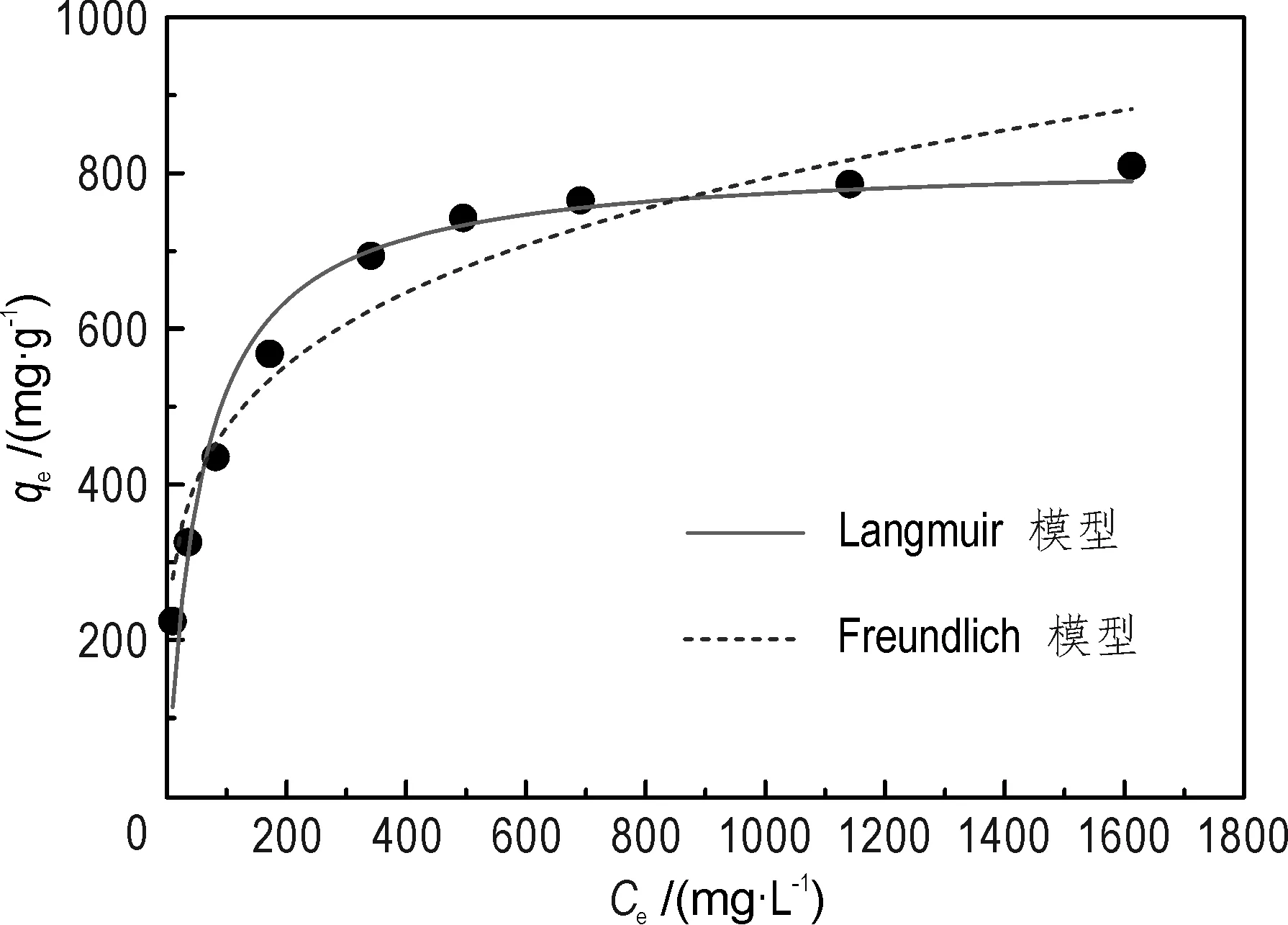
图5 CTABB吸附刚果红等温线Fig.5 Isotherms of the adsorption of congo red onto CTABBpH=7,V=25 mL,m=0.01 g,T=298 K,震荡时间t=600 min
Freundlich模型是一个经验公式,常适用于物理性的多层吸附(Li et al.,2015)。
(6)
其中KF为Freundlich吸附容量参数(mg/g),n是吸附指数。
采用Langmuir和Freundlich模型对吸附过程进行拟合,等温参数见表2。Langmuir模型拟合的相关系数R2比Freundlich模型的更接近于1.0,同时,Langmuir模型的qm值为819.83 mg/g,非常接近于实验值811 mg/g,该结果表明CTABB吸附刚果红过程符合Langmuir等温模型。
2.6 温度对吸附的影响
温度对CTABB吸附刚果红的影响(图6)。随温度升高,去除率降低,表明升高温度不利于吸附。根据Claeyron-Clausius方程ln(qe/Ce) =ΔS/R-ΔH/RT(其中R为气体常数8.314 J/(mol·K),T为绝对温度(K)),以ln(qe/Ce)对1/T作图,线性拟合(图7),依斜率和截距求出ΔH和ΔS,根据方程ΔG=ΔH-TΔS求ΔG(Wang et al.,2015),结果列于表3。

图6 温度对CTABB吸附刚果红的影响Fig.6 Effect of temperature on the adsorption of congo red onto CTABBpH=7,V=25 mL,m=0.01 g,C0=400 mg/L,T=298 K,震荡时间t=600 min

图7 ln(qe/Ce)与1/T拟合Fig.7 ln(qe/Ce) vs. 1/T 表3 CTABB吸附刚果红的热力学参数Table 3 Thermodynamics parameters of the adsorption of congo red onto CTABB

ΔS/(J·(mol-1·K)-1)ΔH/(kJ·mol-1)ΔG/(kJ·mol-1)298K303K308K313K318K35.8313.632.952.772.592.412.24
由表3可知,ΔS大于零,表示CTABB吸附刚果红是熵增过程;ΔH大于零,表明吸附是放热过程,升高温度不利于吸附;ΔG大于零,表明吸附为非自发过程,且随温度升高,ΔG绝对值减少,这与温度升高吸附量减少现象相符;ΔH小于40 kJ/mol,且ΔG随温度变化较小,说明吸附为物理过程,熵增大是该吸附的推动力。
3 结论
(1)CTABB吸附刚果红的去除率随pH增加而减少。
(2)CTABB吸附刚果红过程符合准二级动力学模型,吸附速率由化学过程控制。
(3)吸附符合Langmuir等温模型,CTABB对刚果红吸附量较大,理论最大吸附量达819.83 mg/g。
(4)热力学研究表明CTABB对刚果红吸附为物理吸附,熵增大是该吸附的推动力。
参考文献
张志宾,熊国宣,刘云海,等. 2013.季胺盐阳离子插层蒙脱土对铀吸附性能的研究[J].东华理工大学学报:自然科学版,36( 4): 400-405.
Anirudhan T S, Ramachandran M.2015. Adsorptive removal of basic dyes from aqueous solutions by surfactant modified bentonite clay (organoclay): kinetic and competitive adsorption isotherm[J]. Process Safety and Environmental Protection, 95: 215-225.
Fan L, Luo C, Sun M, et al. 2013. Synthesis of magnetic β-cyclodextrin-chitosan/graphene oxide as nanoadsorbent and its application in dye adsorption and removal[J]. Colloids and Surfaces B: Biointerfaces,103: 601-607.
Fu J, Chen Z, Wang M, et al.2015. Adsorption of methylene blue by a high-efficiency adsorbent (polydopamine microspheres): kinetics, isotherm, thermodynamics and mechanism analysis[J]. Chemical Engineering Journal, 259: 53-61.
Hu C, Hu B, Wang Y, et al. 2016.TiO2nanotube arrays based DSA electrode and application in treating dye wastewater[J]. Russian Journal of Electrochemistry, 52(5): 420-426.
Jo Y N, Um I C. 2015.Effects of solvent on the solution properties, structural characteristics and properties of silk sericin[J]. International journal of biological macromolecules, 78: 287-295.
Kertèsz S, Cakl J, Jiránková H. 2014.Submerged hollow fiber microfiltration as a part of hybrid photocatalytic process for dye wastewater treatment[J]. Desalination, 343: 106-112.
Li H, Wang X, You W, et al. 2015.Adsorption of Pb (II) from aqueous solution by mesoporous MCM-48[J]. Journal of Dispersion Science and Technology, 36(3): 393-401.
Li Y, Du Q, Liu T, et al. 2013. Comparative study of methylene blue dye adsorption onto activated carbon, graphene oxide, and carbon nanotubes[J]. Chemical Engineering Research and Design, 91(2): 361-368.
Nikooe N, Saljoughi E.2017. Preparation and characterization of novel PVDF nanofiltration membranes with hydrophilic property for filtration of dye aqueous solution[J]. Applied Surface Science, 413: 41-49.
Njoku V O, Foo K Y, Asif M, et al.2014. Preparation of activated carbons from rambutan (Nepheliumlappaceum) peel by microwave-induced KOH activation for acid yellow 17 dye adsorption[J]. Chemical Engineering Journal, 250: 198-204.
Ozbay N, Yargic A S. 2015.Factorial experimental design for Remazol Yellow dye sorption using apple pulp/apple pulp carbon-titanium dioxide co-sorbent[J]. Journal of Cleaner Production, 100: 333-343.
Pan H B, Kuo L J, Wood J, et al. 2015.Towards understanding KOH conditioning of amidoxime-based polymer adsorbents for sequestering uranium from seawater[J]. RSC Advances, 5(122): 100715-100721.
Subash B, Krishnakumar B, Swaminathan M, et al. 2013.Highly efficient, solar active, and reusable photocatalyst: Zr-loaded Ag-ZnO for reactive red 120 dye degradation with synergistic effect and dye-sensitized mechanism[J]. Langmuir, 29(3): 939-949.
Sreedharan V, Puvvadi S. 2013.Compressibility behaviour of bentonite and organically modified bentonite slurry[J]. Geotechnique, 63(10): 876.
Trivedi M K, Patil S, Shettigar H, et al. 2016.Spectroscopic characterization of chloramphenicol and tetracycline: an impact of biofield treatment[J]. Pharmaceutica Analytica Acta, 6(7): 395.
Wang D, Liu L, Jiang X, et al. 2015.Adsorption and removal of malachite green from aqueous solution using magnetic β-cyclodextrin-graphene oxide nanocomposites as adsorbents[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 466: 166-173.
Zheng S, Jiang W, Cai Y, et al.2014. Adsorption and photocatalytic degradation of aromaticorganoarsenic compounds in TiO2suspension[J]. Catalysis Today, 224: 83-88.
