氧化石墨烯纳米带对Th(IV)的吸附性能研究
2018-05-15胡学文袁定重仝小兰刘峙嵘
王 云, 吴 鹏, 胡学文, 袁定重,仝小兰, 谢 鹏, 刘峙嵘
(1. 东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西 南昌 330013;2. 东华理工大学核技术应用教育部工程研究中心,江西 南昌 330013; 3. 东华理工大学核科学与工程学院,江西 南昌 330013)
核能发电因经济、清洁和高效,成为新能源的主角。铀是重要的核燃料资源,但我国铀资源相对缺乏,很难满足未来核电发展的需要。钍是除铀外的另一个重要的核能资源,且我国现已探明的钍资源储量占全世界第二位,在铀资源供应有限的情况下,加大钍资源开发和利用可大大缓解铀资源的短缺(罗明标,2013;石秀安等,2011)。钍资源开发利用的同时,也会产生含钍放射性废水,严重污染生态环境(Yousefi et al.,2009)。因此,无论是从钍资源的开发利用,还是从环境保护角度出发,研究钍的高效分离富集技术都是非常必要和紧迫的。
在过去的几十年中,已经发展了许多技术来分离、富集和回收钍,吸附法因具有材料来源广泛、成本低廉、选择性高、操作简单、能耗低、速率快和容量大等特点,日益受到人们的关注(Rao et al.,2006)。目前用于分离与富集钍的吸附介质主要有碳材料、硅材料、聚合物材料、磁性材料及生物质材料等(李雪等,2014;Sengupta et al.,2016;Akkaya,2013;Atta et al.,2015;Bhainsa et al.,2009)。其中,作为碳质材料家族的成员之碳纳米材料,除具有孔结构丰富、抗辐射性、热稳定性、耐酸性优良和环境友好等优点外,由于其纳米尺寸使这种材料比普通碳质材料如活性炭、水热碳等有更大的比表面积和更多的表面原子,还显示出其他优异的物理化学性能,近年来受到人们的广泛重视。碳纳米材料主要包括富勒烯、碳纳米管(CNTs)和石墨烯纳米片(GNs)等,其中碳纳米管和石墨烯纳米片作为吸附剂处理放射性污染物的研究最为活跃(盛国栋等,2012;张伟强等,2014;Lingamdinne et al.,2017;Xu et al.,2016;Liu N et al.,2014)。石墨烯纳米带(GNRs)是近年来材料科学领域的新宠,其独特的结构和一系列优异的性质激发了研究者无限的研究热情。GNRs被定义为宽度为几十纳米的石墨烯,同时保持长宽比大于10,是继碳纳米管之后的又一类准一维碳基纳米材料,它比石墨烯具备更灵活可调的性质和更大的应用价值,兼具碳纳米管和石墨烯两者的优良性质(Hirsch,2009)。相比石墨烯纳米片,GNRs更适合作为一种功能材料的结构材料,能广泛应用于电化学、储能、传感和吸附领域(Liu P et al.,2014;Sinitskii et al.,2010;Wang et al.,2015)。然而截止目前,应用石墨烯纳米带作吸附剂的研究还鲜有报道。
因此,本文试图利用高锰酸钾/浓硫酸氧化法对多壁碳纳米管(MWCNTs)进行轴向切割,制得氧化石墨烯纳米带(GONRs),采用用扫描电镜(SEM)、透射电镜(TEM)、X射线衍射(XRD)和红外光谱(FT-IR)表征GONRs的微观结构,并研究pH、吸附剂用量、接触时间、钍离子浓度和温度等因素对吸附钍性能的影响。
1 实验部分
1.1 实验仪器与试剂
仪器。可见分光度计(721型,天津普瑞斯仪器有限公司);离心机(H1650型,湖南湘仪离心机仪器有限公司);超声仪(KH2200型,昆山禾创超声仪器有限公司);扫描电子显微镜(S4800型,日本Hitachi公司);透射电镜(Tecnai G2 F20,美国FEI公司);红外光谱仪(IR-843型,美国PerkinElmer公司);X射线衍射仪(DX2700型,辽宁丹东浩元仪器有限公司)。
试剂。多壁碳纳米管,高锰酸钾,硫酸,过氧化氢(30%),无水乙醇,氢氧化钠,硝酸,抗坏血酸、尿素、偶氮胂(III),其他试剂均为分析纯试剂,实验用水为自制去离子水。
1.2 氧化石墨烯纳米带的制备
采用改性的Tour方法轴向打开多壁碳纳米管制备氧化石墨烯纳米带(Jiao et al.,2009)。该方法涉及到H2SO4预氧化、KMnO4氧化、透析和纯化四个步骤。首先,称取1 g MWCNTs于装有150 mL H2SO4溶液的三口烧瓶中,在室温下搅拌6 h。然后称量500%(相对于碳管的质量)的KMnO4于混合液中,室温下搅拌1 h。将混合物加热到55 ℃,反应30 min。再将温度升至70 ℃,稳定几分钟,反应停止,冷却到室温。混合物倒入至400 mL含有5 mLH2O2的冰中,并用5.0 μm的PTFE膜过滤。固体物溶解在120 mL去离子水中,超声30 min,在透析袋 (3.5 K, MWCO, pierce) 中透析一周以上。最后,混合液经真空过滤后,固体物在60 ℃ 真空干燥24 h,备用。所得产物被标记为GONRs。
1.3 Th(IV)标准溶液的配制和分析
称取2.38 g Th(NO3)4·4H2O置于100 mL烧杯中,用2 mol/L的HNO3溶解,移入1 000 mL的容量瓶,用2 mol/L的HNO3定容至刻度,即为1 g/L的钍溶液。准确分取上述溶液5 mL,准确稀释至1 000 mL,此溶液为5 mg/L。在分光光度计上,用偶氮胂(III)分光光度法于650 nm波长下测量其吸光度。
1.4 吸附实验
对GONRs吸附Th(IV)的行为使用批处理方法进行研究。分别考察了溶液pH、吸附剂用量、接触时间、钍初始浓度及温度等因素对GONRs吸附U(VI)的影响,并计算了吸附过程的相关动力学、吸附等温线和热力学参数。在指定pH条件下,向50 mL锥形瓶中加入一定量的 GONRs,随后加入25 mL一定浓度的钍溶液。溶液pH是通过pH计测定,用HNO3或NaOH来调节的。锥形瓶在指定温度下振摇一定时间,然后取4 mL混合溶液将吸附系统离心,吸附前后上清液中的钍离子浓度可通过分光光度法测定。吸附量qe(mg/g)及分配系数Kd(mL/g)通过下式计算:
(1)
(2)
式中,C0和Ce分别为钍离子的初始浓度及平衡浓度(mg/L),V是溶液的体积(L),w是吸附剂的质量(g)。
2 结果与讨论
2.1 表征
对碳纳米管和氧化石墨烯纳米带进行了SEM和TEM表征,如图1所示。原始碳纳米管之间互相缠绕但表面光滑、干净,直径为10 ~ 50 nm,空心核结构清晰可见(图1a,c)。而碳纳米管经轴向打开后生成的GONRs直径为30 ~ 100 nm,成纳米带状结构(图1b,d)(Rafiee et al.,2010)。
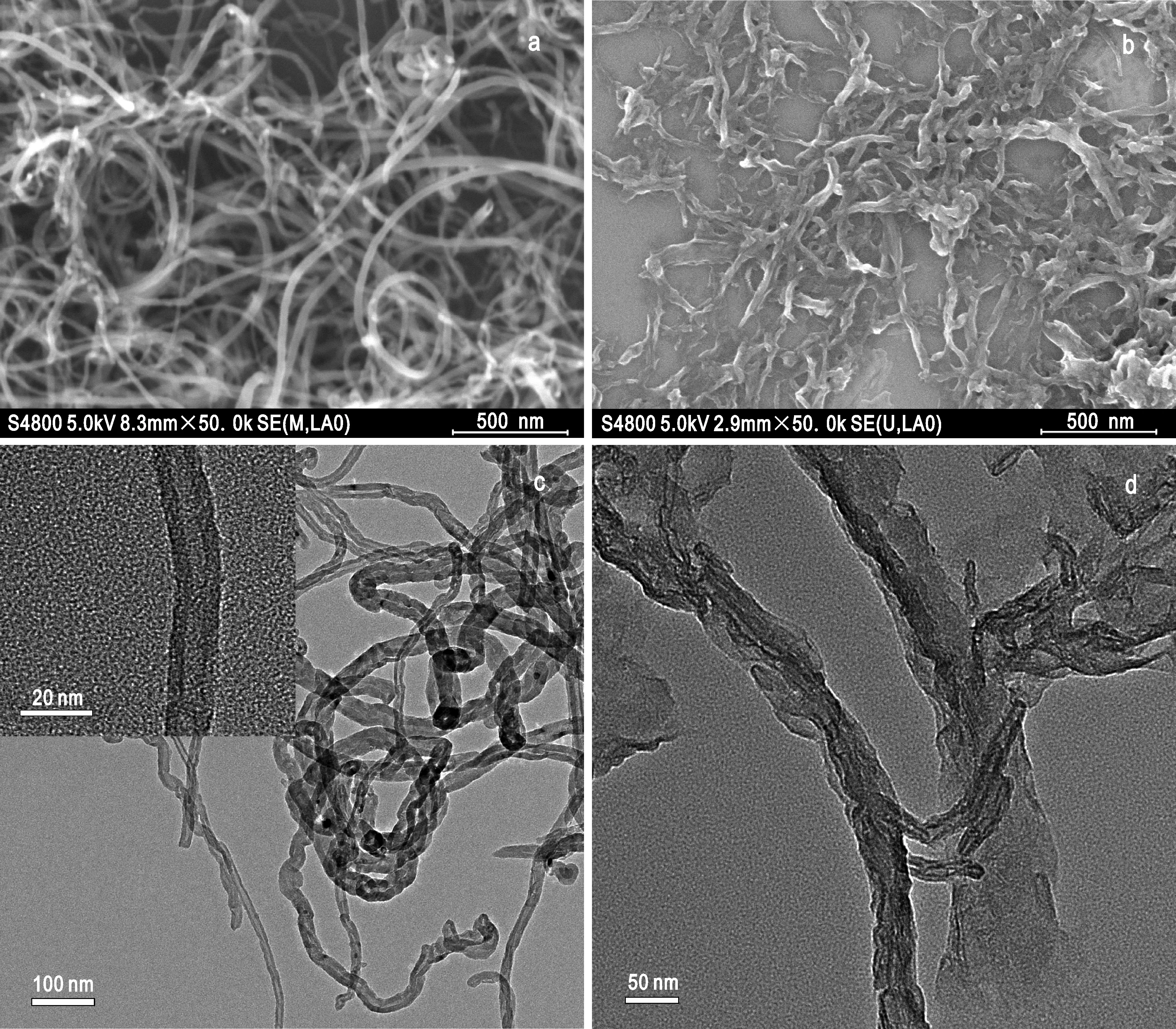
图1 样品的SEM图和TEM图Fig.1 SEM and TEM image of the samples a.MWCNTs的SEM图; b. GONRs的SEM图; c. MWCNTs的TEM图,其中插图为放大的单个MWCNTs的TEM图; d. GONRs的TEM图
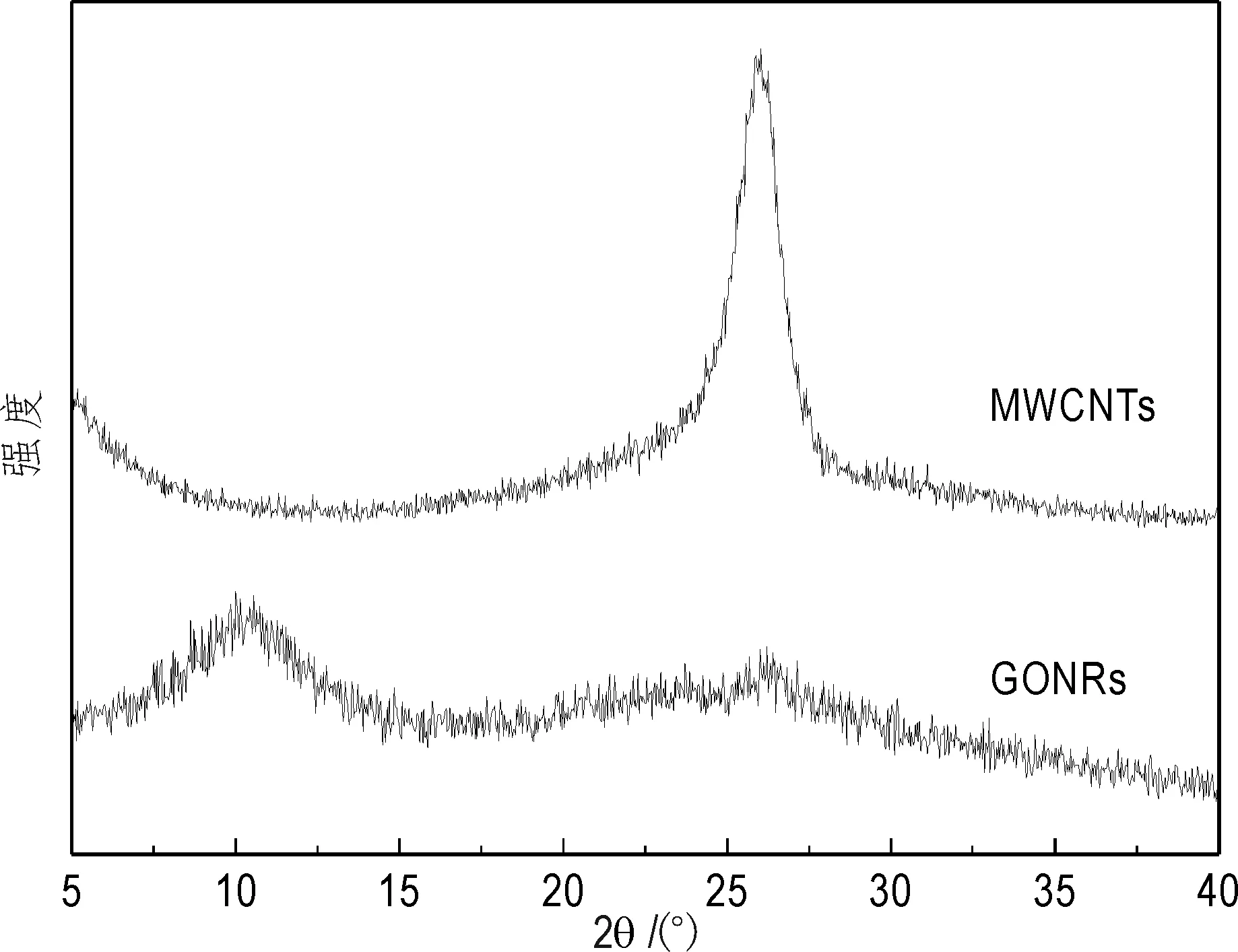
图2 GONRs和MWCNTs的X射线衍射图Fig.2 XRD patterns of GONRs and MWCNTs
图2为MWCNTs和GONRs的XRD图。对于MWCNTs,在2θ = 25.4°处的峰对应于碳纳米管的(002)衍射峰,其晶格间距为3.5 Å。对于GONRs,在2θ = 10.2°处出现了对应于(001)的衍射峰,其晶格间距为8.2 Å。与MWCNTs相比,GONRs之间的间距变大,这是由于MWCNTs被成功轴向切割所致(Castillo-Martínez et al.,2014)。

图3 GONRs和MWCNTs的红外光谱图Fig.3 FT-IR spectra of GONRs and MWCNTs
2.2 pH对吸附性能的影响
pH是影响MWCNTs和GONRs吸附Th(IV)的重要因素之一。如图4所示,两种吸附剂对Th(IV)的吸附量随着pH值升高而升高。当pH 在1~2.5的范围内,两种吸附剂对Th(IV)的吸附量迅速增加,分别为5 mg/g和65 mg/g;当pH 为 3.0时,MWCNTs和GONRs对Th(IV)的吸附量增加到6.5 mg/g和67.8 mg/g。由此可见,MWCNTs经轴向切割后所合成的GONRs对Th(IV)的吸附效果更加显著。实验中溶液pH限制在4.0以下,是因为根据形态分析计算(Pan et al.,2013),钍离子在pH值过高的溶液中会因水解而转变为其他不溶的形态。因此,本实验最佳pH选为3.0。
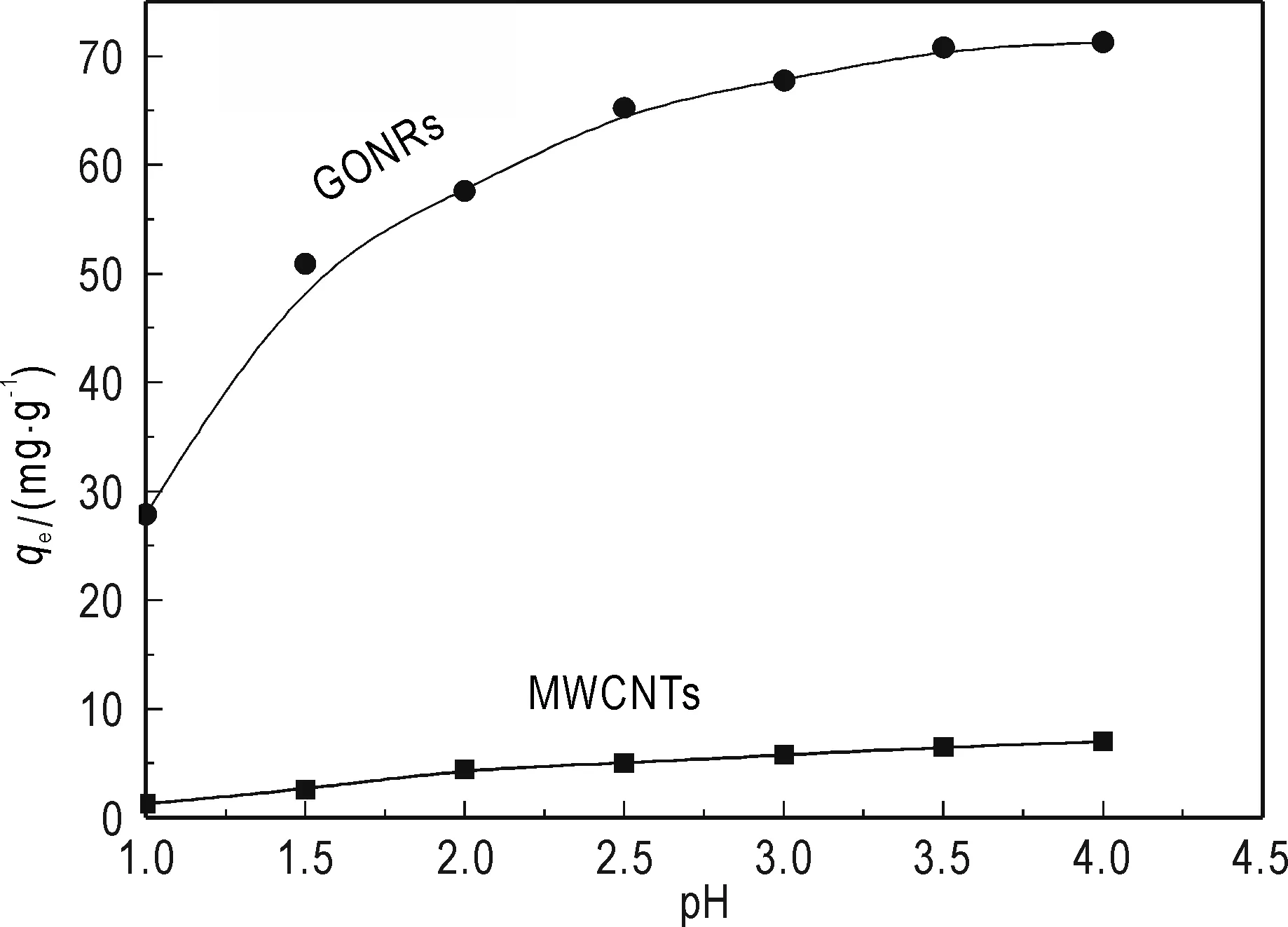
图4 pH对吸附的影响Fig.4 Effect of pH on Th(IV) sorptionC0=30 mg/L, w=20 mg, V=25 mL, T=298 K, t=240 min
2.3 吸附剂用量对吸附性能的影响
吸附剂用量对吸附的影响如图5所示。从图中可以看出,随着吸附剂用量的增加,GONRs对Th(IV)的吸附量逐渐减少。使用5 mg吸附剂时,对Th(IV)的吸附量可高达112 mg/g。但是使用5 mg吸附剂时只有约68%的Th(IV)可以被吸附。当使用10 ~ 50 mg的吸附剂时,可以将约85%或者更多的Th(IV)吸附掉。因此用10 mg吸附剂进行其他吸附条件实验。
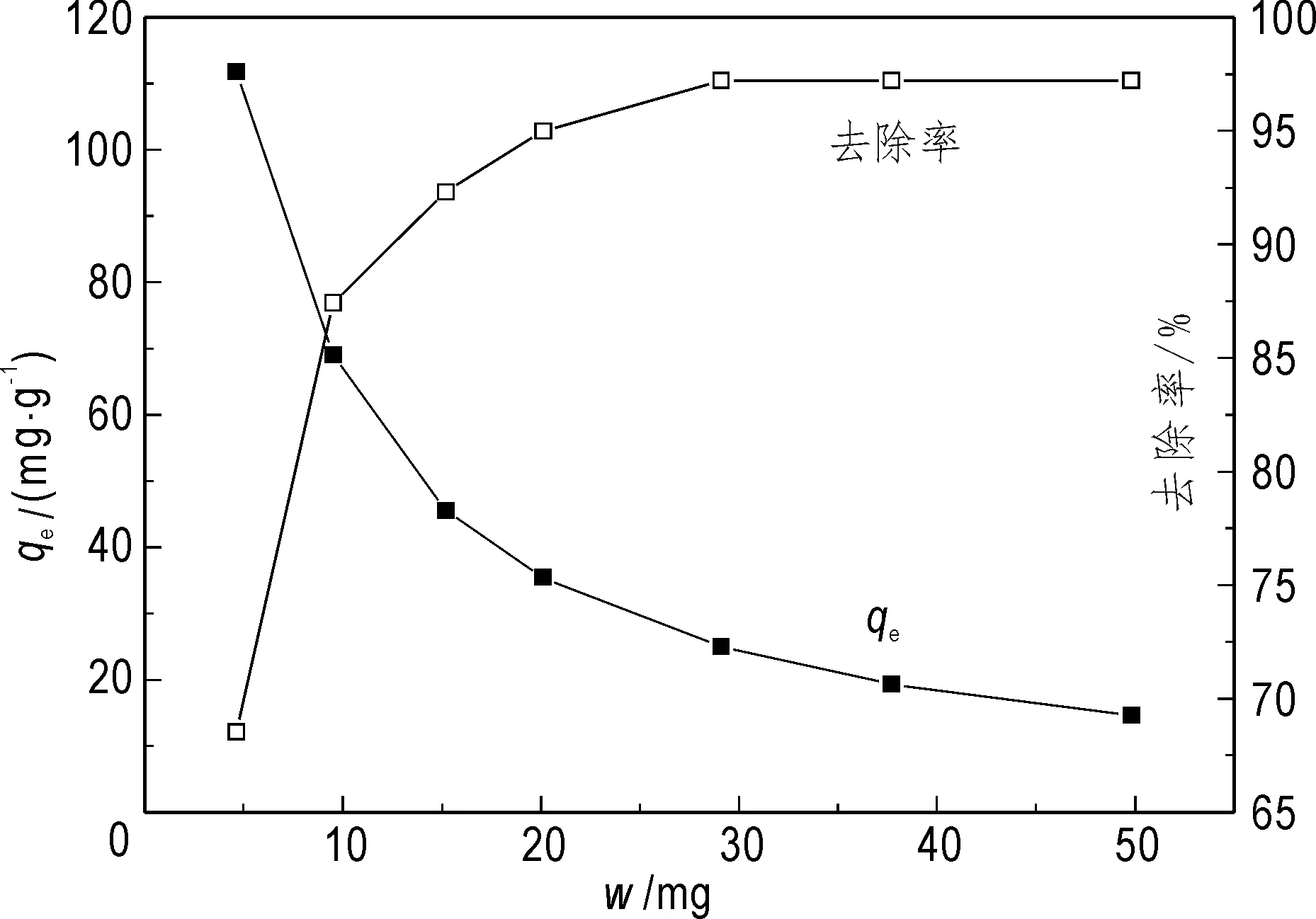
图5 吸附剂用量对GONRs吸附Th(IV)的影响Fig.5 Effect of sorbent dosage on Th(IV) on GONRspH=3.0, C0=30 mg/L, t=240 min, T=298 K,V=25 mL
2.4 接触时间对吸附性能的影响与吸附动力学研究
接触时间对GONRs吸附Th(IV)的影响如图6所示。从图中可以看出,在开始15 min内,GONRs对Th(IV)的吸附速率较快,之后在30 min内吸附基本达到平衡。
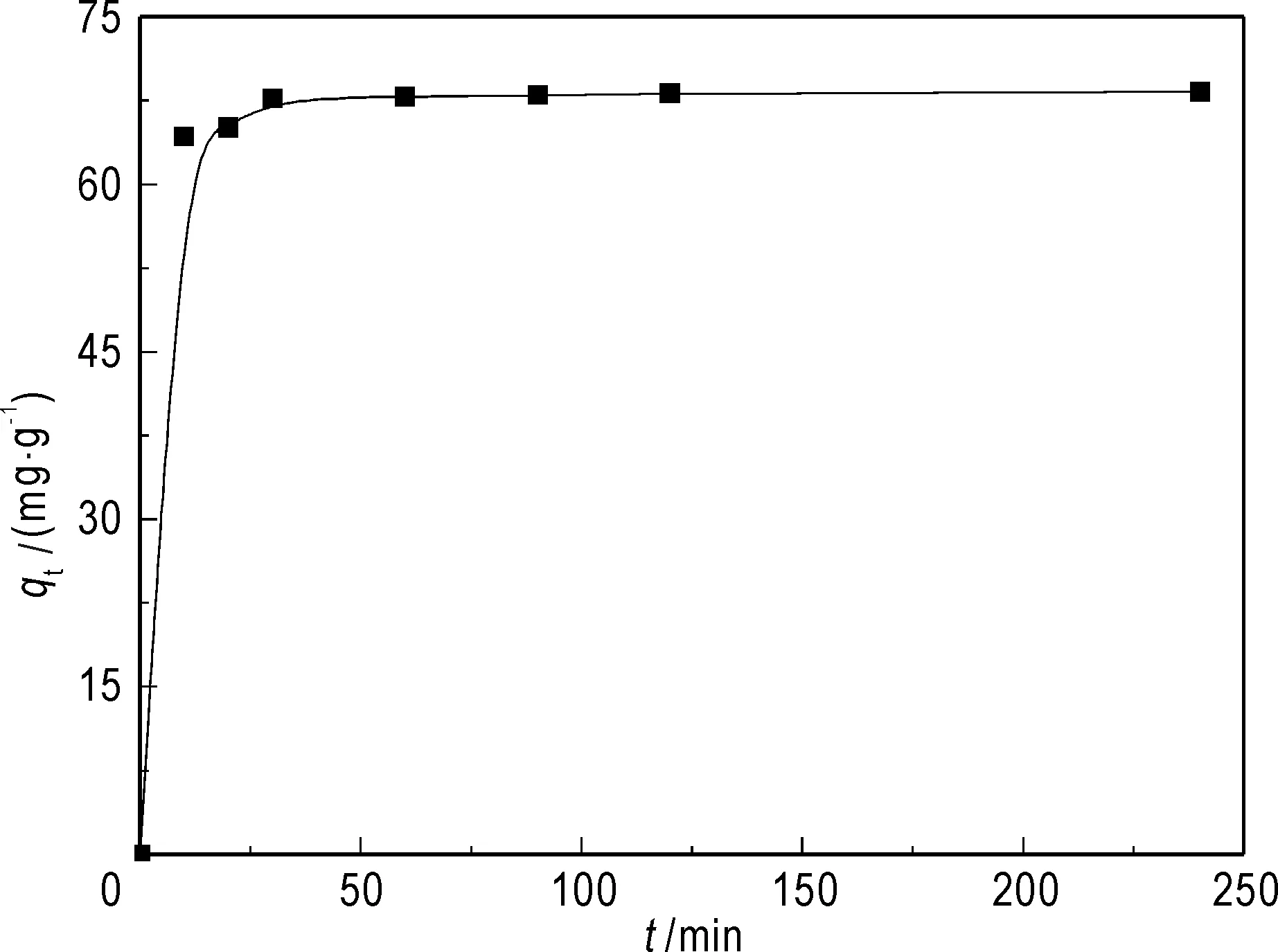
图6 接触时间对吸附的影响Fig.6 Effect of contact time on Th(IV) sorptionpH = 3.0,w=10 mg,V=25 mL, C0=30 mg/L,T=298 K
分别应用准一级动力学和准二级动力学模型对吸附过程的控制机理进行评估。这两种线性形式可分别表示为:
lnv(qe-qt)=lnqe-k1t
(3)
(4)
式中,k1(min-1)和k2(g·mg-1·min-1)分别为准一级及准二级动力学模型的动力学常数等式的常数值,可以通过拟合曲线的斜率和截距得到,结果列于表1。
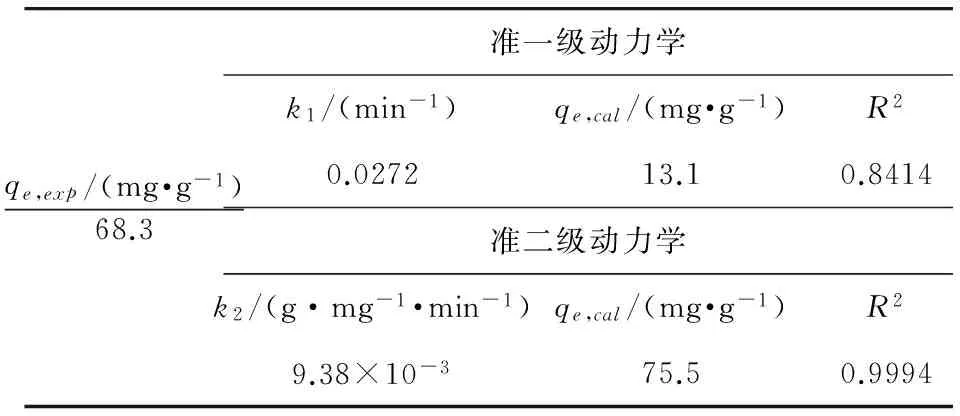
表1 GONRs吸附钍的动力学参数
从表1可以看到,准二级动力学模型的相关系数是最高的,且该模型的理论吸附量qe,cal与实际吸附量qe,exp也是十分接近的。因此可以认为,GONRs对Th(IV)的吸附过程遵循准二级动力学模型。准二级动力学模型是基于这样一个假设,它认为速控步骤是一个化学吸附过程(Li et al.,2014),其中涉及吸附剂与吸附质之间因共用或交换电子导致的价键作用。据此可以认为GONRs对Th(IV)的吸附过程应当是一个化学吸附过程。

表2 GONRs吸附钍的Langmuir和Freundlich模型参数
2.5 钍初始浓度的影响及吸附等温线模拟
图7考察了不同钍初始浓度对吸附的影响,实验中pH选在3.0是为避免钍不可溶物种的产生。随着钍初始浓度的增加,吸附量也不断增加,最终吸附可达平衡。由图7可看出GONRs对钍的最大吸附量为273 mg/g。
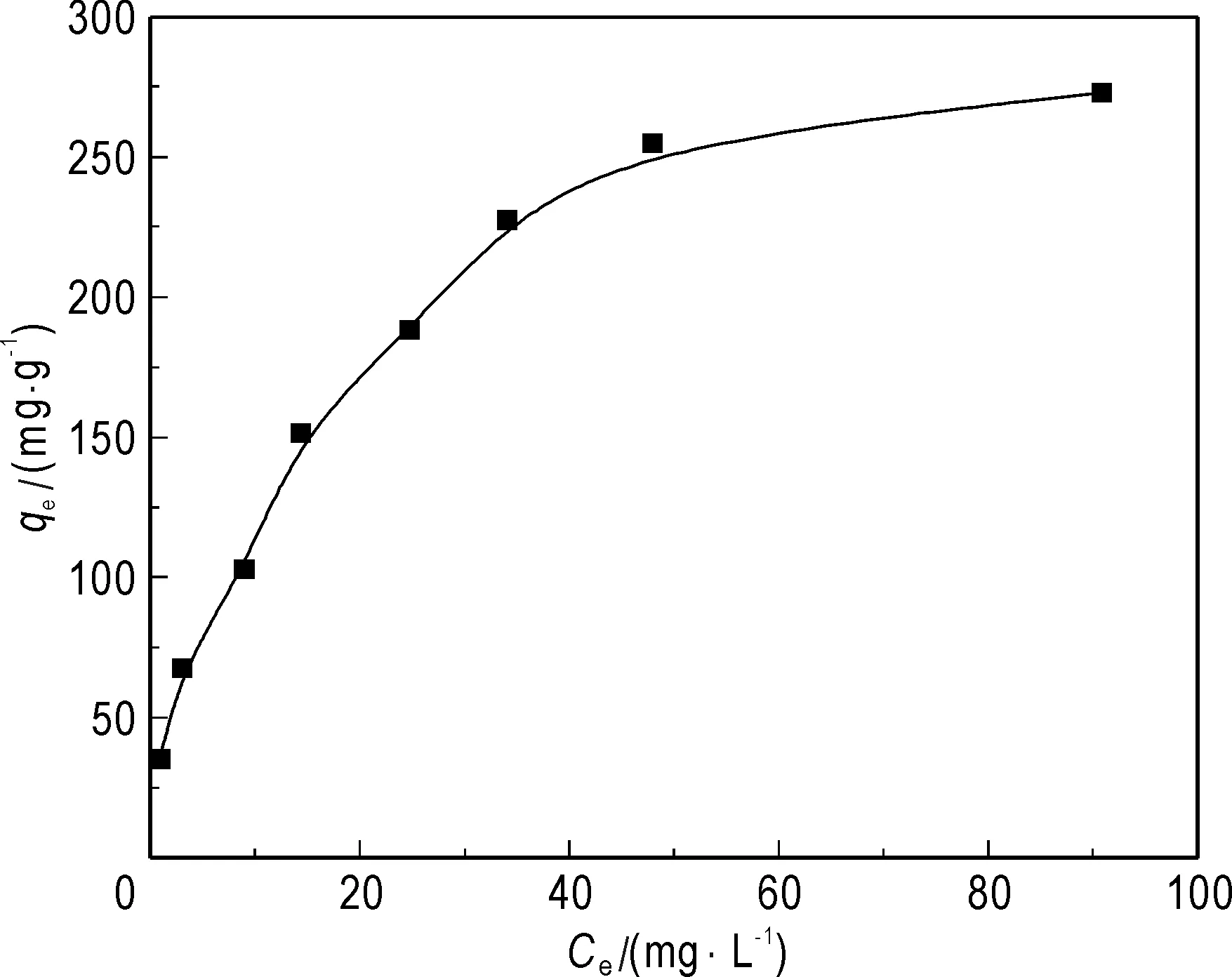
图7 钍初始浓度对吸附的影响Fig.7 Effect of Th(IV) concentration on sorption pH = 3.0, w=10 mg, t=30 min, T=298 K,V=25 mL
对GONRs吸附钍分别使用Langmuir和Freundlich模型进行模拟。Langmuir模型假设为均一表面上的定位吸附,认为每个吸附位点只能容纳一个吸附质分子,为单层吸附:
(5)
Freundlich模型是一个基于非均相表面吸附的经验公式:
(6)
式中,b为平衡常数(L/mg),qm为Langmuir单层吸附的最大吸附量。KF[(mg· g-1) ·(L·mg-1)1/n]和n是在一定范围内表示吸附过程的经验系数。
表2列出了GONRs吸附Th(IV)的Langmuir和Freundlich模型的相关参数。通过对比两种等温模型的相关系数R2可知,GONRs对Th(IV)的吸附符合Langmuir等温模型。此外,Langmuir模型拟合出的理论吸附容量qm与实验所得到的最大吸附量(273 mg/g)更接近,也说明了Langmuir等温模型能更好地描述该吸附过程。这表明Th(IV)在GONRs上的吸附主要是发生在其表面上的单层吸附。
2.6 温度对吸附的影响及其吸附热力学研究
热力学和动力学一样,也是理解吸附机理非常重要的因素。由图8可知,随着温度的升高,GONRs对钍的吸附量也随之增加。这表明高温有利于钍的吸附。
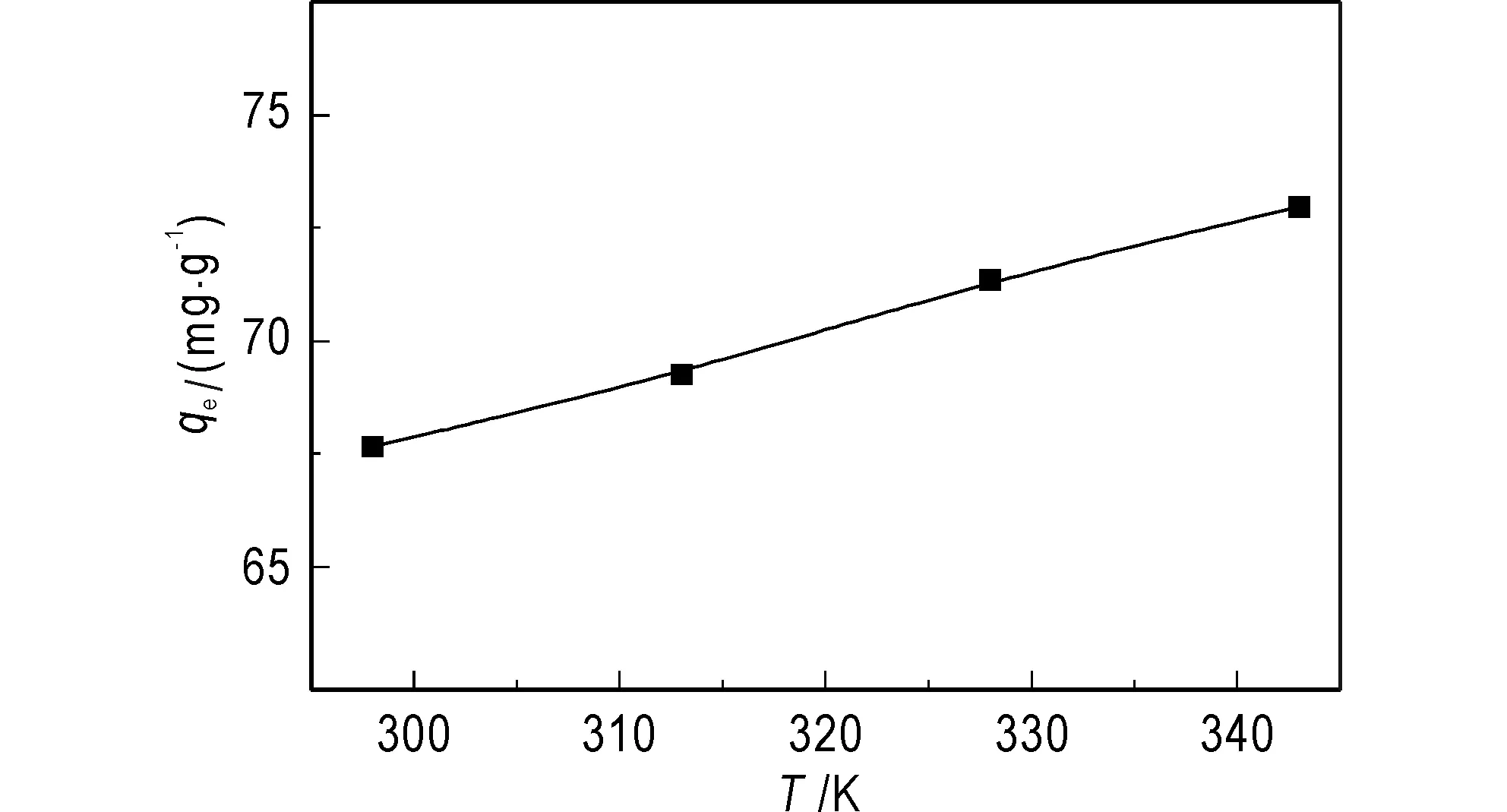
图8 温度对吸附的影响Fig.8 Effect of temperature on the Th(IV) sorptionpH=3.0,w=10 mg,C0=30 mg/L,t=30 min,V=25 mL
热力学参数如焓变(ΔH, kJ·mol-1),熵变(ΔS, J·mol-1·K-1)及吉布斯自由能变化(ΔG, kJ·mol-1)可根据以下方程计算:
(7)
ΔG=ΔH-TΔS

(8)
式中,Kd为分配系数(mL/g),T为绝对温度(K),R为气体常数(8.314 J·mol-1·K-1)。实验数据列于图9和表3中。从热力学参数可知,焓变为正,说明此吸附为吸热反应,较高的温度下对吸附过程较为有利。同时熵变为正,说明吸附剂表面的自由度增加了。吉布斯自由能为负,而且随温度升高,绝对值越来越大,说明该吸附过程为自发的不可逆过程。
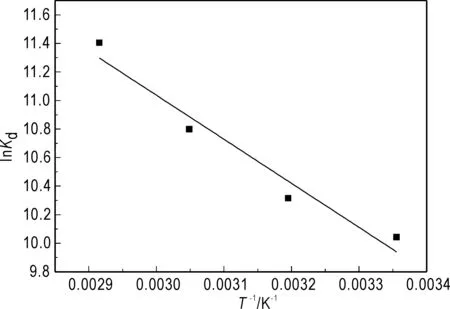
图9 lnKd 随T-1的变化关系Fig.9 Variation of lnKd with T-1
3 结论
(1)SEM,TEM,XRD和FT-IR结果表明,GONR已经被成功地制得,所合成的GONRs为纳米带状结构,含有丰富的含氧官能团。
(2)GONRs对Th(IV)的吸附过程是受pH影响的,不受离子强度影响的,是一个快速、自发、吸热的准二级动力学过程;该吸附符合Langmuir模型,GONRs对钍的最大吸附量为314.3 mg/g。
参考文献
李雪,于梅,唐晓平,等. 2014.Th(IV)在氧化石墨烯上的吸附动力学与热力学[J].核化学与放射化学,36(5): 300-304.
罗明标. 2013.钍的资源化学[M].北京:中国科学技术出版社.
盛国栋,杨世通,郭志强,等. 2012. 纳米材料和纳米技术在核废料处理中的应用研究进展[J].核化学与放射化学, 34(6):321-330.
石秀安, 胡永明. 2011.我国钍燃料循环发展研究[J].核科学与工程,31(3):281-288.
张伟强,马建国,刘淑娟,等. 2014.改性石墨烯海绵材料对铀的吸附研究[J].东华理工大学学报:自然科学版,37(2): 230-235.
Akkaya R. 2013. Uranium and thorium adsorption from aqueous solution using a novel polyhydroxyehtylmethacrylate-pumice composite[J]. Journal of Enviromental Radioactivity,120:58-63.
Atta A M, Akl Z F. 2015. Removal of thorium from water using modified magnetite nanoparticles capped with rosin amidoxime[J]. Mateials Chemistry and Physics,163: 253-261.
Bhainsa K C, D′Souz S F. 2009. Thorium biosorption by Aspergillus fumigatus, a filamentous fungal biomass[J]. Journal of Hazardous Materials,165(1): 670-676.
Castillo-Martínez E, Carretero-González J, Sovich J, et al. 2014. High temperature structural transformations of few layer graphene nanoribbons obtained by unzipping carbon nanotubes[J]. Journal of Materials Chemistry A, 2(1): 221-228.
Hirsch A. 2009. Unzipping carbon nanotubes: a peeling method for the formation of graphene nanoribbons[J]. Angewandte Chemie International Edition, 48: 6594-6596.
Jiao L, Zhang L, Wang X, Diankov G, et al. 2009. Narrow graphene nanoribbons from carbon nanotubes[J]. Nature, 458: 877-880.
Li B, Ma L, Tian Y, et al. 2014. A catechol-like phenolic ligand-functionalized hydrothermal carbon: One-pot synthesis, characterization and sorption behavior toward uranium[J]. Journal of Hazardous Materials,271:41-49.
Lingamdinne L P, Choi Y L, Kim I S, et al. 2017. Preparation and characterization of porous reduced graphene oxide based inverse spinel nickel ferrite nanocomposite for adsorption removal of radionuclides[J]. Journal of Hazardous Materials,326: 145-156.
Liu N, Kim K, Hsu P-C, et al. 2014. Large-scale production of graphene nanoribbons from electrospun polymers[J]. Journal of the American Chemical Society,136(49): 17284-91.
Liu P, Qi W, Du Y, et al. 2014. Adsorption of thorium(IV) on magnetic multi-walled carbon nanotubes[J]. Science China Chemistry,57(11): 1483-1490.
Pan N, Guan D, He T, et al. 2013. Removal of Th4+ions from aqueous solutions by graphene oxide[J]. Journal of Radioanalytical and Nuclear Chemistry,298(3): 1999-2008.
Rafiee M A, Lu W, Thomas A V, et al. 2010. Graphene nanoribbon composites[J]. ACS Nano,4(12): 7415-7420.
Rao T P, Metilda P, Gladis J M. 2006. Preconcentration techniques for uranium(VI) and thorium(IV) prior to analytical determination-an overview[J]. Talanta,68(4): 1047-1064.
Sengupta A, Jayabum S K, Pius I C, et al. 2016. Synthesis, characterization and application of metal oxides impregnated silica for the sorption of thorium[J]. Journal of Radioanalytical and Nuclear Chemistry,309(2): 841-852.
Sinitskii A, Dimiev A, Kosynkin D V. 2010. Tour J M. Graphene nanoribbon devices produced by oxidative unzipping of carbon nanotubes[J]. ACS Nano, 4(9): 5405-5413.
Wang H, Wang Y, Hu Z, et al. 2012. Cutting and unzipping multiwalled carbon nanotubes into curved graphene nanosheets and their enhanced supercapacitor performance[J]. ACS applied materials & interfaces,4(12): 6827-6834.
Wang Y, Wang Z, Gu Z, et al. 2015. Uranium(VI) sorption on graphene oxide nanoribbons derived from unzipping of multiwalled carbon nanotubes[J]. Journal of Radioanalytical and Nuclear Chemistry, 304(3): 1329-1337.
Xu H, Li G,Li Jie, et al. 2016. Interaction of Th(IV) with graphene oxides: Batch experiments, XPS investigation, and modeling[J]. Journal of Molecular Liquids, 213:58-68.
Yousefi S R, Ahmadi S J, Shemirani F, et al. 2009. Simultaneous extraction and preconcentration of uranium and thorium in aqueous samples by new modified mesoporous silica prior to inductively coupled plasma optical emission spectrometry determination[J].Talanta, 80(1): 212-217.
