黑果腺肋花楸水提物对果蝇抗衰老活性的研究
2018-05-15郑丽娜赵大庆赵文学刘钰才王思明
郑丽娜,赵大庆,赵文学,刘钰才,王思明,*
(1.长春中医药大学中医药与生物工程研究开发中心,吉林长春130117;2.吉林省北佳中药集团股份公司,吉林长春130117)
黑果腺肋花楸(Aroniamelanocarpa)系蔷薇科腺肋花楸属多年生落叶灌木,营养含量丰富,因其具有抗氧化、抗炎、降血糖等多种生物学活性而被广泛关注[1-2]。已有研究表明,黄酮及酚酸类化合物在黑果腺肋花楸果实中含量极高,成为其药理活性作用物质基础研究的主要成分[3-6]。花青素(Anthocyanin)属于黄酮类化合物,是一类天然水溶性色素,广泛分布于植物的果实中[7-8]。其安全性高,具有多种保健功能,以抗氧化作用最为显著,被称为“口服的皮肤化妆品”,可为机体补充营养并且及时清除体内自由基[9]。然而,截至目前,花青素功能活性研究仍处于起步阶段,体内研究严重匮乏,限制了其在医药和保健食品中的应用。因此,本研究对黑果腺肋花楸进行水提取,并对其中花青素含量进行检测,以黑腹果蝇(Drosophilamelanogaster)为体内研究对象,研究黑果腺肋花楸水提物对果蝇寿命、抗氧化相关指标以及氧化损伤下果蝇存活时间的影响,探讨其体内抗氧化活性以及对自由基的清除作用,旨在为黑果腺肋花楸功能性开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑果腺肋花楸:由吉林省北佳中药集团股份公司提供,经长春中医药大学生物工程实验室白雪媛副研究员鉴定为蔷薇科黑果腺肋属黑果腺肋花楸;黑果腺肋花楸水提物:由长春中医药大学生物工程实验室提供。
1.1.2 试剂
考马斯亮蓝蛋白测定试剂盒(P4907)、过氧化氢酶(catalase,CAT)测定试剂盒(96T)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(100 T/96样)、丙二醛(malondialdehyde,MDA)测定试剂盒(96 T):南京建成生物工程研究所;百草枯(C10088960):MACKLIN;30%过氧化氢(1601191):西陇化工股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SZ660连续变倍体式显微镜:重庆奥特光学仪器有限公司;m3x-430智能霉菌培养箱:浙江托普仪器有限公司;UV2550紫外分光光度计:日本岛津公司;InfiniteM200PR0全自动酶标仪:TECAN。
1.3 动物
实验所用Oregon K野生型黑腹果蝇由长春中医药大学生物工程研究室提供。收集8 h内羽化未交配雄性果蝇,培养温度(25±1)℃,相对湿度50%~60%培养箱中培养。果蝇寿命实验培养温度(29±1)℃,相对湿度50%~60%。
1.4 方法
1.4.1 黑果腺肋花楸水提取指标性成分花青素含量测定
采用pH示差法测定黑果腺肋花楸水提物中花青素含量。吸取1.00mL黑果腺肋花楸水提物,实验组1将其用pH=1.0的缓冲液稀释100倍,实验组2用pH=4.5的缓冲液稀释100倍,混匀,放置70min,待反应至动态平衡。两实验组均以1.00mL 60%酸性乙醇提取液(乙醇含0.2%盐酸的溶液[10-11])加入等量缓冲液作空白对照。用紫外-可见分光光度计于510nm和710nm处测定吸光度值。根据花青素含量计算公式计算花青素含量,公式如下:

式中:A为吸光度值;Mt为矢车菊-3-葡萄糖苷相对分子质量449.2;DF为稀释倍数;V为提取液总体积,mL;e为矢车菊素-3-葡萄糖苷消光系数29 600;b为比色光程长度1 cm;m为试样质量,g。
1.4.2 果蝇培养基的制备
称取玉米粉175 g,黄豆粉30 g及琼脂粉20 g,加入3 L纯净水充分搅拌溶解。保持沸腾状态30min后加入60 g安琪酵母粉,50 g蔗糖,50 g葡萄糖,充分混匀后继续加热煮沸。随后量取90mL甘蔗糖浆加入容器中,冷却20min,加入10%的尼泊金甲酯40mL及丙酸20mL制成普通培养基。在普通培养基的基础上,分别加入不同体积的黑果腺肋花楸水提液,配成1、5、10mg/mL的含药培养基。
1.4.3 果蝇寿命实验
将培养于29℃培养箱中的2日龄果蝇随机分成4组,对照组接入普通培养基中,给药组接入含黑果腺肋花楸水提物培养基中(1、5、10mg/mL)。每组10管,每管20只。每2天记录果蝇死亡数,每3天更换1次培养基,直至果蝇全部死亡。每组果蝇全部死亡天数平均数为该组平均寿命,每组果蝇半数死亡天数为该组半数死亡时间,每组最后死亡的20只果蝇存活天数的平均数为该组的最高寿命。
1.4.4 急性损伤模型果蝇存活实验
1.4.4.1 百草枯急性试验对果蝇存活时间的影响
果蝇分组情况同1.4.3。培养25 d后,将果蝇转入空培养管中饥饿2 h,随后将果蝇转入事先放有蘸取1mL 6%的葡萄糖溶液配制成的20mmol/L的百草枯溶液滤纸条的培养管中,每隔4小时统计果蝇死亡只数,直至全部死亡。记录每组果蝇的平均存活时间、半数存活时间以及最高存活时间。
1.4.4.2 双氧水急性试验对果蝇存活时间的影响
果蝇分组情况同1.4.3。培养25 d后,将果蝇转入空培养管中饥饿2 h,随后将果蝇转入事先放有蘸取1mL 6%的葡萄糖溶液配制成的9%H2O2滤纸条的培养管中,每隔4小时统计果蝇死亡只数,直至全部死亡,记录每组果蝇的平均存活时间、半数存活时间以及最高存活时间。
1.4.5 果蝇SOD、CAT活性及MDA含量测定
果蝇分组情况同1.4.3。培养25 d后,先将果蝇转入空培养管中饥饿2 h,麻醉后称重,按体积比1∶49比例加入生理盐水,冰浴下匀浆,4℃2 500 r/min离心20min取上清用试剂盒测定CAT、SOD活性以及MDA含量。
1.4.6 数据处理
除黑果花楸中花青素含量测定数据以外,其余数据均以±s表示,组间比较行t检验。
2 结果与分析
2.1 黑果腺肋花楸水提物指标性成分花青素含量测定
用紫外-可见分光光度计对实验组及空白对照组溶液在510 nm和710 nm处测定其OD值,根据公式计算黑果腺肋花楸水提物中花青素含量,结果为(3.4±0.2)mg/g,与目前报道的其他含有高含量花青素的蓝莓等相比结果相差无几[12],详见表1。

表1 黑果腺肋花楸水提物中花青素的含量Table1 Contentsof anthocyanin in aqueousextractof Aroniamelanocarpa
2.2 对果蝇寿命的影响
与对照组相比,黑果腺肋花楸水提物高剂量组平均寿命延长率为11.24%,最高寿命延长率为3.95%,与对照组相比均存在显著差异,详见表2。
2.3 对百草枯急性试验果蝇存活时间的影响
与对照组相比,黑果腺肋花楸水提物中、高剂量组平均存活时间约延长了2 h;最高存活时间分别延长了 0.3、3.0、3.2 h,延长率分别为 1.04%、10.45%、11.14%,其中、高剂量组变化显著(p<0.05),见表 3。
表2 黑果腺肋花楸水提物对果蝇寿命的影响(±s,n=200)Table2 Effectsofaqueousextract from Aroniamelanocarpa on the Lifeof Drosophilamelanogaster(±s,n=200)

表2 黑果腺肋花楸水提物对果蝇寿命的影响(±s,n=200)Table2 Effectsofaqueousextract from Aroniamelanocarpa on the Lifeof Drosophilamelanogaster(±s,n=200)
注:* 表示 p<0.05,显著;** 表示 p<0.01,极显著。
组别剂量/(mg/mL)平均寿命/d半数死亡时间/d 最高寿命/d对照 0 33.8±11.1 35.0 45.6±3.1水提物 1.0 34.8±11.9 38.0 46.5±3.0 5.0 37.0±12.9** 38.0 47.0±3.7 10.0 37.6±11.7** 41.0* 47.4±4.1*
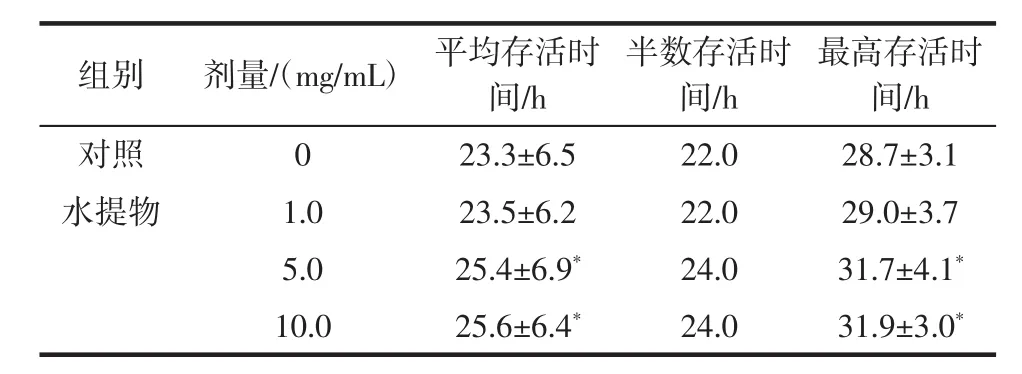
表3 黑果腺肋花楸水提物对百草枯急性实验果蝇存活时间的影响(x±s,n=200)Table3 Effectsofaqueousextract from Aroniamelanocarpa on the Drosophilamelanogaster lifeof paraquatacuteexperimental(x±s,n=200)
2.4 对过氧化氢急性试验果蝇存活时间的影响
与对照组相比,黑果腺肋花楸水提物中、高剂量组平均存活时间延长了约1 h。最长存活时间分别延长了3.6、4.8 h,延长率分别10.46%,13.95%,具有统计学意义(p<0.05),见表 4。
表4 黑果腺肋花楸水提物对过氧化氢急性实验果蝇存活时间的影响(±s,n=200)Table4 Effectsofaqueousextract from Aroniamelanocarpa onthe Drosophilamelanogaster Lifeofhydrogen peroxideacute experimental(± s,n=200)

表4 黑果腺肋花楸水提物对过氧化氢急性实验果蝇存活时间的影响(±s,n=200)Table4 Effectsofaqueousextract from Aroniamelanocarpa onthe Drosophilamelanogaster Lifeofhydrogen peroxideacute experimental(± s,n=200)
注:* 表示 p<0.05,显著。
最高存活时间/h对照 0 21.8±6.3 22.0 29.0±3.2水提物 1.0 22.2±6.2 22.0 30.0±2.7 5.0 23.0±6.5* 23.0 31.3±3.1*10.0 23.3±6.4* 23.0 31.6±3.0*组别剂量/(mg/mL)平均存活时间/h半数存活时间/h
2.5 对相关果蝇抗氧化酶活力及MDA水平的影响
与对照组相比,黑果腺肋花楸水提物各剂量组均能提高CAT,SOD活性,降低MDA含量(p<0.05或p<0.01),且与药物添加量呈现一定的剂量关系,详见表5。
表5 黑果腺肋花楸水提物对果蝇抗氧化酶活力及MDA水平的影响(±s,n=3)Table5 Effectsof aqueousextractof Aroniamelanocarpa on antioxidantenzymeactivity and MDA levelof Drosophila melanogaster(±s,n=3)

表5 黑果腺肋花楸水提物对果蝇抗氧化酶活力及MDA水平的影响(±s,n=3)Table5 Effectsof aqueousextractof Aroniamelanocarpa on antioxidantenzymeactivity and MDA levelof Drosophila melanogaster(±s,n=3)
注:* 表示 p<0.05,显著;** 表示 p<0.01,极显著。
MDA/(U/mg pro)对照 0 234.58±18.67 68.54±5.12 1.04±0.37水提物 1.0 265.26±16.23* 71.25±5.75* 0.98±0.41组别 剂量/(mg/mL)SOD/(U/mg pro)CAT/(U/mg pro)5.0 367.12±16.17** 76.56±3.12** 0.93±0.32*10.0 394.34±14.12** 85.41±3.75** 0.64±0.38*
3 讨论
寿命是衡量生命衰老规律的重要指标[13]。但大鼠等常用哺乳类模式生物存在生命周期较长、不易于重复等问题,限制了相关实验的研究进展。近年来,果蝇已经成为模拟人类疾病很重要的模式生物,具有生命周期短、繁殖能力强、饲养简单等优点,遗传学分析显示在哺乳动物和非脊椎动物中基本的细胞生物学信号通路(signaling transduction pathway)存在惊人的保守性[14],这些特点使得它们可以成为理想且精良的模式生物。花青素是在水果和蔬菜中大量存在的天然黄酮类物质,其能保护人体免受自由基损伤。近年来,花青素对于抗氧化性、抗衰老性等有较多的研究报道,其药理活性功能广泛,安全性高,应用前景大。花青素的提取及理化性质研究已取得了很大的进步,但其生理功能活性及机制研究仍处于起步阶段。因此,本研究首先对黑果腺肋花楸提取物中的花青素含量进行检测,在此基础上,以黑腹果蝇为研究对象,以雄性寿命作为评价指标,研究黑果腺肋花楸水提物的抗衰老活性。研究周期短,重现性好,数据可信度高。结果表明:黑果腺肋花楸水提物能显著延长雄性果蝇的平均寿命和平均最高寿命,且具有一定的剂量效应。百草枯在细胞内形成的过量超氧化阴离子自由基和双氧水产生的羟自由基可诱导果蝇产生氧化损伤。在本研究中,黑果腺肋花楸水提物能够显著提高果蝇耐受能力,延长存活时间,表明黑果腺肋花楸水提物对于清除超氧阴离子自由基和羟自由基具有一定的作用。SOD和CAT作为体内清除活性氧的主要抗氧化酶被认为是反应体内自由基清除能力的间接评价指标[15]。而MDA是自由基作用于不饱和脂肪酸而产生的脂质过氧化的产物,通常作为机体脂质过氧化程度的指标[16]。研究结果表明黑果腺肋花楸水提物能够提高果蝇体内SOD及CAT酶活性,同时可降低MDA含量,且存在一定的剂量效应。综上所述,黑果腺肋花楸水提物中花青素含量较高,且其抗衰老作用是通过提高体内相关抗氧化酶活性从而增强自由基清除能力而实现的。
参考文献:
[1]Leslaw Juszczak,Mariusz Witczak,Dorota Galkowska.Flow Behaviourof Black Chokeberry(Aroniamelanocarpa)Juice[J].国际食品工程期刊,2009,5(1):161-167
[2]Dorota Walkowiak-Tomczak.Changes in antioxidant activity of black chokeberry juice concentrate solutions during storage[J].Acta Scientiarum Polonorum:Technologia Alimentaria,2007,6(2):49-56
[3]国石磊.黑果腺肋花楸花色苷分离纯化、结构鉴定及其抗氧化活性研究[D].秦皇岛:河北科技师范学院,2015
[4]于雪,胡文忠,姜爱丽,等.黑果腺肋花楸营养物质与功效的研究进展[J].食品工业科技,2016,34(10):396-400
[5]陈妍竹,胡文忠,姜爱丽,等.黑果腺肋花楸功能作用及食品加工研究进展[J].食品工业科技,2016,36(9):397-400
[6]国石磊,朱凤妹,王娜,等.黑果腺肋花楸花色苷树脂纯化工艺及其稳定性研究[J].天然产物研究与开发,2015,33(9):1636-1642
[7]徐春明,庞高阳,李婷.花青素的生理活性研究进展[J].中国食品添加剂,2013(3):205-210
[8]侯锐,陈琦,王利,等.花青素及其生物活性的研究进展[J].现代生物医学进展,2015,28(15):5590-5593
[9]Zhao JG,Yan QQ,Lu LZ,et al.In vivo antioxidant,hypoglycemic,and anti-tumor activities ofanthocyanin extracts from purple sweet potato[J].Nutr ResPract,2013,7(5):359-365
[10]王绍云,李性苑,潘永银,等.响应面法优化透骨香果花青索超声一振荡提取工艺[J].中国食品添加剂,2017(4):127-133
[11]张荣菲,王绍云.贵州黔东南蓝莓中花青素的提取与含量测定[J].中国食品添加剂,2016(11):190-194
[12]石桂珍,李京东,张玉清,等.蓝莓花青素的提取及含量分析[J].食品研究与开发,2016,37(14):55-58
[13]杜丽娟,汪庆平,邵金良,等.响应面法对黑果构祀中花青素测定条件的优化[J].中国食物与营养,2016,22(6):50-54
[14]Calhoun AJ,Murthy M.Quantifying behavior to solve sensorimotor transformations:advances from worms and flies[J].Curr Opin Neurobiol,2017,30(46):90-98
[15]Moris D,Spartalis M,Tzatzaki E,et al.The role of reactive oxygen species inmyocardial redox signaling and regulation[J].Ann Transl Med,2017,5(16):324-332
[16]Zhou Q,Zhu L,ZhangD,etal.Oxidative Stress-Related Biomarkers in Postmenopausal Osteoporosis:A Systematic Reviewand Meta-Analyses[J].DiseaseMarkers,2016,2016(3):1-12
