红河州13种食用花卉的总黄酮、总多酚含量测定
2018-05-15严和平洪亮徐进诺罗玉芹陈雅顺许春欧朝凤张举成
严和平,洪亮,徐进诺,罗玉芹,陈雅顺,许春,欧朝凤,张举成,*
(1.红河学院理学院,云南蒙自661199;2.云南省天然药物与化学生物学重点实验室,云南蒙自661199;3.红河学院生命科学与技术学院,云南蒙自661199;4.浙江环茂自控科技有限公司,浙江杭州310051)
云南拥有中国二分之一的植物资源,是植物资源极为丰富的“天然花园”。云南省东南部的红河哈尼族彝族自治州居民多有食用花卉的习惯,刘怡涛[1]在2001年首次全面报道了云南经常食用的花卉种类有303种之多。事实上,作为植物精华的鲜花除了食用价值外,还具有观赏和药用价值。花卉中含有的丰富的黄酮[2-3]、多酚类物质[4]氨基酸、微量元素、维生素等物质[5],受到保健食品开发者的青睐。其中的多酚类和黄酮类化合物在抗氧化、抗菌、抗病毒、抗微生物、抗肿瘤、调血脂和降血糖[6-13]等多方面具有良好的效果,从而对人的身体健康起到一定程度的保护作用。红河州食用花卉种类繁多,由于缺乏现代科学试验分析,得到开发利用的却是凤毛麟角。本文对云南省红河州居民经常食用的13种花卉中的总黄酮和总多酚含量进行了测定,以期为云南省红河州地区食用花卉的深度利用和新型天然功能食品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
金雀花(Caragana sinica)、苦刺花(学名:白刺花,Sophora davidii)、桂花 (学名:木犀,Osmanthus fragrans)、石榴花(Punica granatum)、芭蕉花(Musa sapientum)、菊花(Chrysanthemummorifolium)、马桑花(学名:桑椹,Morus alba)、棠梨花(Pyrus pashia)、黄饭花(学名:密蒙花,Buddleja officinalis)、玉荷花(学名:羊蹄甲,Bauhinia purpurea)、鸡屎臭药花(学名:缬草,Valeriana officinalis)、帘子藤花(学名:威灵仙,Clematis chinensisOsbeck)、猫屎花(学名:鼠麴草,Gnaphalium affine):所用花卉均由菜市场采购。
1.1.2 试剂
芦丁标准品(纯度≥98%)、一水合没食子酸标准品(纯度>99%):阿拉丁试剂有限公司;Folin-phenol试剂:国药集团化学试剂有限公司;乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为分析纯:国药集团化学试剂有限公司;水为娃哈哈纯净水:浙江娃哈哈饮用水有限公司。
1.2 仪器与设备
TU-1950双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;DHG-9145A电热恒温鼓风干燥箱、THZ-100恒温培养摇床:上海一恒科学仪器有限公司;OSB-2100恒温水浴锅:上海安亭科学仪器厂;AR1140电子分析天平:梅特勒-托利多国际贸易(上海)有限公司;DY-300粉碎机:南阳东亿机械设备有限公司;Brand移液枪:德国Brand公司。
1.3 方法
1.3.1 样品制备
13种花卉分别在60℃烘干至恒重,经粉碎过200目筛,低温、避光、密封储存备用。平行精密称取3份1.000 g研磨好的各种花的粉末于150mL圆底烧瓶中,加入 80%的乙醇溶液,料液比 1∶20(g/mL),80℃恒温水浴浸提160min,过滤,滤液用60%的乙醇溶液定容至50mL,待测。
1.3.2 含量测定
1.3.2.1 总黄酮含量测定
总黄酮含量采用双波长分光光度法进行测定[14-15]。准确量取一定量样液于10mL比色管中,分别加入质量分数5%亚硝酸钠溶液和10%硝酸铝溶液各0.2mL,摇匀,放置6min,再加入质量分数4%氢氧化钠溶液2.0mL,加水定容至5mL,络合反应15min,在510 nm和584 nm条件下测定。同时进行空白实验。总黄酮提取率(以芦丁计,%)的计算公式为(1)式。

式中:C为测试样品液的黄酮质量浓度,μg/mL;V

式中:C为测试样品液的多酚浓度,μg/mL;V为提取液总体积,mL;K为提取液稀释倍数;m为样品质量,g。
1.3.3 标准曲线绘制
1.3.3.1 芦丁标准曲线绘制
精密称取芦丁标准品10mg,用60%乙醇溶解并定容至100mL容量瓶中,制成100μg/mL的储备液。分别精密吸取 0、0.10、0.20、0.40、0.80、1.20、1.60mL 的储备液于比色管中,加60%乙醇至10 mL,按照“1.3.2.1”的方法,测定波长510、584 nm条件下的吸光度值,得到吸光度差值△A=A510nm-A584nm,以芦丁浓度(x)为横坐标,吸光度差值△A(y)为纵坐标,绘制芦丁标准曲线,得到芦丁的标准曲线回归方程为y=16.149x+0.000 5(R2=0.999 2),表明芦丁标准溶液在 0~32 μg/mL范围内,浓度与吸光度差值呈良好的线性关系。
1.3.3.2 没食子酸标准曲线绘制
精密称取干燥的没食子酸标准品2.5mg,蒸馏水溶解并定容至10mL,制成250μg/mL的储备液,再准确移取1.00mL储备液定容至10mL,制成25μg/mL的没食子酸标准溶液。分别精密吸取25μg/mL没食子酸标准溶液 0、0.10、0.20、0.40、0.80、1.20、2.00 mL,按照“1.3.2.2”的方法,测定波长765nm条件下的吸光度值。以没食子酸标准溶液浓度为X轴,吸光度为Y轴,建立没食子酸吸光度(Y)与标准品浓度(X)之间的线性回归方程:y=128.48x+0.029 26(R2=0.998 2),表明没食子酸标准溶液在0~10μg/mL范围内,浓度与吸光度呈良好的线性关系。为提取液总体积,mL;K为提取液稀释倍数;m为样品质量;g。
1.3.2.2 总多酚含量测定
依据GB/T 8313-2008《茶叶中茶多酚和儿茶素类含量的检测方法》中多酚的测定方法,在765 nm处有最大吸收波长,利用紫外分光光度法测定食用花卉提取液中总多酚含量。总多酚含量(以没食子酸计,%)的计算公式为(2)式。
2 结果与讨论
2.1 试验条件优化结果
2.1.1 黄酮测定条件优化结果
2.1.1.1 5%亚硝酸钠溶液的体积对黄酮含量的影响
分别取 5%亚硝酸钠溶液 0.1、0.2、0.3、0.4mL 加入到体系中,按上述“1.3.2.1”的方法进行测定,结果见图1。
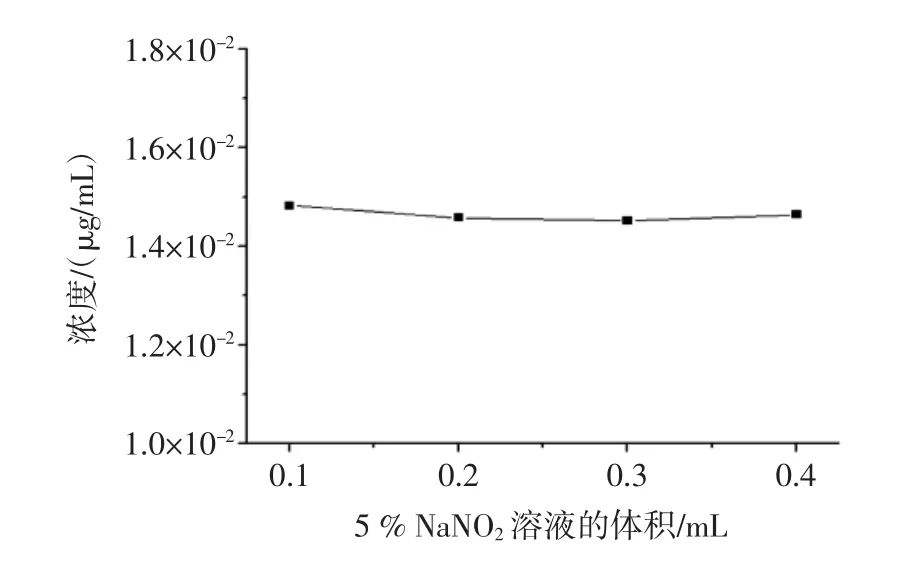
图1 5%亚硝酸钠溶液的体积对黄酮含量的影响Fig.1 Effectof the volum eof 5%NaNO2 solution on the flavones content
图1 表明:当5%亚硝酸钠溶液的体积在0.1mL~0.4mL之间时,测量体系的相对标准偏差为0.915%,即5%亚硝酸钠溶液的体积在0.1mL~0.4mL之间时,对试验结果影响不大,结合参考文献[14],选择测定时5%亚硝酸钠溶液用量为0.2mL。
2.1.1.2 10%硝酸铝溶液的体积对黄酮含量的影响
分别取 0.1、0.2、0.3、0.4mL 10%硝酸铝溶液加入体系中,按上述“1.3.2.1”项的方法进行测量,结果见图2。
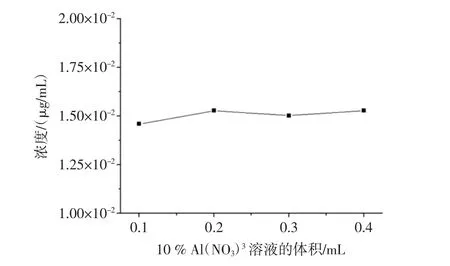
图2 10%硝酸铝溶液的体积对黄酮含量的影响Fig.2 Effectof the volum eof 10%A l(NO3)3 solution on the flavones content
图2 表明:体系中10%硝酸铝溶液体积的加入量从0.1mL增加至0.2mL时,黄酮检出量也逐渐增加;体积从0.2mL增加至0.4mL时,对黄酮的检测影响不大,体系的相对标准偏差为0.943%,结合参考文献[14],选择测定时10%硝酸铝溶液用量为0.2mL。
2.1.1.3 4%氢氧化钠溶液的体积对黄酮含量的影响
分别取1.0、1.5、2.0、2.5mL 4%氢氧化钠溶液加入体系中,按上述“1.3.2.1”项的方法进行测量,结果见图3。
图3表明:体系中4%氢氧化钠溶液体积的加入量从1.0mL增加至1.5mL时,黄酮检出量也逐渐增加;体积从1.5mL增加至2.5mL时,对试验结果影响不大,体系的相对标准偏差为0.469%,结合参考文献[14],选择测定时4%氢氧化钠溶液用量为2.0mL。
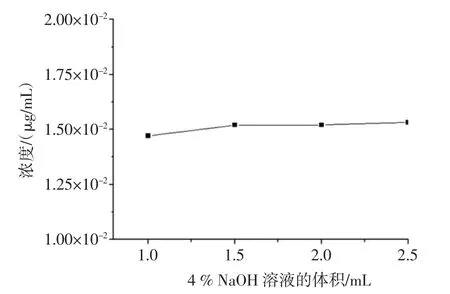
图3 4%氢氧化钠溶液的体积对黄酮含量的影响Fig.3 Effectof thevolumeof4%NaOH solution on the flavones content
2.1.2 多酚测定条件优化结果
2.1.2.1 15%碳酸钠溶液的体积对多酚含量的影响
按“1.3.2.2”的方法,没食子酸标准溶液0.4mL,显色剂 Folin-phenol为 0.2mL,分别加入 0.1、0.2、0.3、0.4、0.5、0.8、1.0、1.2mL 15%碳酸钠溶液,避光反应 1.5 h,在765 nm测定吸光度,结果见图4。
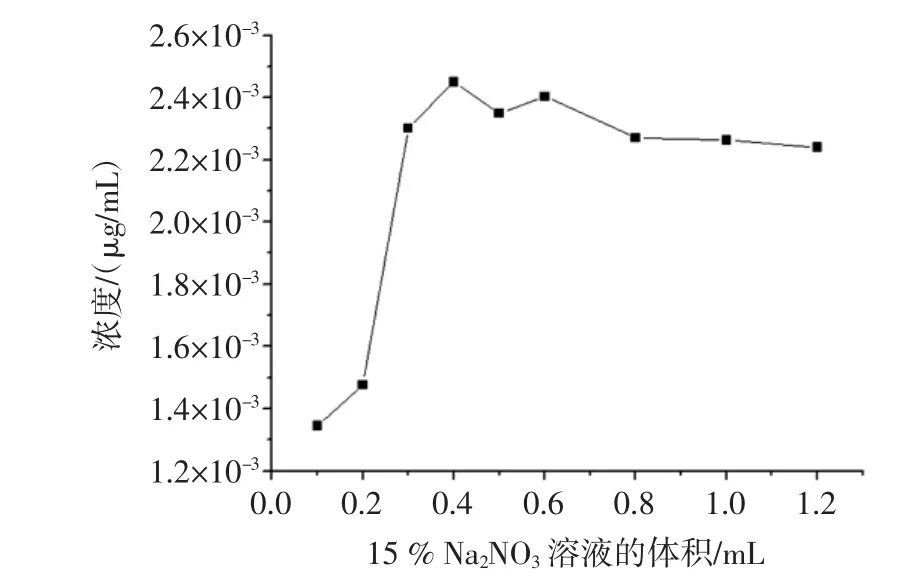
图4 15%碳酸钠溶液的体积对多酚含量的影响Fig.4 Effectof the volum eof 15%Na2CO3 solution on the polyphenols content
由图4可知:15%碳酸钠溶液用量从0.1mL增加至0.4mL时,没食子酸的检出量逐渐增加,15%碳酸钠溶液用量为0.4mL时浓度值最高,之后,15%碳酸钠溶液用量从0.4mL增加至1.2mL时,没食子酸的检出量都比0.4mL用量时小,因此本试验15%碳酸钠溶液用量选用0.4mL。
2.1.2.2 Folin-phenol试剂的体积对多酚含量的影响
按“1.3.2.2”的方法,没食子酸标准溶液0.4mL,15%碳酸钠用量 0.8mL,分别加入 0.1、0.2、0.3、0.4、0.5、0.6、0.7mLFolin-phenol试剂,避光反应 1.5 h,在765 nm测定吸光度,结果见图5。
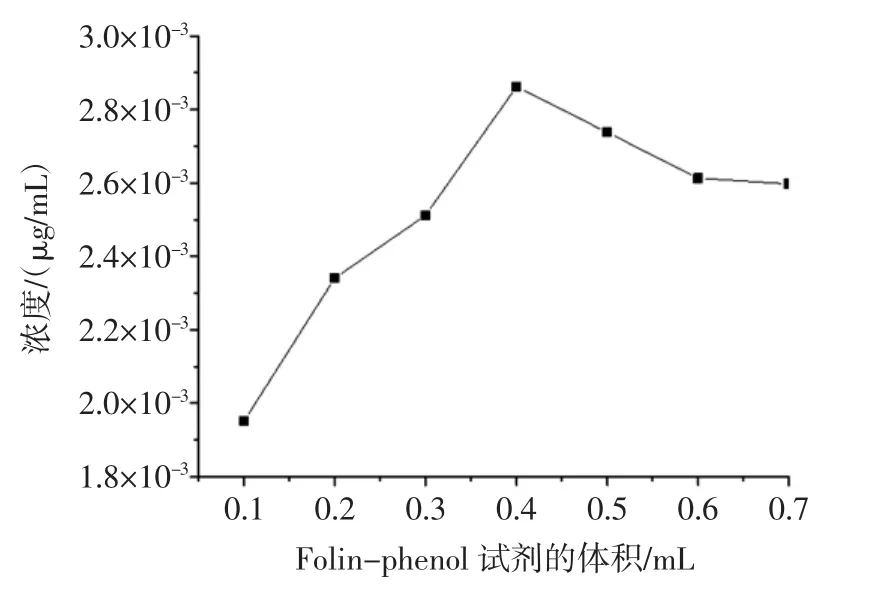
图5 Folin-phenol试剂的体积对多酚含量的影响Fig.5 Effectof thevolumeof Folin-phenolagenton the polyphenolscontent
由图5可知:Folin-phenol试剂用量从0.1mL增加至0.4mL时,没食子酸的检出量增大,Folin-phenol试剂用量为0.4mL时达到最高,之后,Folin-phenol试剂用量从0.4mL增加至0.7mL时,没食子酸检出量逐渐减小,因此本实验Folin-phenol试剂用量选用0.4mL。
以后的样品均在0.4mL 15%碳酸钠溶液、0.4mL Folin-phenol试剂的条件下进行测定。
2.2 稳定性试验
2.2.1 总黄酮测定的稳定性试验
按“1.3.2.1”的方法配制好待测体系后,在 5、10、15、20、25、30、35、40、45、60、90、120、150、180min 时测定,结果见图6。

图6 总黄酮的稳定性实验结果Fig.6 The resultsof stability experim entof total flavonoids
从图6得出,随反应时间从5min增加到180min,体系在510 nm和584 nm处的吸光度差值逐渐下降,提示黄酮检出量在下降,15min后测定结果的RSD值大于5%,说明总黄酮反应体系在15min内稳定,以后样品均在反应15min的条件下进行测定。
2.2.2 总多酚测定的稳定性试验
按“1.3.2.2”的方法配制好待测体系后,在10、20、30、40、50、60、90、120、150min 时测定,60min 内间隔10min测定一次,60min后间隔30min测定一次,结果如图7。
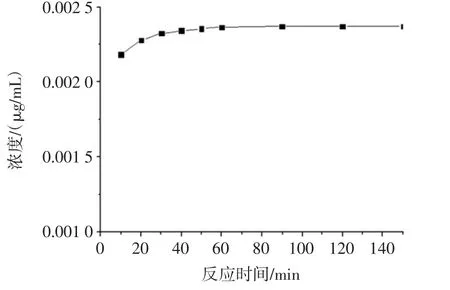
图7 总多酚的稳定性实验结果Fig.7 The resultsof stability experimentof totalpolyphenols
从图7得出,在0到60min以内,该反应体系的多酚检出量一直上升,在90min后基本保持不变,在150min内测定结果的RSD为2.67%,表明该方法在1.5 h内稳定性较好,以后样品均在反应1.5 h的条件下进行测定。
2.3 方法精密度试验
分别取一定量的芦丁和没食子酸标准溶液,按试验条件优化结果,各平行试验5次,结果见表1。

表1 精密度试验结果Table1 The precision experimental results
黄酮和多酚检测结果的相对标准偏差(RSD)分别为3.76%和4.27%,表明该检测方法的精密度良好。
2.4 样品含量测定
2.4.1 食用花卉中总黄酮含量测定
每种花卉粉末样品称取1.000 g,平行3次,并按“1.3.1”的方法制备样品液,取一定体积的样液按“1.3.2.1”的方法测定,同时进行空白试验,结果见表2。

表2 13种食用花卉的总黄酮和总多酚含量Table2 Total flavonesand totalpolyphenolscontents in 13 types edible flowers
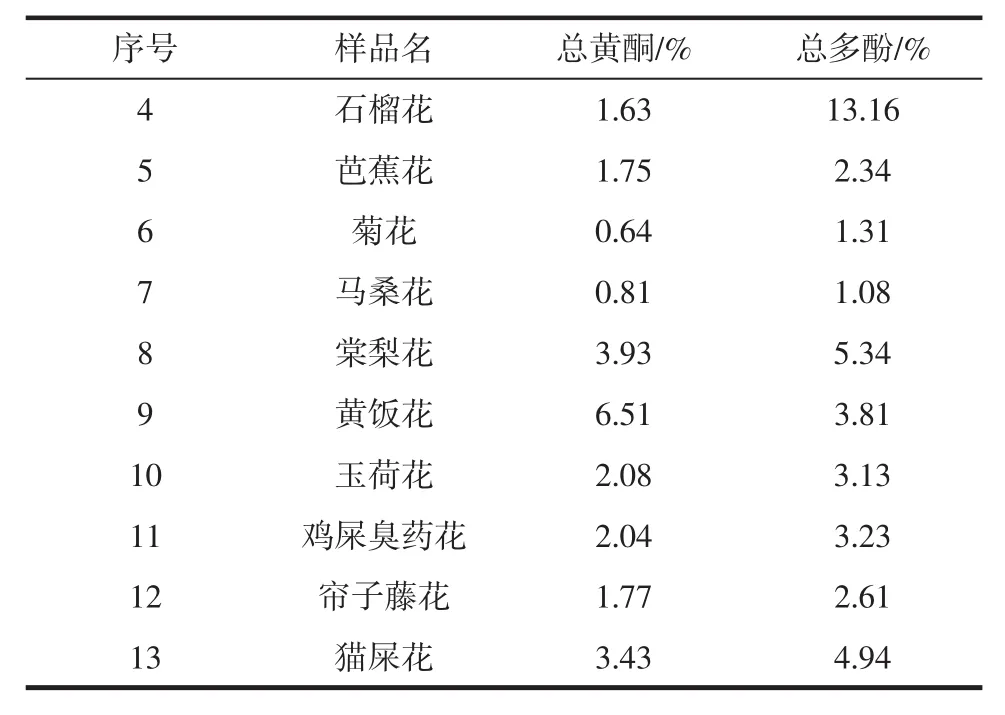
续表2 13种食用花卉的总黄酮和总多酚含量Continue table2 Total flavonesand totalpolyphenols contents in 13 typesedible flowers
由表2可知:13种食用花卉总黄酮含量顺序是:桂花>黄饭花>棠梨花>猫屎花>玉荷花>鸡屎臭药花>帘子藤花>芭蕉花>石榴花>马桑花>菊花>金雀花>苦刺花。13种食用花卉的总黄酮含量差别较大,含量最高的是桂花,为23.93%;含量最低的是苦刺花,为0.22%,两者总黄酮含量相差一百倍之多。
经大量文献检索表明,红河州13种食用花卉中,苦刺花、马桑花、棠梨花、鸡屎臭药花、猫屎花的总黄酮含量鲜见报道。在文献[16]中,桂花的总黄酮含量为(233.01±7.42)mg/g,与本次试验值相当。文献[17-22]中金雀花、石榴花、芭蕉花、黄饭花、玉荷花、帘子藤花的总黄酮含量与本文测定值比均偏高,可能的原因是文献中采用正交试验设计、响应面法设计获得针对该种花的最佳提取工艺。进行提取时,能使其黄酮类化合物得到充分、有效的提取。建议以后对食用花卉开发利用时,在最佳提取工艺条件下进行。
2.4.2 食用花卉中总多酚含量测定
每种花卉粉末样品称取1.000 g,平行3次,并按“1.3.1”的方法制备样品液,取一定体积的样液按“1.3.2.2”所述方法测定,同时进行空白试验。结果见表2。由表2可知:13种食用花卉总多酚含量顺序是:石榴花>桂花>棠梨花>猫屎花>黄饭花>鸡屎臭药花>玉荷花>帘子藤花>芭蕉花>菊花>金雀花>马桑花>苦刺花。在考察的13种食用花卉中,除桂花和黄饭花外,其余花卉总多酚含量均高于总黄酮含量。总多酚含量以蒙自的石榴花最高,为13.16%,苦刺花最低仅为0.83%。
经大量文献检索表明,红河州13种食用花卉中,金雀花、苦刺花、芭蕉花、马桑花、棠梨花、黄饭花、玉荷花、鸡屎臭药花、帘子藤花、猫屎花的总多酚含量鲜见报道。在文献[16]中,桂花的总多酚含量为(90.60±6.88)mg/g,与本次实验值相当。石榴花中多酚的研究报道不多,很多研究者都把目光集中在石榴皮和石榴籽中多酚研究上。
2.5 回收率试验
分别各取3份已知黄酮和多酚含量的金雀花样品,准确加入1.00mg芦丁或没食子酸标准溶液后,按照“1.3.2.1”和“1.3.2.2”进行试验,分别计算得到黄酮和多酚的回收率,结果见表3。
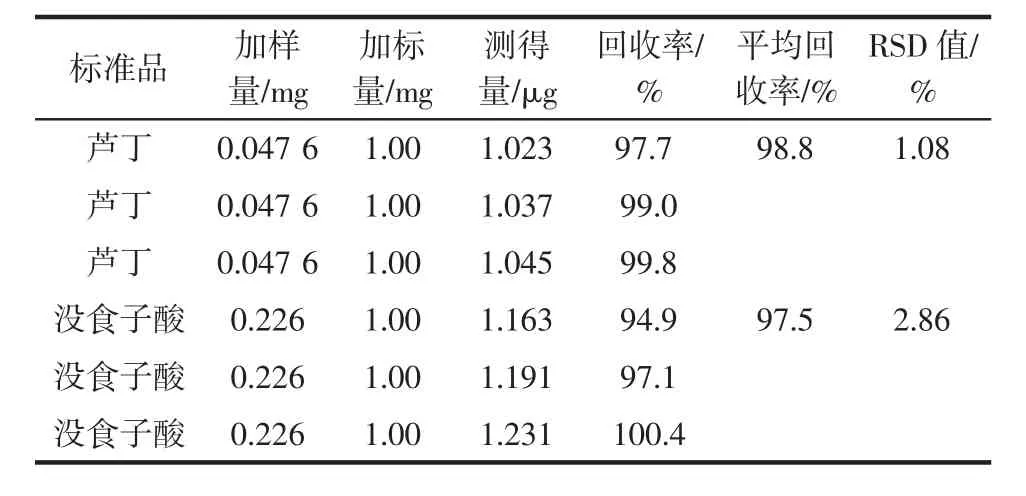
表3 回收率试验结果(n=3)Table3 The recovery experim ental results(n=3)
黄酮的平均回收率为98.8%,多酚的平均回收率为97.5%;黄酮和多酚回收率3次测定的RSD值分别为1.08%和2.86%,小于3%,表明回收率结果良好。
3 结论
对红河州13种食用花卉中的总黄酮和总多酚进行了提取和测定,并对各种花中的总黄酮和总多酚含量进行了比较,结果表明总黄酮含量顺序是:桂花>黄饭花>棠梨花>猫屎花>玉荷花>鸡屎臭药花>帘子藤花>芭蕉花>石榴花>马桑花>菊花>金雀花>苦刺花。总多酚含量顺序是:石榴花>桂花>棠梨花>猫屎花>黄饭花>鸡屎臭药花>玉荷花>帘子藤花>芭蕉花>菊花>金雀花>马桑花>苦刺花。桂花的黄酮含量高于其他测试花卉,并且其多酚含量也仅次于石榴花位居第二;石榴花的多酚含量最高。无论是总黄酮和总多酚的含量均是苦刺花最低。
13种红河州食用花卉中马桑花、棠梨花、鸡屎臭药花、猫屎花的总黄酮含量鲜见报道;金雀花、苦刺花、芭蕉花、马桑花、棠梨花、黄饭花、玉荷花、鸡屎臭药花、帘子藤花、猫屎花的总多酚含量鲜见报道。对红河州经常食用的13种花卉中的总黄酮和总多酚含量的测定,为这些食用花卉的深度开发利用提供了理论依据。
13种红河州食用花卉中石榴花中的多酚含量最高,并且红河州有大面积种植的石榴资源,可以为进一步开发石榴花提供原料支持,同时能为当地种植业创收。棠梨花中黄酮和多酚含量均较高,可以进一步研究开发为功能型保健食品,从而提高附加值。
参考文献:
[1]刘怡涛,龙春林.云南各民族食用花卉的初步研究[J].云南植物研究,2001,23(4):41-56
[2]宁亚萍,董施彬,李建霞,等.山杏花总黄酮抗氧化活性及其对酪氨酸酶抑制作用的研究[J].食品工业科技,2016,37(5):104-108
[3]梁丹霞,顾霞敏,许海丹.合欢花总黄酮不同提取工艺的比较[J].食品与发酵科技,2015,51(5):23-26
[4]刘伟,李紫薇,陈文强.新疆野生樱桃李枝、叶不同萃取部位抗氧化活性研究[J].食品工业科技,2016,37(3):119-122
[5]王云云,张兴,孙力,等.国内外食用花卉的研究进展[J].黑龙江科学,2010,1(5):46-49
[6]邹维娜,王微,徐启江,等.香茶藨子叶片总酚、总黄酮提取及抗氧化性研究[J].食品工业科技,2017,38(2):266-272
[7]刘娟,李楠,王昌涛.牡丹花粉黄酮的提取及抗氧化性研究[J].食品研究与开发,2012,33(10):39-44
[8]尹志娜.植物多酚分离提取方法和生物功能研究进展[J].生命科学仪器,2010,8(3):43-49
[9]岳秀洁,李超,扶雄.超声提取辣木叶黄酮优化及其抗氧化活性[J].食品工业科技,2016,37(1):226-231
[10]郭雷,朱文成,刘超.密蒙花化学成分及生物活性研究进展[J].食品研究与开发,2012(7):222-225
[11]杨申明,王波,王振吉,等.金雀花总黄酮提取工艺优化及抗氧化性研究[J].浙江农业学报,2015(2):278-284
[12]张秋燕,张福平,陈秋华,等.鼠麴草黄酮类化合物抗氧化性研究[J].辽宁中医药大学学报,2014(3):30-32
[13]何健民.食用花卉棠梨花的化学成分研究[D].昆明:云南大学,2013:27
[14]陈云,封京京.双波长分光光度法测定油菜蜂花粉中总黄酮含量的研究[J].中国酿造,2016,35(2):131-134
[15]郑敏燕,魏永生,卢挺.双波长分光光度法测定油菜蜂花粉中总黄酮的含量[J].商丘师范学院学报,2004,20(2):113-114
[16]黄玲艳,黄宏轶,汪元元,等.16种常见可食花卉水提液的总多酚与总黄酮含量及其抗氧化活性[J].食品工业科技,2017,38(4):354-356,360
[17]杨申明,王波,王振吉,等.金雀花总黄酮提取工艺优化及抗氧化性研究[J].浙江农业学报,2015,27(12):278-284
[18]萨提瓦尔地,艾克白尔,艾来提,等.新疆石榴花中总黄酮提取工艺研究[J].食品科学,2007,28(3):110-112
[19]周银丽,王晓云,白建波,等.芭蕉花中总黄酮的最佳提取工艺[J].江苏农业科学,2013,41(6):257-259
[20]钟佳,马金晶,罗雯,等.大叶羊蹄甲总黄酮的提取及其对羟自由基的清除作用研究[J].中国农学通报,2012,28(16):215-218
[21]郝宁,于艳,张漫霞,等.威灵仙总皂苷和总黄酮超声提取工艺[J].中药材,2014,37(5):884-889
[22]郭雷,王淑军,刘玮炜.响应面法优化密蒙花总黄酮的超声提取工艺[J].食品科学,2012,33(4):13-17
