两种藨草属植物对盐度的表型可塑性反应
2018-05-15殷甘强王玉国张文驹
殷甘强,杨 梅,王玉国,杨 继,张文驹
(1.复旦大学 生物多样性和生态工程教育部重点实验室,上海200438; 2.长江大学 农学院,荆州 434025)
对于固着生活的植物而言,表型可塑性(phenotypic plasticity),即同一基因型响应环境变化在形态上或生理上产生多种表型的能力,是植物适应环境条件变化的重要方式[1-2].由于自然选择,不同生境的物种表型可塑性可能会发生适应性分化[2-4].通常我们判断表型可塑性是否有适应意义的关键在于可塑性对适合度是否有影响[5-7].已有大量研究对比了来自不同生境的物种表型可塑性的差异,并讨论了这种可塑性的适应意义,然而这些研究一方面大多没有使用同一个基因型的材料[8-10],另一方面通常缺乏适合度证据的支持,或者选择的指标不能充分反映实际的适合度[11-13].
水生植物常常通过克隆繁殖扩大群体,可以通过形态结构调节、克隆分株选择性放置、分株间物质传输与共享、相连分株形态和生理功能特化等策略适应异质的生境[14-17].因此,水生植物常常在形态、行为和生理上具有较强的表型可塑性,这有利于其拓宽生态位,占据更多样的生境[3-4,18].陆生植物的表型可塑性受到植物生态学界的持续关注,但水生植物的表型可塑性的研究明显不足[17].
扁秆藨草(ScirpusplaniculmisFr. Schmidt)和海三棱藨草(S.mariqueterTang et Wang)是莎草科(Cyperaceae)藨草属的水生植物.它们既可有性繁殖,又可通过地下膨大的球茎进行繁殖,在形态上极为相似[19];分子标记证据也表明海三棱藨草和扁秆藨草有着极为相近的亲缘关系[20].然而,两者的生境有显著差别: 扁秆藨草分布于淡水生境,如水田、河流、湖泊;而海三棱藨草生长在河口潮间带的盐沼生境中,其生境盐度较高且波动较大[21-22].相较于淡水生境,河口潮间带由于受径流量、潮汐、潮位等不同程度的影响而呈现出更高的环境异质性[23].因此,我们推测,与扁秆藨草相比,海三棱藨草具有较强的表型可塑性,并且这种可塑性的差异可能对这两个物种适应各自生境具有重要意义.目前,已有学者对藨草属植物在不同盐度下的表型可塑性进行过相关研究[24-25],发现扁秆藨草从0‰至5‰盐度有一定程度的可塑性,而海三棱藨草的可塑性目前还未见报道.
本研究以扁秆藨草和海三棱藨草为材料,利用同一基因型的克隆分株样品,通过控制盐度梯度的同质园栽培实验及球茎萌发实验,以繁殖体数量和幼苗生命力作为适合度代理[7],希望回答以下两个问题: (1) 在盐度梯度下,扁秆藨草和海三棱藨草的克隆生长的表型可塑性是否存在与理论预测的差异?(2) 如果存在差异,其有何适应意义?
1 材料和方法
1.1 材料
扁秆藨草植株采于浙江杭州市下沙水渠边,海三棱藨草植株采于浙江嘉兴、慈溪市的滩涂.为了减少物种内遗传差异带来的影响,两个物种各选取了两个独立的株系(genet),分别放置于同质园环境中连续培养一年以上以消除母本效应,并通过营养生长使每一株系获得足够多的遗传背景完全相同的克隆分株(ramet)用于栽培实验.所用的海三棱藨草仅进行营养生长和克隆繁殖.
1.2 方法
1.2.1 栽培实验
取扁秆藨草和海三棱藨草克隆分株分别进行盆栽.参考已有的研究及海三棱藨草生境全年盐度均值波动范围9‰~13‰[26],栽培实验设有4个盐度梯度处理: 0‰、5‰、10‰、15‰,盐溶液用NaCl配制.4个处理分别设置15个重复,一个分株即为一个重复.盆栽置于上海市复旦大学江湾校区玻璃温室内,温室内温度控制在20~35℃之间,光照为自然光,栽培基质为沙土和腐殖质质量比14∶1的混合物,呈弱碱性.栽培实验从2016年6月13日至2016年10月20日.前期研究已表明在相同的栽培条件下,该时间段的扁秆藨草仅进行营养生长和克隆繁殖.
1.2.2 形态指标
栽培实验结束后,将植物材料从花盆中取出洗净,进行测量,共进行9项形态指标的测量计算,具体测量方法如下: (1) 分株数,为除母株以外所有分株的数量,植株展开第一片叶即为一株分株,包含中途死亡的植株;(2) 分株成活率,为成活分株的数量除以分株数;(3) 植株高度,为最高植株顶端距离土面的距离;(4) 茎直径,为最粗植株直立茎基部的直径;(5) 球茎数,为膨大呈球形的块茎的数量,如果直立茎基部膨大呈球形且具芽,也计作球茎;(6) 球茎生物量,用吸水纸将球茎表面水分吸干后称量球茎鲜重,取部分球茎在80℃下烘干至恒重,计算干湿重比例,用球茎鲜重乘以干湿重比估算球茎生物量;(7) 球茎平均重,为球茎生物量除以球茎数;(8) 总生物量,整株植物的生物量,为球茎、直立茎、匍匐茎、叶、根烘干后测得的生物量的总和;(9) 球茎投入比例,为球茎生物量除以总生物量.
1.2.3 球茎萌发实验
对扁秆藨草和海三棱藨草分别进行球茎萌发实验.取上述栽培实验中各盐度处理下的新鲜球茎分别置于4℃中保存,次年(2017年)3月取出并进行萌发实验.萌发实验采用与栽培实验相同的盐度梯度和环境条件,即在原盐度处理下获得的球茎仍置于该盐度下萌发,使球茎萌发的环境与上一代生长的环境一致.每盆浅埋10粒球茎为一个重复,每个盐度处理设3个重复.萌发处理第35天统计以下指标: (1) 出苗数,为每盆10粒球茎萌发产生的幼苗数量(出苗率即为出苗数除以10);(2) 幼苗高度,为最高植株顶端距离土面的距离;(3) 幼苗茎直径,为最粗植株直立茎基部的直径.
1.2.4 数据分析
所有数据分析均在R 3.3.2软件中完成.通过各性状的反应规范(reaction norm[5])直观地比较可塑性的差异.运用方差分析检测物种和盐度对各性状变异的影响,如果物种×盐度交互作用影响显著,则表明该性状在不同物种间对盐度的表型可塑性存在显著差异[4].
为了更准确的比较扁秆藨草和海三棱藨草适合度的差异,我们参考了以种群增长能力评估适合度的方法[27-28],选择当年繁殖体数量和幼苗生命力这两个对适合度有重要影响的因素[7],并定义了适合度:
适合度=球茎数×出苗率×幼苗高度×幼苗茎直径,
(1)
其中: 式(1)中的球茎数是指第一年每盆栽培植株产生的球茎总数;球茎数×子代出苗率代表实际有效的繁殖体数量;幼苗高度×幼苗茎直径代表幼苗的生命力.
为了比较两个物种适合度的变化,我们在适合度的基础上定义了相对适合度:

(2)
2 结果与分析
2.1 扁秆藨草在不同盐度下的性状变化
扁秆藨草各性状随盐度变化而变化(图1).统计检验显示,除了球茎平均重,盐度对其他各性状都有显著影响(表1,看46页).不同性状的反应规范不同,可分为4类: (1) 持续下降型,包括分株数、植株高度、茎直径、球茎数、球茎生物量、总生物量6个性状,具有相似的反应规范,盐度从0‰至15‰变化时,各指标值持续下降(r2=0.218~0.531,P<0.001;茎直径r2=0.095,P=0.002)(图1A~F);(2) 先升后降型,只有球茎平均重一个性状,最大值出现在5‰盐度时,从5‰至15‰显著下降(图1G);(3) 缓慢上升型,球茎投入比例随盐度梯度变化而线性上升,但上升的幅度较小(r2=0.107,P=0.001)(图1H);(4) 快速下降型,只包括分株成活率,其反应规范变化幅度最大,盐度从0‰至5‰,成活率保持稳定,但从10‰开始成活率快速下降,至15‰时,成活率下降至50%(图1I).

图1 扁秆藨草和海三棱藨草各性状反应规范Fig.1 The reaction norms of Scirpus planiculmis and S. mariqueterbar为标准误;小写字母表示扁秆藨草t检验结果;大写字母表示海三棱藨草t检验结果.
不同盐度下扁秆藨草球茎的出苗数、幼苗高度和幼苗茎直径见表2(看46页),各性状都具有可塑性: 出苗数随着盐度的增加而下降,在15‰盐度下,依然能萌发出少量幼苗;幼苗高度和茎直径从0‰至5‰略有上升,从5‰至10‰快速下降.随着盐度的增加,扁秆藨草相对适合度逐渐下降: 在0‰盐度下适合度最大,在15‰盐度下相对适合度几乎为0;从0‰至5‰相对适合度下降较快(图2,看46页).

表1 扁秆藨草和海三棱藨草不同盐度下性状变化的方差分析F值
注:***P<0.001,**P<0.01,*P<0.05,ns无显著性.

表2 扁秆藨草和海三棱藨草球茎萌发35天时的性状
注: 表中数据以平均值±标准差表示.出苗数指每10粒球茎在35天时产生的幼苗数,一粒球茎可能同时萌发多个幼苗.
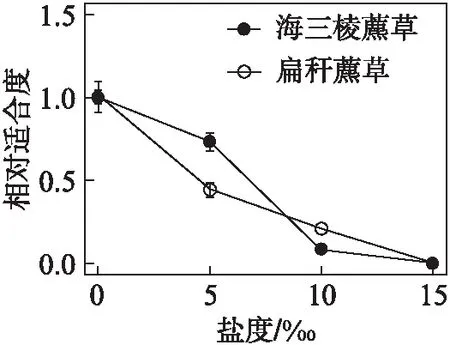
图2 扁秆藨草和海三棱藨草相对适合度随盐度变化趋势Fig.2 The relative fitness of Scirpus planiculmis and S. mariqueter under different saline treatmentsbar为标准误;小写字母表示扁秆藨草t检验结果;大写字母表示海三棱藨草t检验结果.
2.2 海三棱藨草在不同盐度下的性状变化
统计检验显示盐度对海三棱藨草所有性状都有显著影响(表1),不同性状的反应规范不同,也可分为4类: (1) 线性下降型,包括分株数、植株高度、茎直径、球茎数、球茎生物量及总生物量6个性状,盐度从0‰增至15‰时,各表型的量值都呈下降趋势(r2=0.153~0.541,P<0.001),表现出差异显著的2~4种状态(图1A~F);(2) 拱型,仅包括球茎平均重,最大值出现在中等盐度5‰~10‰条件下,在0‰和15‰条件下量值都显著下降(图1G);(3) 缓慢上升型,仅包括球茎投入比例,在盐度0‰至15‰范围内逐渐上升(r2=0.087,P=0.003),只有两个极端条件下表型存在显著差异(图1H);(4) 缓慢下降行,仅包括分株成活率,在盐度0‰至15‰范围内逐渐下降(r2=0.073,P=0.006),只有两个极端条件下表型存在显著差异(图1I).
不同盐度下海三棱藨草球茎萌发幼苗各性状都具有可塑性(表2): 出苗数随着盐度的增加而下降,在15‰盐度下,完全不能出苗;幼苗高度和茎直径从0‰至5‰略有上升,从5‰至10‰快速下降.海三棱藨草相对适合度随着盐度的增加而逐渐下降;在0‰盐度下相对适合度最大;在15‰盐度下相对适合度为0;从5‰至10‰相对适合度下降较快.
2.3 扁秆藨草和海三棱藨草表型变化趋势的比较
总体上,盐度梯度对扁秆藨草和海三棱藨草的所有性状都有影响(表1).排除盐度对表型的影响,两物种的分株数和球茎数本身无显著差异(表1),对于植株高度、茎直径、分株成活率,海三棱藨草的表现优于扁秆藨草(图1B~C,I),而对于球茎生物量、总生物量、球茎平均重、球茎投入比例,扁秆藨草的表现优于海三棱藨草(图1E~H).
双因素方差分析则进一步显示,这两个物种分株成活率和球茎数的反应规范存在显著差异(表1),其他指标具有相似的反应规范(图1).两者的分株成活率都随着盐度增加而显著上升,但扁秆藨草上升的速率比海三棱藨草更高;盐度从0‰升至5‰时,海三棱藨草的球茎数下降幅度大于扁秆藨草的下降幅度.
扁秆藨草和海三棱藨草的适合度都随着盐度增加而下降,都是在0‰盐度下表现最好,而在15‰盐度时,适合度接近或等于0,但是两者适合度下降的斜率是不同的,从0‰至5‰盐度,扁秆藨草下降斜率较大,海三棱藨草则下降斜率较小,使得海三棱藨草的相对适合度高于扁秆藨草,但5‰至10‰盐度,扁秆藨草下降斜率较小,而海三棱藨草下降斜率较大,扁秆藨草的适合度高于海三棱藨草(图2).
3 讨 论
3.1 表型可塑性的适应性差异
已有大量研究证实来自不同生境物种的表型可塑性会发生适应性分化(例如[29-31]),而水生植物通常通过表型可塑性响应环境的变化[17-18],理论上也应当会产生更显著的适应性分化.然而,扁秆藨草和海三棱藨草对不同盐度的反应规范十分相似,9个测量性状中有7个性状的反应规范一致或高度相似(图1,表1),仅有分株成活率和球茎数两个性状的反应规范存在显著差异,而且从反应规范上可以看出球茎数在盐度大于5‰的生境下也完全相同(图1).上述两个物种反应规范的相似性看起来与理论预测的相悖,作为一个生活于淡水生境下的物种,扁秆藨草应显示对盐度较低的可塑性,而只分布于盐生生境的海三棱藨草在盐度变化时应显示较高的可塑性.
这是否由于两者的表型可塑性都只是对盐胁迫的被动反应,而在相同胁迫下产生了相似的表型变化?盐生植物并非都是喜盐植物,其中有许多是耐盐植物[32].从两个物种都在淡水生境中获得最高适合度以及适合度随着盐度增加而下降的结果来看(图2),上述的推测可能是正确的.然而,高盐度条件下扁秆藨草的成活率远低于海三棱藨草表明两者还是有不同的适应策略,并且根据繁殖体数量和幼苗生命力估算的适合度,两者的下降速率也显著不同,盐度从0‰至5‰变化时,海三棱藨草的适合度下降比扁秆藨草要慢得多.因此,海三棱藨草的表型变异应更具有适应意义,不完全是被动的反应.
之所以会造成这种适应性上的差异,可能是因为某些生理过程,尤其是球茎萌发相关的生理过程导致.本研究中,适合度是以繁殖体数量及幼苗生命力估算的,海三棱藨草从0‰至5‰盐度时,出苗率仅减少了10.7%,但幼苗高度和直径分别增加了23.1%和23.9%,而扁秆藨草的出苗率减少了22.4%,幼苗的高度和直径分别增加了仅1.9%和3.2%,也就意味着较高的盐度都会抑制扁秆藨草和海三棱藨草球茎的萌发,但不同的是海三棱藨草的萌发过程受影响较小,并且盐胁迫会刺激产生更为高大粗壮的幼苗,而扁秆藨草萌发过程受影响较大,盐胁迫对幼苗的高度和直径的影响较小.这可能是由于盐生植物繁殖体的萌发过程对盐胁迫有较强的耐受和调节机制[33-34].
扁秆藨草是欧亚大陆的广布种,有学者对比分布于欧洲的扁秆藨草和藨草属另一种滩涂植物BolboschoenusmaritimusL.也发现扁秆藨草比后者对盐度变化具有更强的表型可塑性[25],为何一个生活于淡水环境的物种会与生于盐水环境的物种具有相似的表型可塑性还需进一步研究.
3.2 适合度的度量
在本研究中,我们以植物当年繁殖体数量和幼苗生命力估算适合度[7],其结果表明扁秆藨草和海三棱藨草的相对适合度都会随着盐度的增加而快速下降但下降的速率不同.此外,在15‰盐度时,两者适合度都下降至0或接近0,即第一代虽然能在15‰盐度下存活,但是产生的球茎不能萌发,因此没有适应意义.
成活率、繁殖体数量和总生物量等也是研究中经常使用的适合度代理(例如[9,35]).然而本研究中,如果以成活率、繁殖体数量或总生物量作为适合度代理可能会得到完全不同的结论: 以成活率为适合度代理时,扁秆藨草的适合度较低,且随着盐度增加快速下降,而海三棱藨草成活率较高且稳定,因此会认为15‰盐度下两者是可以生存的,并推测海三棱藨草比扁秆藨草更适应含盐生境;以繁殖体数量为适合度代理时,盐度从0‰升至5‰,海三棱藨草的适合度下降速度更快,因此会认为海三棱藨草的表型可塑性是缺乏适应意义的;以总生物量为适合度代理时,扁秆藨草和海三棱藨草完全没有差异,因此会推测两者对含盐生境的适应能力是相同的.这种结论上的误差是由繁殖权衡和球茎萌发的差异造成的: 虽然扁秆藨草和海三棱藨草的生物量是相似的,但是扁秆藨草将更多资源投入到克隆繁殖上,这也导致地上植株部分的成活率较低;尽管盐度从0‰至5‰海三棱藨草的球茎数下降更快,但其第二代实际的出苗率下降更慢,同时幼苗的生存力反而增加了.因此,需根据实际情况,选择合适的适合度代理,才能得到更符合实际情况的结论.
由于海三棱藨草与扁秆藨草花期并不同步,研究中我们只考虑了克隆生长.实际上,水生植物常常是兼性生殖的,海三棱藨草和扁秆藨草都可以进行有性繁殖.种子数量及其活力直接影响植物的适合度,因此,有待进一步研究这两个种的可塑性对种子生产及活力的影响,从而全面揭示表型可塑性的适应意义.
参考文献:
[1] BRADSHAW A D. Evolutionary significance of phenotypic plasticity in plants [J].AdvancesinGenetics, 1965,13(1): 115-155.
[2] SCHLICHTING C D. The evolution of phenotypic plasticity in plants [J].AnnualReviewofEcology&Systematics, 1986,17(1): 667-693.
[3] SULTAN S E. Phenotypic plasticity and plant adaptation [J].ActaBotanicaNeerlandica, 1995,44(4): 363-383.
[4] PIGLIUCCI M. Evolution of phenotypic plasticity: Where are we going now? [J].TrendsinEcology&Evolution, 2005,20(20): 481-486.
[5] SCHEINER S M. Genetics and evolution of phenotypic plasticity [J].AnnualReviewofEcologyandSystematics, 1993,24(1): 35.
[6] SCHLICHTING C D, SMITH H. Phenotypic plasticity: Linking molecular mechanisms with evolutionary outcomes [J].EvolutionaryEcology, 2002,16(3): 189-211.
[7] DAVIDSON A M, JENNIONS M, NICOTRA A B. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis [J].EcologyLetters, 2011,14(4): 419-431.
[8] CHIPPINDALE A K, ARMAND M L, SUNG B K, et al. Phenotypic plasticity and selection inDrosophilalife-history evolution. I. Nutrition and the cost of reproduction [J].JournalofevolutionBiology, 1993,6: 171-193.
[9] VAN KLEUNEN M, LENSSEN J P, FISCHER M, et al. Selection on phenotypic plasticity of morphological traits in response to flooding and competition in the clonal shore plantRanunculusreptans[J].JournalofEvolutionaryBiology, 2007,20(6): 2126.
[10] ZHANG L H, ZHANG Y W, ZHAO X N, et al. Effects of different nutrient sources on plasticity of reproductive strategies in a monoecious species,Sagittariagraminea(Alismataceae) [J].JournalofSystematicsandEvolution, 2014,52(1): 84-91.
[11] KROON H D, STUEFER J F, DONG M, et al. On plastic and non-plastic variation in clonal plant morphology and its ecological significance [J].FoliaGeobotanica, 1994,29(2): 123-138.
[12] RICHARDS C L, WHITE S N, MCGUIRE M A, et al. Plasticity, not adaptation to salt level, explains variation along a salinity gradient in a salt marsh perennial [J].EstuariesandCoasts, 2010,33(4): 840-852.
[13] RIIS T, LAMBERTINI C, OLESEN B, et al. Invasion strategies in clonal aquatic plants: Are phenotypic differences caused by phenotypic plasticity or local adaptation? [J].AnnalsofBotany, 2010,106(5): 813-822.
[14] GENG Y P, PAN X Y, XU C Y, et al. Phenotypic plasticity rather than locally adapted ecotypes allows the invasive alligator weed to colonize a wide range of habitats [J].BiologicalInvasions, 2007,9(3): 245-256.
[15] 董鸣.克隆植物生态学 [M].北京: 科学出版社,2011.
[16] WANG Z, LI Y, DURING H J, et al. Do clonal plants show greater division of labour morphologically and physiologically at higher patch contrasts? [J]PLoSOne, 2011,6(9): e25401.
[17] 黎磊,耿宇鹏,兰志春,等.异质生境中水生植物表型可塑性的研究进展 [J].生物多样性,2016,24(2): 216-227.
[18] ECKERT C G, DORKEN M E, BARRETT S C. Ecological and evolutionary consequences of sexual and clonal reproduction in aquatic plants [J].AquaticBotany, 2016,135: 46-61.
[19] 唐进,汪发缵.中国植物志.莎草科,藨草属 [M].北京: 科学出版社,1961,11: 7-34.
[20] YANG M, ZHOU Y B, ZHU Q Q, et al. AFLP markers in the detection ofScirpus×mariqueter(Cyperaceae) hybrid in China [J].AquaticBotany, 2009,91(4): 298-302.
[21] 钱希.扁稈藨草的生物学特性及防治研究 [J].植物生态学与地植物学学报,1988,3: 43-53.
[22] 欧善华,宋国元.海三棱藤草的形态,分布与资源 [J].上海师范大学学报(自然科学版),1992,21(增刊): 4-9.
[23] 陈吉余,陈沈良.中国河口研究五十年: 回顾与展望 [J].海洋与湖沼,2007,38(6): 481-486.
[24] 李惠芳,章光新.水盐交互作用对莫莫格国家级自然保护区扁秆藨草幼苗生长的影响 [J].湿地科学,2013,11(2): 173-177.
[26] 胡方西,潘定安,严肃庄,等.杭州湾盐度变化的基本特征 [M]∥中国海洋湖沼学会海岸河口学会.海岸河口研究.北京: 海洋出版社,1990: 76-94.
[27] WIKBERG S. Fitness in clonal plants [J].Oikos, 1995,72(2): 293.
[28] WINKLER E, FISCHER M. Two fitness measures for clonal plants and the importance of spatial aspects [J].PlantEcology, 1999,141(1): 191-199.
[29] WELLS C L, PIGLIUCCI M. Adaptive phenotypic plasticity: The case of heterophylly in aquatic plants [J].PerspectivesinPlantEcology,EvolutionandSystematics, 2000,3(1): 1-18.
[30] SULTAN S E. Phenotypic plasticity for fitness components inPolygonumspecies of contrasting ecological breadth [J].Ecology, 2001,82(2): 328-343.
[31] OKE K B, BUKHARI M, KAEUFFER R, et al. Does plasticity enhance or dampen phenotypic parallelism? A test with three lake-stream stickleback pairs [J].JournalofEvolutionaryBiology, 2016,29(1): 126-143.
[32] FLOWERS T J, COLMER T D. Salinity tolerance in halophytes [J].NewPhytologist, 2008,179(4): 945-963.
[33] 渠晓霞,黄振英.盐生植物种子萌发对环境的适应对策 [J].生态学报,2005,25(9): 2389-2398.
[34] 王东明,贾媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展 [J].中国农学通报,2009,25(4): 124-128.
[35] VAN KLEUNEN M, FISCHER M. Adaptive evolution of plastic foraging responses in a clonal plant [J].Ecology, 2001,82(12): 3309-3319.
