Cu2(OH)3NO3/Ag复合物的制备及性能研究
2018-05-15吴莹莹
吴莹莹,徐 伟
(复旦大学 材料科学系,上海 200433)
碱式硝酸铜是一种层状结构的羟基盐,化学式为Cu2(OH)3NO3,常用于汽车安全气囊填充物,是离子交换剂和点火器的成分[1-3].碱式硝酸铜还被用于制备Cu(OH)2和CuO纳米材料[4-5];用于催化一些无机和有机氧化反应[6-9];对一些有机染料也有吸附作用[10-11].碱式硝酸铜的合成方法有多种,除了一些传统方法以外,近年来又有一些新进展,比如溶液蒸发方法[12]、固态反应方法[13]以及超声化学方法[11,14].
碱式硝酸铜还可以采用Cu2O和AgNO3反应来合成[15].Li等人利用Cu2O和AgNO3反应,在乙醇作用下制备银纳米线[16],但是并没有对复合产物的性能进行研究.我们实验室曾经用CuSCN和碱溶液反应来制备Cu2O纳米线材料[17-18].我们希望通过AgNO3处理来改性Cu2O纳米线材料,但是发现得到的是碱式硝酸铜/银复合物,研究还发现这种复合物材料可以有很好的导电性,并且其性能可以通过AgNO3溶液的用量来控制.我们认为这种原位形成的导电复合物材料在导电胶以及与电磁波相互作用等领域还有进一步的开发价值.本文先报道这类复合物材料的合成、表征及基本性能研究.
1 实 验
1.1 样品的制备
Cu2O的制备: 取0.01mol CuSCN,加入1L的0.01mol/L NaOH溶液中,超声1h,过滤,多次水洗,60℃下烘干,即得Cu2O.
Cu2(OH)3NO3/Ag复合物的制备: 取0.18g上述自制的Cu2O,加入0.025mol/L AgNO3溶液中,室温下超声1h后,分离出固体粉末,用去离子水洗涤多次,60℃下烘干,即得到复合物固体粉末,记为Sample 1.
根据使用的Cu2O和AgNO3的摩尔比不同,复合产物样品分别记为Sample 1-X(X=1,2,3,4,5,6,7).Cu2O和AgNO3的摩尔比(n)为: 1∶0.5(Sample 1-1);1∶1(Sample 1-2);1∶2(Sample 1-3);1∶4(Sample 1-4);1∶5(Sample 1-5);1∶10(Sample 1-6);1∶20(Sample 1-7).
试剂: CuSCN、NaOH、AgNO3和玫瑰红B(RhB)购自国药集团上海化学试剂有限公司,均为分析纯;甲基橙(MO)和亚甲基蓝(MB)指示剂购自国药集团上海化学试剂有限公司;刚果红(CR)指示剂购自Aladdin公司.
参考文献[15-16],我们认为Cu2O与AgNO3反应生成Cu2(OH)3NO3/Ag复合物可能涉及如下化学反应:
(1)

(2)

(3)

(4)

(5)
1.2 样品的表征
用D8 ADVANCE型X射线衍射仪(XRD)表征样品的晶型结构;用XL30型扫描电子显微镜(SEM)及PHI XL30型透射电子显微镜(TEM)表征样品的微观结构和形貌;用EDAX TSL型能量色散X射线光谱仪(EDX)及PHI 5000C ESCA System X射线光电子能谱仪(XPS)分析样品的元素组成和价态;用Nicolet Nexus 470型傅里叶变换红外分光光度计(FTIR)及溴化钾(KBr)压片法来检测样品的重要官能团,方法为: 干燥处理后,分别将1~2mg Sample 1-5、吸附MO、MB后的Sample 1-5与200mg纯KBr研细均匀,置于模具中,在5×107~10×107Pa压力下载油压机上压制成片,即可用于测试.用四探针电阻测量仪器测试样品的导电性.
1.3 样品的吸附性能测试
吸附实验在室温下进行,实验过程pH值稳定在6~7范围内.以一定浓度的MO、CR、MB和RhB溶液作为模拟废水.将一定量的Sample 1-5作为吸附剂,分别添加到相应的染料溶液中,避光下搅拌,每隔定量的时间取出约4mL的混合溶液,放在6000r/min的离心机中离心5min,取上层清液,装入比色皿中,以去离子水的吸光度作为0基准,然后通过可见分光光度计在染料溶液对应的最大吸收波长处(MO、CR、MB和RhB的最大吸收波长分别为: 461、595、662和552nm)测定溶液吸光度A,直至混合溶液的吸光度A不再发生明显变化,即测试结束.
用最大吸收峰处的吸光度变化来代替浓度的变化,计算被测染料溶液的吸附率,公式为:
A=(C0-Ct)/C0×100%=(A0-At)/A0×100%,
计算复合物对染料溶液的吸附量,公式为:
qt=(C0-Ct)V/m.
其中:A为吸附率;C0,Ct分别为染料的初始浓度和吸附时间为t时的浓度(mg/L);A0,At分别为染料溶液初始时和t时的吸光度;qt为t时的吸附量(mg/g);V为溶液体积(L);m为吸附剂添加量(g).
2 结果与讨论
2.1 样品的XRD表征
图1(a)是自制Cu2O和Sample 1-5的XRD结果,图中标明了Cu2O、Cu2(OH)3NO3和Ag对应的衍射峰.自制Cu2O的XRD图谱与之前的分析结果一致,对应JCPDS No.65-3288立方相Cu2O,与课题组利用低浓度NaOH制备氧化亚铜的结果相一致[16].Sample 1-5的XRD图谱中38.2°,44.4°,64.6°,77.5°的衍射峰分别对应于银的(111),(200),(220)和(311)晶面(JCPDS No. 65-2871);12.8°,25.8°,33.5°和36.5°处的衍射峰分别与Cu2(OH)3NO3(JCPDS No.54-0747)的(001),(002),(120)和(121)晶面相对应,并没有检测到Cu2O、CuO及Cu(OH)2的衍射峰信号.复合物Sample 1-X(X=1,2,3,4,5,6)的XRD表征结果如图1(b)所示,随着AgNO3用量的增加,Cu2O衍射峰逐渐变弱,银和Cu2(OH)3NO3的衍射峰强度逐渐增强,当n=1∶4时,再增加AgNO3用量,复合物衍射峰的强度不再改变,说明Cu2O和AgNO3已经完全反应.

图1 (a) Cu2O和Sample 1-5的XRD图谱;(b) Sample 1-X(X=1,2,3,4,5,6)的XRD图谱Fig.1 XRD patterns of (a) Cu2O and Sample 1-5;(b) Sample 1-X(X =1,2,3,4,5,6)
2.2 样品的SEM和TEM表征
图2(a)为自制Cu2O的SEM图像,显示生成的Cu2O为较长且均匀的纳米线,这与肖星星之前制备的Cu2O纳米线薄膜结构十分相似[18],与Cu2O纳米粉体材料结果相一致[16].图2(b)显示Sample 1-5由片状物质混杂了一些像碎屑似的团聚物构成,是一种纳米复合物.片状物的厚度在100nm左右,见图2(b)中插图;片状物的长和宽在数微米左右,其中有很多呈现比较规则的六边形.图2(c)为Cu2(OH)3NO3六边形薄片的TEM图像.图2(d)中TEM图像显示银纳米带呈无规则弯曲的条带形状,直径约200nm,长度可达数十微米不等,为多晶结构.

图2 (a)Cu2O和(b)Sample 1-5的SEM图像;(c)Cu2(OH)3NO3六边形薄片和(d)银纳米带的TEM图像Fig.2 SEM images of (a) Cu2O and (b) Sample 1-5;TEM images of (c) Cu2(OH)3NO3 hexagonal nanosheets and (d) Ag nanoribbons
图3(a)、(b)分别为六边形薄片和无规则带状物的EDX图谱,EDX结果显示六边形薄片中含有Cu、O元素,带状物中含有Ag、Cu元素.结合XRD表征结果,证明六边形薄片为Cu2(OH)3NO3,无规则带状物为银纳米带,其中还混有Cu2(OH)3NO3六边形薄片.本实验证明,在AgNO3作用下Cu2O纳米线可以转变成六边形Cu2(OH)3NO3纳米片,同时生成银纳米带.这种形态变化是很有趣的,详细的生长机制还有待研究.

图3 (a) Cu2(OH)3NO3六边形薄片和(b)银纳米带的EDX分析结果Fig.3 EDX analysis of (a) Cu2(OH)3NO3 hexagonal nanosheets and (b) Ag nanoribbons
图4为Sample 1-X(X=1,2,3,4,5,6)的SEM图像(图中标注反应物Cu2O与AgNO3的摩尔比),随着AgNO3用量增加,生成的复合物中有更多的片状Cu2(OH)3NO3和带状Ag.AgNO3用量较少时,观察到很多颗粒状物质,可能是被超声震碎的Cu2O.当n=1∶4时,已经能观察到明显的六边形薄片,随着AgNO3溶液用量继续增加,颗粒状物质几乎没有了,六边形薄片和碎屑状物质基本稳定.这与前面的XRD测试结果一致,说明可通过改变AgNO3的用量来控制复合物的组成和形貌.

图4 Sample 1-X (X=1,2,3,4,5,6)的SEM图像Fig.4 SEM images of Sample 1-X(X=1,2,3,4,5,6)
2.3 样品的XPS表征
图5(a)、(b)和(c)分别为Sample 1-5中Ag、Cu和O的XPS谱图.
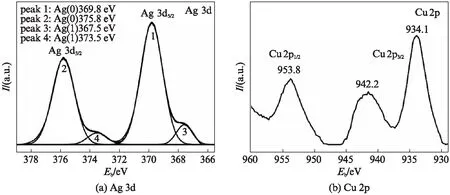

图5 Sample 1-5的XPS图谱Fig.5 XPS spectra of Sample 1-5
图5(a)表明样品表面存在少量的Ag+,这可能是由于银在空气中被氧化,在369.8eV和375.8eV处分别为单质Ag中Ag 3d1/2和Ag 3d3/2的电子结合能[19].图5(b)中934.1eV和953.8eV处的峰分别对应于Cu 2p3/2、Cu 2p1/2的结合能,且在942.2eV处有较强的卫星特征峰,与报道的Cu2(OH)3NO3的XPS图谱一致[14].图5(c)显示了O元素经高斯拟合后的XPS谱图,与文献中检测到的Cu2(OH)3NO3中O元素的XPS分析一致[14].通过以上,进一步证明复合物Sample 1-5由Cu2(OH)3NO3薄片和银纳米带构成.
2.4 样品的导电性能测试

表1 复合物Sample 1-X(X=1,2,3,4,5,6,7)
将制备得到的复合物样品Sample 1-X(X=1,2,3,4,5,6,7)用红外压片机压制成大小、厚度一致的圆片,用四探针电阻测试仪测试其电阻,结果如表1所列.样品的导电性和AgNO3使用量有关,在一定范围内,AgNO3用量增加,复合物的方阻降低,即导电性增强;当AgNO3用量为5倍Cu2O时(即Sample 1-5),复合物方阻在15~50mΩ/□,继续增加AgNO3用量,复合物方阻数值稳定在5~50mΩ/□范围.我们认为复合物的导电性主要受复合物中银含量的影响,银含量增加,导电性提高,银含量一定,复合物导电性则稳定,这与XRD和SEM表征中发现银的生成与AgNO3用量有关的结论一致.
2.5 样品的吸附性能测试


图6 (a) Sample 1-5对不同染料的吸附率-时间曲线;(b) Sample 1-5和吸附MO、MB后的Sample 1-5的红外谱图; (c) Sample 1-5(10mg)对20,30和40mg/L MO溶液(100mL)的吸附量-时间曲线图Fig.6 (a) A-t curves of different dyes by Sample 1-5;(b) FT-IR spectra of Sample 1-5 and Sample 1-5 adsorbed MO and MB; (c) qt-t curves of 20,30,40mg/L MO(100mL) by Sample 1-5(10mg)
此外还研究了Sample 1-5作为吸附剂对染料MO的吸附过程.图6(c)(看6页)是10mg Sample 1-5对100mL不同浓度(20mg/L、30mg/L和40mg/L)MO溶液的吸附曲线,吸附时间为540min至溶液吸光度不发生变化.根据中间曲线(30mg/L,100mL)的数据进行吸附动力学模型拟合,得到准一阶、准二阶动力学模型的决定系数R2分别为0.9774和0.9996,说明复合物对MO的吸附更符合准二阶动力学模型,表明该吸附过程可能受速率控制.将复合物对不同浓度的MO溶液的吸附数据进行吸附等温模型拟合,得到Langmuir和Freundlich模型方程分别为:y=0.001130x+0.002550,y=0.2277x+5.463,对应的线性拟合相关系数R2分别为0.9653和0.8623,复合物对MO的吸附更符合Langmuir等温吸附模型.
3 结 论
本文以自制的Cu2O为原料,在超声波作用下与AgNO3溶液反应,利用Ag+和Cu+之间的氧化还原反应,制备了一种新颖的Cu2(OH)3NO3/Ag复合物材料.经XRD、SEM、TEM、EDX、XPS等表征测试证明这种复合物是由薄片状Cu2(OH)3NO3和纳米带状Ag构成.通过改变AgNO3的使用量,可以控制复合物的形貌及组成,还可以控制复合物的导电性能,压片后的方块电阻为5~50mΩ/□.实验还证明Cu2(OH)3NO3/Ag复合物对甲基橙、刚果红染料具有选择性的吸附作用.该导电复合物在室温下制备,方法简单,容易批量生产.
参考文献:
[1] SCHMID H, EISENREICH N. Investigation of a two-stage airbag module with azide-free gas generators [J].PropellantsExplosivesPyrotechnics, 2000,25(5): 230-235.
[2] STANIMIROVA T, Dencheva S, KIROV G. Structural interpretation of anion exchange in divalent copper hydroxy salt minerals [J].ClayMinerals, 2013,48(1): 21-36.
[3] BISWICK T, JONES W, PACUA A, et al. Synthesis,characterisation and anion exchange properties of copper, magnesium, zinc and nickel hydroxy nitrates [J].JSolidStateChem, 2006,179(1): 49-55.
[4] PARK S H, KIM H J. Unidirectionally aligned copper hydroxide crystalline nanorods from two-dimensional copper hydroxy nitrate [J].JAmChemSoc, 2004,126(44): 14368-14369.
[5] BA N, ZHU L, LI H, et al. 3D rod-like copper oxide with nanowire hierarchical structure: Ultrasound assisted synthesis from Cu2(OH)3NO3,precursor,optical properties and formation mechanism [J].SolidStateSciences, 2016,53: 23-29.
[6] ARCIBAR-OROZCO J A, GIANNAKOUDAKIS D A, BANDOSZ T J. Copper hydroxyl nitrate/graphite oxide composite as superoxidant for the decomposition/mineralization of organophosphate-based chemical warfare agent surrogate [J].AdvancedMaterialsInterfaces, 2015,2(16): 1500215.
[7] ISCHENKO E V, YATSIMIRSKY A V, MAKSIMOV Y V, et al. Physicochemical, structural and catalytic properties of CuO/Cu2(OH)3NO3∶(Co∶Fe) composites [J].GlobalJournalofPhysicalChemistry, 2011,2(3): 255-263.
[8] ZHAN Y, ZHOU X, FU B, et al. Catalytic wet peroxide oxidation of azo dye(Direct Blue 15) using solvothermally synthesized copper hydroxide nitrate as catalyst [J].JournalofHazardousMaterials, 2011,187(1-3): 348-354.
[9] SRIKHAOW A, SMITH S M. Preparation of Cu2(OH)3NO3/ZnO,a novel catalyst for methyl orange oxidation under ambient conditions [J].AppliedCatalysisB:Environmental, 2013,s130-131(6): 84-92.
[10] JIA J, WANG H, NIU H, et al. Highly selective adsorption of organic dyes containing sulphonic groups using Cu2(OH)3NO3nanosheets [J].JournalofNanoparticleResearch, 2016,18(9): 260.
[11] WANG S, ZHANG X, PAN L, et al. Controllable sonochemical synthesis of Cu2O/Cu2(OH)3NO3,composites toward synergy of adsorption and photocatalysis [J].AppliedCatalysisB:Environmental, 2015,164(9): 234-240.
[12] NIU H, YANG Q, TANG K. A new route to copper nitrate hydroxide microcrystals [J].MaterialsScience&EngineeringB, 2006,135(2): 172-175.
[13] WANG X B, HUANG L N. A novel one-step method to synthesize copper nitrate hydroxide nanorings [J].TransactionsofNonferrousMetalsSocietyofChina(EnglishEdition), 2009,19(s2): 480-484.
[14] ANANDAN S, WU J J, ASHOKKUMAR M. Sonochemical synthesis of layered copper hydroxy nitrate nanosheets [J].Chemphyschem, 2015,16(16): 3389-3391.
[15] 陈寿椿.重要无机化学反应 [M]. 3版.上海: 上海科学与技术出版社,1994: 47.
[16] LI C, YANG X, YANG B, et al. A template-free oxide reduction route to silver nanowires [J].MaterialsLetters, 2005,59(11): 1409-1412.
[17] 肖星星.CuSCN和Cu2O纳米结构薄膜的制备及性能研究[D].上海: 复旦大学,2014.
[18] XIAO X, XIA P, JI X, et al. In situ,synthesis and characterization of Cu2O nanowire networks from CuSCN films [J].MaterialsLetters, 2014,128(10): 271-274.
[19] HSIEH S, LIN P Y, CHU L Y. Improved performance of solution-phase surface-enhanced raman scattering at Ag/CuO nanocomposite surfaces [J].JournalofPhysicalChemistryC, 2014,118(23): 12500-12505.
[20] HENRIST C, TRAINA K, HUBERT C, et al. Study of the morphology of copper hydroxyl nitrate nanoplatelets obtained by controlled double jet precipitation and urea hydrolysis [J].JournalofCrystalGrowth, 2003,254(1/2): 176-187.
[21] GÜNER E K, ÖZER A. Synthesis and characterization of copper hydroxyl nitrate and copper oxide by hydrothermal method [J].JournaloftheTurkishChemicalSocietyB:ChemicalEngineering, 2017,1(1): 183-192.
[22] THOMAS N. Mechanochemical synthesis of layered hydroxy salts [J].MaterialsResearchBulletin, 2012,47(11): 3568-3572.
