阿尔茨海默症靶基因及其药物的预测研究
2018-05-15李小林田卫东
侯 吉,李小林,田卫东
(1.复旦大学 生命科学学院 生物统计学与计算生物学系,上海 200438; 2.上海出入境检验检疫局 上海 200135)
阿尔茨海默症(Alzheimer’s disease, AD)又称老年痴呆症,是一种进行性神经障碍疾病,严重危害老年人身心健康[1].记忆丧失,思维能力,推理能力下降以及个性和行为的变化是AD的主要特征[2].其病理特征是在AD患者的大脑中形成细胞外淀粉样斑块和细胞内神经原纤维缠结.主要原因是淀粉样蛋白β肽(Aβ)的过量产生,导致淀粉样蛋白斑积聚.这种过量产生是由于亲本淀粉样蛋白前体蛋白(APP)的内切蛋白,其被α-酶复合物,β-酶复合物和γ-酶复合物的分泌酶切割[3].大脑中Aβ的产生增加和清除率降低会导致疾病发展过程中的突发事件级联,包括突触损伤,高磷酸化tau(p-tau),线粒体结构和功能变化,炎症反应,激素失衡,细胞周期变化和神经元损失[4-6].在全球范围内,大约有超过4000万个60岁以上的老人患有阿尔茨海默症,患者人数增长趋势不断上升,甚至每20年翻一番[7-8].
近年来,AD的预防及治疗的相关研究虽然已经取得了很大的进步,一些新的药物也被陆续研发出来,但真正具有明显临床效果的却是凤毛麟角.因此,有必要对历年来所有可用于治疗AD的药物进行汇总整理,运用生物信息学和系统生物学整合各层面的数据进行有效深入分析,预测未知的AD靶基因.对于进一步指导AD药物开发以及对已有药物临床综合使用具有重要的意义.
1 数据和方法
1.1 数据的收集和处理
DrugBank数据库是本文研究的核心.DrugBank(http:∥www.drugbank.ca)是一个综合的在线数据库,其中包含许多药物及其相关作用机制以及广泛的生物化学和药理学信息.该数据库将详细的药物(即化学、药理和药物)数据与综合药物靶标(即序列、结构和途径)信息相结合.数据库中总共包含了9591个药品,包括美国食品药品监督管理局(FDA)批准的2037个小分子药物,241个FDA批准的生物技术(蛋白质、肽)药物,96个营养药物和6000多个实验药物.此外,4661非冗余蛋白(即药物靶标、酶、转运蛋白、载体)的序列与这些药物的关系也被储存在这些条目中.每个药物数据条目包含超过200个数据字段,其中一半的信息是药物、化学数据,另一半是药物靶标或蛋白质数据.
本次研究从DrugBank数据库中下载drugbank_all_full_database.xml.zip文件,解压后得到full database.xml即DrugBank全药物数据信息.通过DrugBank(http:∥www.drugbank.ca)的高级搜索功能找出所有可用于治疗AD的药物及其ID.而后通过数据匹配,从DrugBank全药物数据信息中挖掘得到221个AD的靶基因.
1.2 功能富集分析
通过DAVID(https:∥david.ncifcrf.gov/)网站使用基因本体(Gene Ontology, GO)进行功能富集分析,以P<0.05(FDR校正)为标准筛选得到靶基因所参与的一系列生物学过程(Biological Process, BP).进一步通过Gene Ontology数据库挖掘出这些生物过程中所有的相关基因,称之为ADTarget_BP(AD Target from Biological Process).同时,根据富集得到的生物学过程进一步分析其与AD的联系.
1.3 靶基因预测
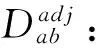
μa是a基因的网络原始平均距离:
其中N为所有网络基因的总数(19038).
最终可计算得到网络中各个基因关于某个疾病的权重:
K为所有疾病基因的总数[11],在本研究中即为AD靶基因的个数(221).
本研究将使用矫正后的距离Dadj来计算靶基因子网络的平均距离和10000个随机相同数量基因(221个)子网络的平均距离,并进行比较.由此得出靶基因子网络的平均距离是否较小,即靶基因在整个基因网络中是否相对聚集.
对于聚集度较高的靶基因子网络,进一步使用GenePANDA预测AD的靶基因,由此获得到更好的预测结果[11].将AD的221个已知靶基因输入GenePANDA预测工具,进而得到网络中所有19038个基因关于AD靶基因预测的分数排名,分数排名越高则代表预测基因和原始AD靶基因集的关系越密切.本次研究提取分数排名前100的基因,而后将该基因集中包含的已知AD靶基因去除,得到GenePANDA初步预测的AD靶基因集.再将该基因集进行整理,去除其中已知的靶基因,最后得到GenePANDA实际预测的AD靶基因集,称之为ADTarget_GP(AD Target from GenePANDA).将ADTarget_GP与ADTarget_BP取交集,得到最终预测的AD靶基因集,称之为ADTarget_PT(AD Target from Predict).
1.4 治疗AD药物预测
将预测得到的AD靶基因集合ADTarget_PT与DrugBank全药物数据库(full database.xml)进行匹配,得到这些靶基因的相关药物,该些药物即为预测得到可用于治疗AD的潜在药物.
2 结果和分析
2.1 靶基因本体(Gene Ontology, GO)富集分析
在DAVID网站对221个AD的已知靶基因使用Gene Ontology做功能富集分析,以P<0.05(FDR校正)为标准筛选得到显著富集的78个生物学过程.
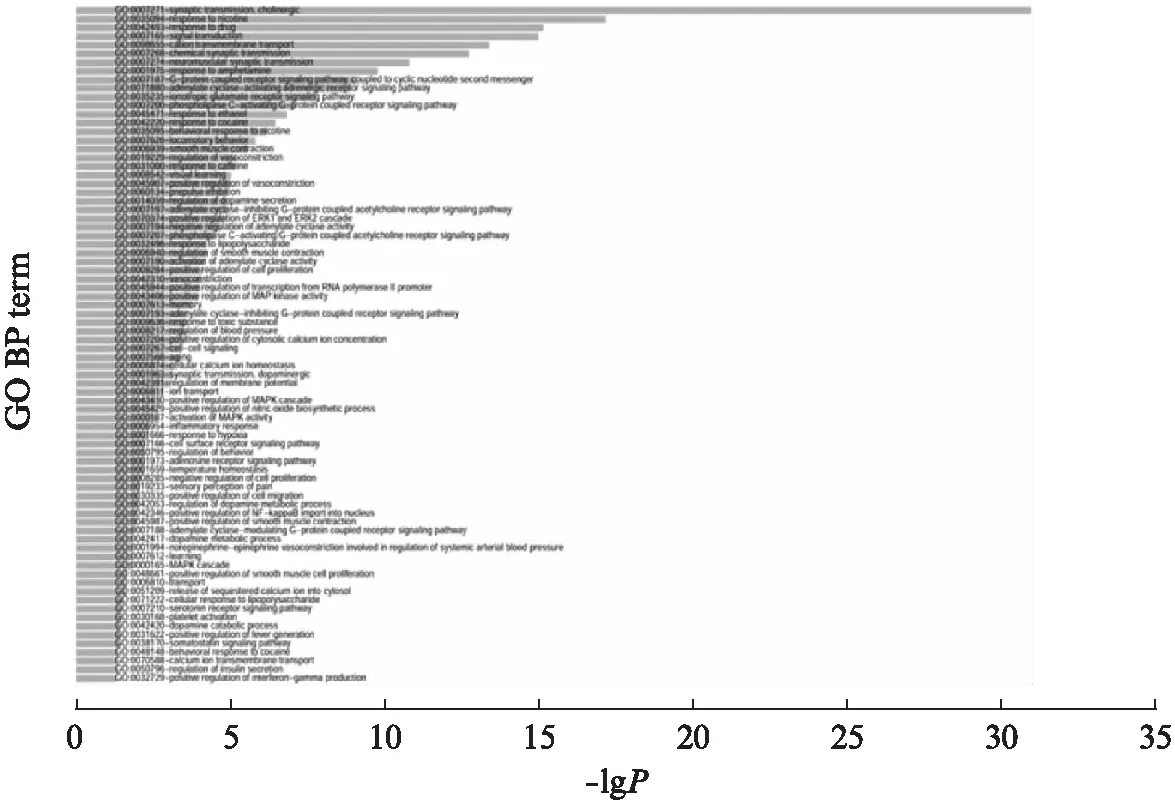
图1 已知AD靶基因功能富集生物过程Fig.1 Functional enrichment biological process of known AD target genes从上到下包括GO:0007271,0035094,0042493,0007165,0098655,0007268,0007274,0001975,0007187,0071880,0035235,0007200,0045471,0042220,0035095,0007626,0006939,0019229,0031000,0008542,0045907,0060134,0014059,0007197,0070374,0007194,0007207,0032496,0006940,0007190,0008284,0042310,0045944,0043406,0007613,0007193,0009636,0008217,0007204,0007267,0007568,0006874,0001963,0042391,0006811,0043410,0045429,0000187,0006954,0001666,0007166,0050795,0001973,0001659,0008285,0019233,0030335,0042053,0042346,0045987,0007188,0042417,0001994,0007612,0000165,0048661,0006810,0051209,0071222,0007210,0030168,0042420,0031622,0038170,0048148,0070588,0050796,0032729.
由图1可知,已知的AD靶基因主要与胆碱能传递、尼古丁反应、药物反应、信号转导、阳离子转运、化学传播、神经肌肉突触传播等生物学过程相关.这些生物学过程已有多项被报道与AD有关.例如,实验证实尼古丁可在体外分解预先形成的β-淀粉样蛋白原纤维[12].而胆碱能传递更是与AD治疗息息相关,有研究发现新分子能够通过靶向胆碱能系统,直接对胆碱受体进行刺激并加入到乙酰胆碱酯酶抑制剂中,抑制β-淀粉样蛋白聚集[13].此外,与谷氨酸能功能障碍相关的化学生物学过程也与治疗AD有密切关系[14].而涉及神经肌肉突触传播的生物学过程的突触功能障碍和认知衰退也被证明是阿尔茨海默病的早期特征[15].尽管如此,富集的78个生物学过程仍有一些并未发现有与AD相关的直接研究证据,如阳性调节平滑肌细胞增殖、钙离子跨膜运输等.基于我们的分析结果,这些尚未有证据证明与AD相关的生物学功能特征,或许将是未来阿尔茨海默症研究领域的新方向.
基于上述对78个生物学过程与AD相关性的分析,我们有理由相信参与这些生物过程的基因也与AD相关.而后通过编写程序获取78个生物学过程在GO数据库中相关的所有基因,即ADTarget_BP,共3350个.
2.2 AD靶基因预测结果
对AD的221个已知靶基因作网络距离校正,得到Dadj,并计算得到AD靶基因子网络的平均距离为0.7089,通过编写程序从19038个基因中随机抽取子网络10000次,每次抽取与已知靶基因相同数量的221个基因,得出的子网络平均距离分布见图2(看54页).
由图2可知,AD靶基因子网络平均距离显著小于随机子网络平均距离(P<10-4),即AD靶基因在整个基因网络中显著聚集.因此使用GenePANDA对AD的靶基因进行预测,结果将更可靠.
将收集到的221个AD靶基因输入至GenePANDA预测工具后,我们得到整个基因网络中所有关于AD靶基因的预测结果,即19038个基因的分值排名.本次研究截取分值排名前100的预测靶基因作为研究对象.将其中已知AD靶基因去除后,得到预测的AD靶基因集合,ADTarget_GP,共有86个基因.而后,将ADTarget_GP与上述ADTarget_BP取交集,最终得到预测的AD靶基因集,即ADTarget_PT,共有66个基因.对66个预测AD的靶基因进行文献查阅验证,验证结果如表1所示.

图2 已知AD靶基因子网络示意图及其平均距离Fig.2 Gene sub-network diagram and its average distance of known AD target genes

表1 阿尔茨海默症预测靶基因验证结果表
通过查询文献,上述报道有用于治疗AD的靶基因或与AD直接相关的基因共有30个基因.例如,氧杂双环庚烯磺酸盐通过激活GPER1,提供了针对增强胶质细胞存活的保护,从而治疗AD[16].还有实验证明导致AD中海马POMC电路缺陷的潜在细胞机制很重要,识别补充POMC衍生肽的储存和维持MC4R活化的方法对于缓解海马突触可塑性损伤至关重要,因此POMC/MC4R电路是AD相关认知功能障碍的潜在治疗靶点[17].M13家族的酶已被确定为脑内Aβ分解代谢的主要介质.因此,这些酶对AD具有显著的病理和治疗意义.而大脑中SSTR4作用的选择性增强有可能通过调节这些酶来减轻毒性Aβ42寡聚体的积累[18].另外,有研究证明GALR2参与对空间记忆障碍和海马Aβ聚集的保护作用[19].
2.3 治疗AD药物预测结果
上述文献验证的研究结果表明预测得到的AD靶基因(ADTarget_PT)与AD密切相关,靶向这些基因的药物则可潜在治疗AD.因此,本研究进一步从DrugBank药物数据库(full database.xml)中挖掘靶向66个预测的靶基因的药物,进一步获得我们预测靶基因的研究价值.在66个预测的靶基因中,18个基因有对应的靶向药物.最终共得到44种可潜在用于治疗AD的药物,其中有10种药物已被研究可用于治疗AD,详见表2.

表2 DrugBank中靶向预测基因的药物
*: 已被研究可用于治疗阿尔茨海默症的药物.
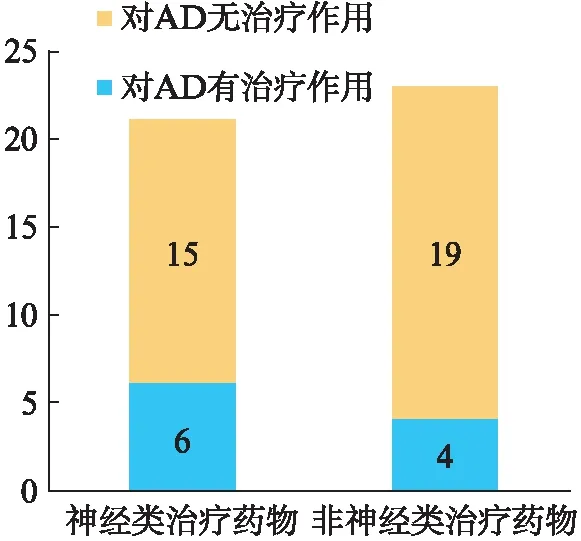
图3 预测用于治疗AD药物分类图Fig.3 Classification of predicted drugs for the treatment of AD
在这44种药物中有21种药物是可被用于治疗抑郁症、偏头痛等疾病的神经类治疗药物,另外23种药物是可被用于治疗艾滋病、哮喘等疾病的非神经类治疗药物(图3,看56页).在神经类治疗药物中有阿米替林、奥氮平、氯氮平、阿莫沙平、α-氨基异丁酸和组胺共6种药物对AD有治疗作用.例如,阿米替林是预测得到的用于治疗各型抑郁症或抑郁状态的神经类治疗药物.有研究显示,阿米替林在老年患者损伤的AD脑中具有显著的治疗作用,并且它显示出作为治疗AD的可耐受的新型治疗剂的希望[20].此外,阿莫沙平也是预测得到的神经类治疗药物,它是一种二苯并氧氮卓三环类抗抑郁药.研究表明,阿莫沙平通过多种HTR6介导的靶标(包括β-arrestin2和CDK5)降低了Aβ的产生.阿莫沙平虽然不再是治疗抑郁症的一线药物,但可能有益于治疗AD,而进一步用三氯乙酸(TCA)对其结构进行修饰发现,它可作为治疗AD的理想治疗剂[21].在非神经类治疗药物中有地塞米松、吲哚美辛、舒林酸和酮洛芬共4种药物对AD有治疗作用.例如,地塞米松是一种抗炎糖皮质激素,可用于治疗哮喘、风湿性疾病等.有实验发现地塞米松在特异性位点显著降低了由糖原合酶激酶-3β蛋白水平活性降低介导的tau磷酸化,在改善AD认知障碍中起重要作用[22].
3 讨 论
本次AD靶基因和药物的预测研究,通过整理其已知靶基因,使用功能富集分析、网络分析预测、数据匹配和大量文献查阅等方式得到的实验结果将为AD药物的开发和临床治疗提供重要的参考意义.预测得到的66个基因中,一些基因是被上述文献证实是有效作用于AD的靶基因或与AD直接相关的靶基因,一些基因则是与脑神经相关的靶基因,而另一些虽没有被报道,也为后续的科学研究提供可行性依据.
此外,AD药物开发成本高,近几年许多大公司诸如辉瑞(Pfizer)、强生(JNJ)、礼来(Eli Lilly)和罗氏(Roche)等均为此折戟,同时这些公司也因巨额的药物开发成本而受到非常沉重的打击.截至目前,始终没有一款对AD完全有效,并且适用于所有患者的治疗药物.本次研究预测得到6种神经类治疗药物和4种非神经类治疗药物均已被研究可用于治疗AD.Hirohata等研究得到非甾体抗炎药(Non-Steroidal Anti-Inflammatory Drugs,NSAID)可以抑制来自Aβ的fAβ形成和体外预先形成的fAβ,对AD β-淀粉样蛋白原纤维具有抗淀粉样变性作用,可有望预防和治疗AD[23].而本研究预测得到可用与治疗AD的4种非神经类治疗药物除上述地塞米松外,余下3种药物吲哚美辛、舒林酸和酮洛芬均属于非甾体抗炎药.而6种神经类治疗药物中,α-氨基异丁酸被Gozes等研究证明可以保护神经元抵抗AD相关的Aβ1-42毒性,抑制tau衍生肽的聚集[24].而余下的5种预测药物阿米替林、奥氮平、氯氮平、阿莫沙平和组胺均是靶向与AD有直接关系的HRH4基因(表2).低剂量奥氮平似乎对于治疗老年患者的AD引起的行为障碍和精神病症状而言是有效的,并有良好的耐受性[25].而Choi等认为氯氮平可作为AD治疗多靶标方法的候选者[26].此外,有研究显示组胺有利于AD病理的治疗[27].
预测药物靶基因的一个应用方面是帮助新药物的开发[28],而药物靶基因的研究是开发新药最重要的一个组成部分,研究人员可以根据预测的靶基因设计并合成作用化合物.随后进行有关实验,可以有效节约新药开发的时间经济成本[29].药物靶基因预测的另一个应用方面是药物重新审视定位[28],通过预测靶基因挖掘已知靶向药物.尽管这些靶向药物原本被用于治疗其他疾病,但对它们进行筛选、修饰或许能够发现其具有治疗AD的新用途[30].
综上所述,本研究预测得出的靶基因以及可潜在用于治疗AD的药物,将为AD的临床药物治疗提供更多的选择,也为后续的药物开发提供新思路和线索.
参考文献:
[1] LUKIW W J. Circular RNA(circRNA) in Alzheimer’s disease(AD) [J].FrontGenet, 2013,4: 307.
[2] REDDY P H, TONK S, KUMAR S, et al. A critical evaluation of neuroprotective and neurodegenerative MicroRNAs in Alzheimer’s disease [J].BiochemBiophysResCommun, 2017,483(4): 1156-1165.
[3] LAFERLA F M, GREEN K N, ODDO S. Intracellular amyloid-beta in Alzheimer’s disease [J].NatRevNeurosci, 2007,8(7): 499-509.
[4] KUMAR P, DEZSO Z, MACKENZIE C, et al. Circulating miRNA biomarkers for Alzheimer’s disease [J].PLoSOne, 2013,8(7): e69807.
[5] MATTSON M P. Pathways towards and away from Alzheimer’s disease [J].Nature, 2004,430(7000): 631-639.
[6] REDDY P H, MANCZAK M, MAO P, et al. Amyloid-beta and mitochondria in aging and Alzheimer’s disease: Implications for synaptic damage and cognitive decline [J].JAlzheimersDis, 2010,20(Suppl 2): 499-512.
[7] PRINCE M, BRYCE R, ALBANESE E, et al. The global prevalence of dementia: A systematic review and metaanalysis [J].AlzheimersDement, 2013,9(1): 63-75.
[8] SCHELTENS P, BLENNOW K, BRETELER M M, et al. Alzheimer’s disease [J].Lancet, 2016,388(10043): 505-517.
[9] SPERLING R, MORMINO E, JOHNSON K. The evolution of preclinical Alzheimer’s disease: Implications for prevention trials [J].Neuron, 2014,84(3): 608-622.
[10] LAW V, KNOX C, DJOUMBOU Y, et al. DrugBank 4.0: Shedding new light on drug metabolism [J].NucleicAcidsRes, 2014,42(Database issue): D1091-1097.
[11] YIN T, CHEN S, WU X, et al. GenePANDA—a novel network-based gene prioritizing tool for complex diseases [J].SciRep, 2017,7: 43258.
[12] ONO K, HASEGAWA K, YAMADA M, et al. Nicotine breaks down preformed Alzheimer’s beta-amyloid fibrils in vitro [J].BiolPsychiatry, 2002,52(9): 880-886.
[13] SIMONI E, BARTOLINI M, ABU I F, et al. Multitarget drug design strategy in Alzheimer’s disease: Focus on cholinergic transmission and amyloid-beta aggregation [J].FutureMedicinalChemistry, 2017,9(10): 953-963.
[14] ZADORI D, VERES G, SZALARDY L, et al. Glutamatergic dysfunctioning in Alzheimer’s disease and related therapeutic targets [J].JAlzheimersDis, 2014,42(Suppl 3): 177-187.
[15] KLEVANSKI M, HERRMANN U, WEYER S W, et al. The APP intracellular domain is required for normal synaptic morphology, synaptic plasticity, and hippocampus-dependent behavior [J].JournalofNeuroscience, 2015,35(49): 16018-16033.
[16] DENG L J, CHENG C, WU J, et al. Oxabicycloheptene sulfonate protects against beta-amyloid-induced toxicity by activation of PI3K/Akt and ERK signaling pathways via GPER1 in C6 cells [J].NeurochemRes, 2017,42(8): 2246-2256.
[17] SHEN Y, TIAN M, ZHENG Y, et al. Stimulation of the hippocampal POMC/MC4R circuit alleviates synaptic plasticity impairment in an Alzheimer’s disease model [J].CellRep, 2016,17(7): 1819-1831.
[18] SANDOVAL K E, FARR S A, BANKS W A, et al. Somatostatin receptor subtype-4 agonist NNC 26-9100 mitigates the effect of soluble Abeta(42) oligomers via a metalloproteinase-dependent mechanism [J].BrainRes, 2013,1520: 145-156.
[19] LI L, YU L, KONG Q. Exogenous galanin attenuates spatial memory impairment and decreases hippocampal beta-amyloid levels in rat model of Alzheimer’s disease [J].IntJNeurosci, 2013,123(11): 759-765.
[20] CHADWICK W, MITCHELL N, CAROLL J, et al. Amitriptyline-mediated cognitive enhancement in aged 3xTg Alzheimer’s disease mice is associated with neurogenesis and neurotrophic activity [J].PLoSOne, 2011,6(6): e21660.
[21] LI X, WANG Q, HU T, et al. A tricyclic antidepressant, amoxapine, reduces amyloid-beta generation through multiple serotonin receptor 6-mediated targets [J].SciRep, 2017,7(1): 4983.
[22] JOSHI Y B, CHU J, PRATICO D.Stress hormone leads to memory deficits and altered tau phosphorylation in a model of Alzheimer’s disease [J].JAlzheimersDis, 2012,31(1): 167-176.
[23] HIROHATA M, ONO K, NAIKI H, et al. Non-steroidal anti-inflammatory drugs have anti-amyloidogenic effects for Alzheimer’s beta-amyloid fibrils in vitro [J].Neuropharmacology, 2005,49(7): 1088-1099.
[24] GOZES I, SCHIRER Y, IDAN-FELDMAN A, et al. NAP alpha-aminoisobutyric acid(IsoNAP) [J].JMolNeurosci, 2014,52(1): 1-9.
[25] STREET J S, CLARK W S, KADAM D L, et al. Long-term efficacy of olanzapine in the control of psychotic and behavioral symptoms in nursing home patients with Alzheimer’s dementia [J].IntJGeriatrPsychiatry, 2001,16(Suppl 1): 62-70.
[26] CHOI Y, JEONG H J, LIU Q F, et al. Clozapine improves memory impairment and reduces abeta level in the Tg-APPswe/PS1dE9 mouse model of Alzheimer’s disease [J].MolNeurobiol, 2017,54(1): 450-460.
[27] PATNAIK R, SHARMA A, SKAPER S D, et al. Histamine H3 inverse agonist BF 2649 or antagonist with partial H4 agonist activity clobenpropit reduces amyloid beta peptide-induced brain pathology in alzheimer’s disease [J].MolNeurobiol, 2017(4) : 1-10.
[28] EMIG D, IVLIEV A, PUSTOVALOVA O, et al. Drug target prediction and repositioning using an integrated network-based approach [J].PLoSOne, 2013,8(4): e60618.
[29] DREWS J. Drug discovery: A historical perspective [J].Science, 2000,287(5460): 1960-1964.
[30] LANGEDIJK J, MANTEL-TEEUWISSE A K, SLIJKERMAN D S, et al. Drug repositioning and repurposing: Terminology and definitions in literature [J].DrugDiscovToday, 2015,20(8): 1027-1034.
