巴戟天中环烯醚萜苷和蒽醌在电喷雾离子源负离子模式下的质谱裂解行为
2018-05-14赵祥升杨美华吴海峰舒晓燕
赵祥升,杨美华,吴海峰,舒晓燕
(1.中国医学科学院药用植物研究所海南分所,海南 海口 571100;2.中国医学科学院药用植物研究所,北京 100193;3.西南科技大学生命科学与工程学院,四川 绵阳 621010)
巴戟天为茜草科多年生植物巴戟天(MorindaofficinalisHow)的干燥根,是我国著名的南药和保健药材,具有补肾阳、强筋骨、祛风湿之功效,在临床上主要用于治疗阳痿遗精、宫冷不孕、月经不调、少腹冷痛、风湿痹痛、筋骨萎软等症[1]。巴戟天主要分布于广东、海南、广西、福建等热带和亚热带地区[2],主要活性成分为环烯醚萜苷类、蒽醌类和多糖[3-4]。目前,从巴戟天中已分离得到7种环烯醚萜苷和34种蒽醌类化合物[5],并对这些化合物进行了定性和定量分析[6-8],但尚未见巴戟天中主要环烯醚萜苷类和蒽醌类化合物裂解行为的报道。
液相色谱-质谱联用技术是快速分离和鉴定天然药物中活性成分的有效方法,电喷雾-四极杆-飞行时间质谱(ESI-Q-TOF MS)等高分辨质谱技术凭借其在质量精度、全质量数据采集、数据可溯源性等方面的优势,越来越广泛地应用于中药分析领域[9-10]。利用LC-Q-TOF MS 既可以获得化合物的分子离子信息,又可以在碰撞碎裂后获得丰富的离子碎片信息,有助于准确推测其可能的分子式以及化合物的结构和裂解规律[11]。环烯醚萜苷类和蒽醌类化合物在电喷雾负离子模式下有较高的灵敏度,能够获得丰富的碎片离子信息[12-13]。
本工作拟在UPLC-ESI-Q/TOF MS负离子模式下,对巴戟天中主要的4种环烯醚萜苷(水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷)和2种蒽醌类(甲基异茜草素和甲基异茜草素-1-甲醚)化合物的质谱裂解行为进行研究,以期为其他同类化合物的结构鉴定提供技术依据。
1 实验部分
1.1 主要仪器与装置
Waters AcquityTMUPLC 色谱仪,Waters Xevo G2-XS四极杆-飞行时间质谱仪:美国Waters公司产品;Mili-Q超纯水系统:美国Millipore公司产品;DK-S型电热恒温水浴锅:上海森信实验仪器有限公司产品;XS105DU电子分析天平:上海托利多有限公司产品。
1.2 材料与试剂
巴戟天:采自海南,经中国医学科学院药用植物研究所海南分所南药资源中心鉴定为茜草科植物巴戟天(MorindaofficinalisHow)的根;甲醇、乙腈、甲酸:均为色谱纯,美国Thermo Fisher公司产品;实验用水:Mili-Q超纯水;水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸和车叶草苷对照品:纯度>98%,上海同田生物科技有限公司产品;甲基异茜草素和甲基异茜草素-1-甲醚对照品:纯度>98%,成都克洛玛生物科技有限公司产品。6种对照品的结构式示于图1。
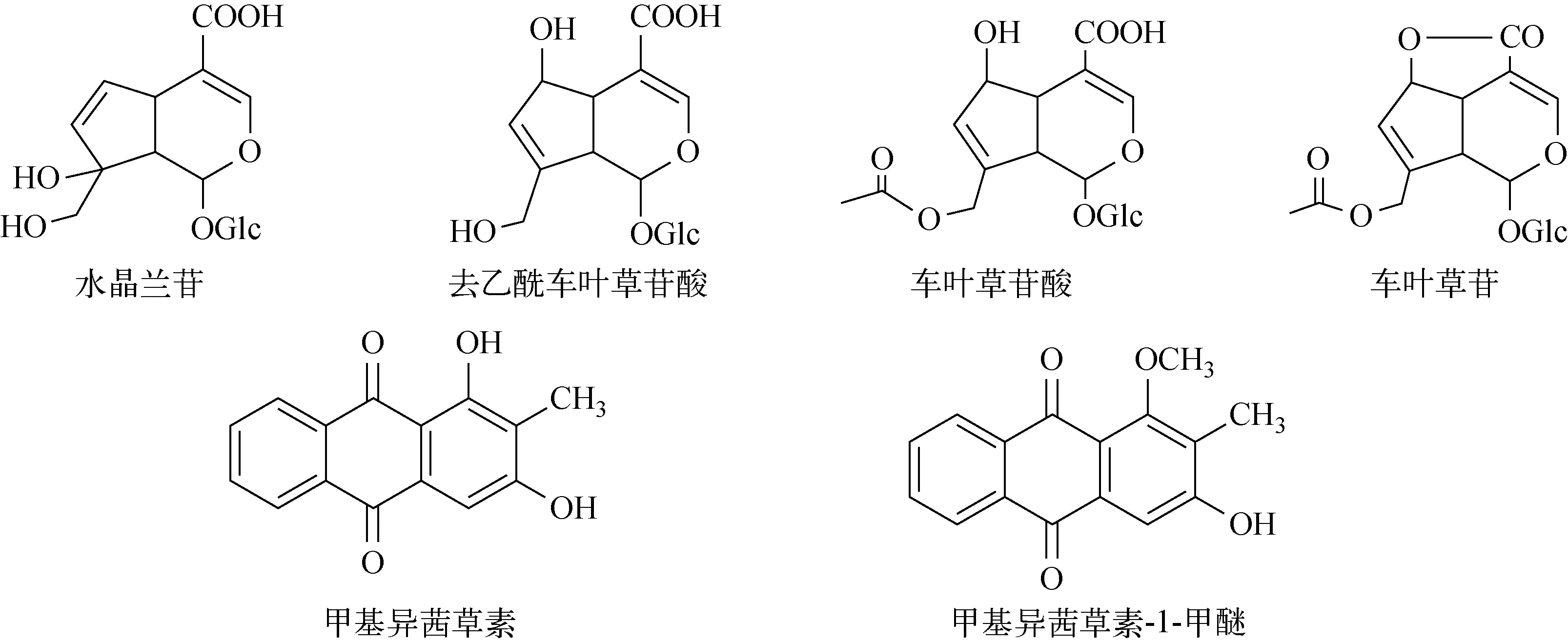
图1 6种对照品的结构式Fig.1 Chemical structures of 6 compounds
1.3 实验条件
电喷雾离子源(ESI),负离子扫描模式;毛细管电压2.5 kV;锥孔电压50 V;离子源温度125 ℃;校正液为亮氨酸脑啡肽;质量扫描范围m/z50~1 200;脱溶剂气(N2)流速800 L/h;脱溶剂气温度600 ℃;碰撞气为氩气;注射泵直接进样。
1.4 供试溶液的制备
精密称取适量的水晶兰苷、去乙酰车叶草苷酸、车叶草苷酸、车叶草苷、甲基异茜草素和甲基异茜草素-1-甲醚对照品,用甲醇溶解,并定容至25 mL容量瓶中,摇匀,使对照品浓度为1 mg/L,过0.22 μm滤膜,即得供试溶液。
2 结果与讨论
2.1 质谱分析
电喷雾电离是一种软电离技术,易得到相对分子质量信息,但利用该技术产生的准分子离子内能较小,产生的碎片离子较少[14]。在ESI-模式下的一级质谱中,6种对照品化合物均检测到脱氢准分子离子峰[M-H]-,几乎没有碎片离子,易于确定化合物的相对分子质量。在得到准分子离子后,调整碰撞诱导解离能,可获得丰富的结构信息,6种化合物[M-H]-离子的ESI-MS/MS谱图示于图2。
2.2 二级质谱裂解规律分析
2.2.1环烯醚萜苷 环烯醚萜类化合物的基本母核是环烯醚萜醇,具有环状烯醚及半缩醛羟基,半缩醛羟基性质活泼,故该类化合物多以苷类存在[15]。巴戟天中的环烯醚萜苷属于环戊烯型,由1个特征的二氢吡喃环顺式连接1个五元环。通常,该类化合物首先丢失中性分子H2O、CO2、葡萄糖残基等,其次是二氢吡喃环和糖环(葡萄糖)的断裂[12]。以车叶草苷酸为例,二氢吡喃环和糖环的断裂途径示于图3,其母环断裂后形成的特征离子可用于鉴别母核结构[12,15]。

注:a.水晶兰苷;b.去乙酰车叶草苷酸;c.车叶草苷酸;d.车叶草苷;e.甲基异茜草素;f.甲基异茜草素-1-甲醚图2 6种化合物[M-H]-离子的ESI-MS/MS图谱Fig.2 ESI-MS/MS spectra of [M-H]- ions of 6 compounds
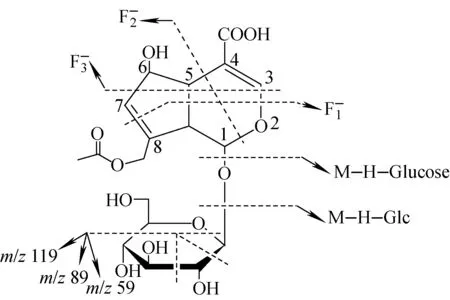
图3 环烯醚萜苷类化合物的裂解途径Fig.3 Fragmentation pathway of iridoid glycosides
调节碰撞电压,对车叶草苷酸的准分子离子[M-H]-m/z431进行CID分析,产生了m/z371、269、251、225、191、165、147、179、119等碎片离子(图2c),其中m/z371比m/z431减少了60 u,推测可能是C8位上中性丢失了1分子CH3COOH,而相似的丢失也发生在m/z191与m/z251之间。在环烯醚萜苷的MS/MS中,中性丢失葡萄糖残基(162 u,Glc)和葡萄糖(180 u,Glucose)比较常见,离子m/z269 (m/z431-162 u)和m/z251(m/z431-180 u)均是由此产生的。碎片离子m/z225、251是由前体离子m/z269脱去C4(6)上的CO2和H2O 分子形成;m/z251 进一步失去1分子CO2得到碎片离子m/z207。此外,还发现了脱去乙烯酮(C2H2O)的现象,如m/z183(m/z225 -C2H2O)、m/z165(m/z207-C2H2O)的形成。由上述分析可知,车叶草苷酸主要的裂解途径是丢失Glc、CO2、H2O、CH3COOH、C2H2O等母环上的功能基团。

图4 ESI负离子模式下,车叶草苷酸可能的裂解途径 Fig.4 Proposed fragmentation pathways of asperulosidic acid in ESI-MS/MS

车叶草苷的结构和质谱裂解途径与车叶草苷酸类似,但其裂解途径较车叶草苷酸简单,在MS/MS中形成的碎片离子较少,主要有m/z147、191等(图2c),这些离子主要是由母环脱去取代基生成的。但增加解离电压后,没有发现二氢吡喃环断裂的特征离子,只发现了糖环断裂特征离子m/z119。ESI负离子模式下车叶草苷的裂解行为示于图5。
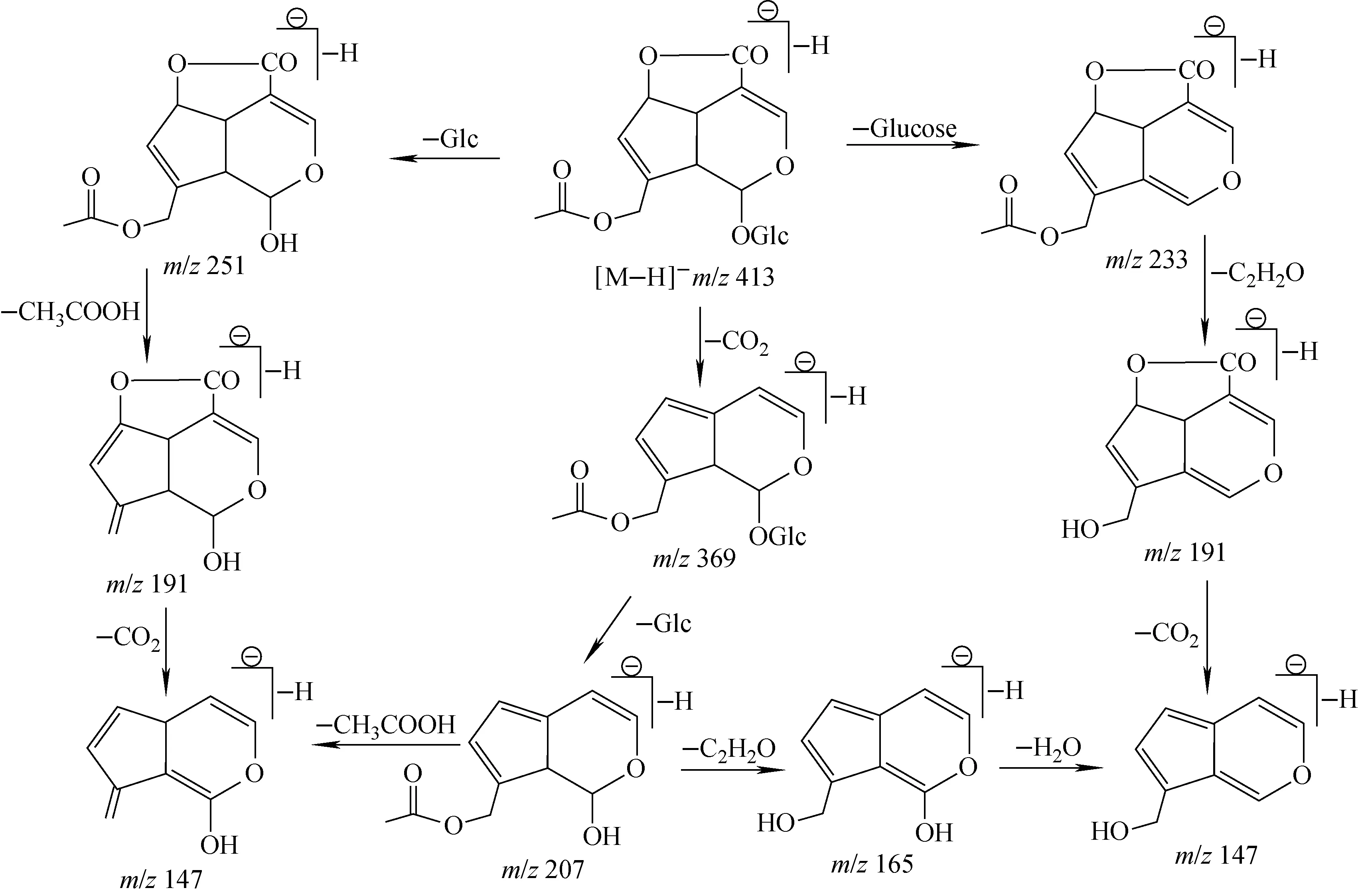
图5 ESI负离子模式下,车叶草苷可能的裂解途径 Fig.5 Proposed fragmentation pathways of asperuloside in ESI-MS/MS
去乙酰车叶草苷酸的结构与车叶草苷酸类似,仅脱去1分子乙烯酮。在MS/MS中,去乙酰车叶草苷酸主要脱去母核的取代基,如H2O、CO2、葡萄糖残基或葡萄糖。碎片离子m/z371、345、227、209是由准分子离子m/z389[M-H]-分别脱去1分子H2O、CO2、葡萄糖残基和葡萄糖形成;离子m/z371、209、191失去1分子CO2,形成碎片离子m/z327、165、147;离子m/z327、191、165、147也有可能由其前体离子(m/z345、209、183、165)失去1分子H2O形成。去乙酰车叶草苷酸中母环和糖环也发生了断裂,形成了m/z119、113、101、89、71、59等离子,但母环较糖环断裂后形成的碎片离子丰度低。去乙酰车叶草苷酸可能的裂解途径示于图6。
水晶兰苷为去乙酰车叶草苷酸的同分异构体,二者的质谱裂解行为类似,主要是母核上取代基的丢失和糖环的断裂,但碎片离子丰度不同。水晶兰苷在ESI负离子模式下可能的裂解途径示于图7,其裂解行为在越桔属植物中已有报道[19]。
2.2.2蒽醌 蒽醌类化合物中,酚羟基上O原子和苯环间存在p-π共轭,共轭体系结构决定了其分子的稳定性。在质谱选择性离子碰撞诱导解离中,该类化合物的主要裂解方式是逐级失去母核基团中CO并保留共轭体系。此外,侧链取代基(主要为OH、CH3、OCH3、COOH)容易以H2O、CH3、CH2、 CO2等中性小分子片段的形式丢失[20-21]。
甲基异茜草素与甲基异茜草素-1-甲醚的结构相似,仅C1位的取代基(OH、OCH3)不同,在ESI负离子模式下均能生成信号较强的[M-H]-准分子离子(m/z253和m/z267),二者可能的裂解途径示于图8。在MS/MS下,离子m/z225和m/z209 由分子离子峰[M-H]-m/z253 分别丢失1分子CO和CO2所得;m/z225继续失去1分子CO得到m/z197 碎片离子;离子m/z209分别失去1分子CO和CH2得到碎片离子m/z181 和m/z195。甲基异茜草素-1-甲醚准分子离子峰[M-H]-m/z267 的裂解比甲基异茜草素简单,主要产生了m/z252 [M-H-CH3]-和m/z224 [M-H-CH3-CO]-2个碎片离子。

图6 ESI负离子模式下,去乙酰车叶草苷酸可能的裂解途径Fig.6 Proposed fragmentation pathways of deacetyla sperulosidic acid in ESI-MS/MS

图7 ESI负离子模式下,水晶兰苷可能的裂解途径Fig.7 Proposed fragmentation pathways of monotropein in ESI-MS/MS

图8 ESI负离子模式下,甲基异茜草素可能的裂解途径Fig.8 Proposed fragmentation pathways of rubiadin in ESI-MS/MS
3 结论
使用ESI-Q-TOF MS/MS技术研究了巴戟天中4种环烯醚萜苷和2种蒽醌类化合物的裂解行为,分析了化合物在负离子模式下主要的特征碎片离子、裂解模式和相应的质谱图。环烯醚萜苷在ESI-模式下主要的裂解途径首先是脱去母环上的功能取代基,如H2O、CO2、CH3COOH和糖单元等;其次是母环上半缩醛结构的异构化造成二氢吡喃环和糖环的断裂。而蒽醌类化合物,逐级丢失CO和取代基是该类成分主要的裂解途径。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典2015年版(一部)[M]. 北京:中国医药科技出版社,2015:81.
[2] YONG J P, LU C Z, HUANG S J, et al. Chemical components isolated from the roots ofMorindaofficinalis[J]. Chemistry of Natural Compounds, 2015, 51(3): 548-549.
[3] CHOI J, LEE K T, CHOI M Y, et al. Antinociceptive anti-inflammatory effect of Monotropein isolated from the root ofMorindaofficinalis[J]. Biological & Pharmaceutical Bulletin, 2005, 28(10): 1 915-1 918.
[4] ZHANG H L, ZHANG Q W, ZHANG X Q, et al. Chemical constituents from the roots ofMorindaofficinalis[J]. Chinese Journal of Natural Medicines, 2010, 8(3): 192-195.
[5] 黄珍珍. 巴戟天的化学成分及其生物活性研究[D]. 广州:广州中医药大学,2013.
[6] 吴凌凤,曾令杰. 巴戟天化学成分与质量控制研究进展[J]. 广东药学院学报,2012,28(1):98-101.
WU Lingfeng,ZENG Lingjie. Chemical constituents from the roots ofMorindaofficinalisand the quality control[J]. Journal of Guangdong Pharmaceutical University, 2012, 28(1): 98-101(in Chinese).
[7] LI C, DONG J, TIAN J, et al. LC/MS/MS determination and pharmacokinetic study of iridoid glycosides monotropein and deacetylasperulosidic acid isomers in rat plasma after oral administration ofMorindaofficinalisextract[J]. Biomedical Chromatography, 2015, 30(2): 163-168.
[8] 王美玲,张清清,付爽,等. UPLC-Q-TOF MSE技术结合UNIFI数据库筛查方法快速分析巴戟天化学成分[J]. 质谱学报,2017,38(1):75-82.
WANG Meiling, ZHANG Qingqing, FU Shuang, et al. Characterization ofMorindaofficinalisHow by UPLC-Q-TOF MSEcoupled with UNIFI Database filter[J]. Journal of Chinese Mass Spectrometry Society, 2017, 38(1): 75-82(in Chinese).
[9] WU H, GUO J, CHEN S, et al. Recent developments in qualitative and quantitative analysis of phytochemical constituents and their metabolites using liquid chromatography-mass spectrometry[J]. Journal of Pharmaceutical & Biomedical Analysis, 2013, 72(2): 267-291.
[10] LING Y, LIU K, ZHANG Q, et al. High performance liquid chromatography coupled to electrospray ionization and quadrupole time-of-flight-mass spectrometry as a powerful analytical strategy for systematic analysis and improved characterization of the major bioactive constituents from Radix[J]. Journal of Pharmaceutical & Biomedical Analysis, 2014, 98(10): 120-129.
[11] 孟哲,石志红,吕运开,等. 超高效液相色谱-高分辨四极杆飞行时间质谱法快速筛查乳制品中磺胺类与氟喹诺酮类药物[J]. 分析化学,2014,42(10):1 493-1 500.
MENG Zhe, SHI Zhihong, LV Yunkai, et al. Rapid screening of fluoroquinolones and sulfonamides in dairy products using ultra performance liquid chromatography coupled to high resolution quadrupole time-of-flight mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2014, 42(10): 1 493-1 500(in Chinese).
[12] 李存满,梁鑫淼,薛兴亚. 电喷雾离子源正离子模式下环烯醚萜苷的质谱裂解行为[J]. 高等学校化学学报,2013,34(3):567-572.
LI Cunman, LIANG Xinmiao, XUE Xingya. Electrospray ionization quadrupole time-of-flight tandem mass spectrometry of iridoid Glucosieds in positive ion mode[J]. Chemical Journal of Chinese Universtiy, 2013, 34(3): 567-572(in Chinese).
[13] 董静,王弘,万乐人,等. 高效液相色谱/电喷雾-离子阱-飞行时间质谱分析鉴定中药虎杖中的主要化学成分[J]. 色谱,2009,27(4):425-430.
DONG Jing, WANG Hong, WAN Leren, et al. Identification and determination of major constituents inPolygonumcuspidatumSieb.et Zucc by high performance liquid chromatography/electrospray ionization-ion trap-time-of-flight mass spectrometry[J]. Chinese Journal of Chromatography, 2009, 27(4): 425-430(in Chinese).
[14] 李娟,宋树美,王少敏,等. 电喷雾质谱法研究4种青蒿素类药物的质谱裂解特征[J]. 质谱学报,2009,30(3):148-153.
LI Juan, SONG Shumei, WANG Shaomin, et al. Study of fragmentation behavior for 4 artemisinins by electrospray ionization mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2009, 30(3): 148-153(in Chinese).
[15] 李存满,骆亚薇,田宝勇. 环烯醚萜苷类化合物的质谱裂解规律研究进展[J]. 河北师范大学学报,2015,39(6):522-526.
LI Cunman, LUO Yawei, TIAN Baoyong. Research progress on mass spectral fragmentation of iridoids[J]. Journal of Hebei Normal University, 2015, 39(6): 522-526(in Chinese).
[16] LI C M, ZHANG X L, XUE X Y, et al. Structural characterization of iridoid glucosides by ultra-performance liquid chromatography/electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry Rcm, 2008, 22(12): 1 941-1 954.
[17] REN L, XUE X, ZHANG F, et al. Studies of iridoid glycosides using liquid chromatography/electrospray ionization tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry Rcm, 2007, 21(18): 3 039-3 050.
[18] ES-SAFI N E, KERHOAS L, DUCROT P H. Fragmentation study of iridoid glucosides through positive and negative electrospray ionization, collision-induced dissociation and tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry Rcm, 2007, 21(7): 1 165-1 175.
[19] HEFFELS P, MÜLLER L, SCHIEBER A, et al. Profiling of iridoid glycosides in Vaccinium species by UHPLC-MS[J]. Food Research International, 2017, 100: 462-468.
[20] 董红娇,陈晓虎,曾锐. UPLC-Q-Exactive 四极杆-静电场轨道阱高分辨质谱联用快速分析民族药小大黄的化学成分[J]. 中草药,2016,47(14):2 428-2 435.
DONG Hongjiao, CHEN Xiaohu, ZENG Rui. Rapid analysis on chemical constituents in roots of Rheum pumilum by UPLC coupled with hybrid quadrupole-orbitrap MS[J]. Chinese Traditional and Herbal Drugs,2016, 47(14): 2 428-2 435(in Chinese).
[21] 陈毅,单鸣秋,王海丽,等. UPLC-Q-TOF-MS分析茜草炒炭前后的化学成分变化[J]. 中国中药杂志,2017,42(5):923-930.
CHEN Yi, SHAN Mingqiu, WANG Haili, et al. Changes of chemical constituents in Rubiae Radix et Rhizoma before and after carbonized by UPLC-Q-TOF-MS method[J]. China Journal of Chinese Materia Medica, 2017, 42(5): 923-930(in Chinese).
