水稻根际和非根际土磷酸酶活性对碳、磷添加的响应
2018-05-14刘玉槐魏晓梦魏亮祝贞科葛体达张艳杰鲁顺保吴金水
刘玉槐,魏晓梦,魏亮,祝贞科,葛体达,张艳杰,鲁顺保,吴金水
水稻根际和非根际土磷酸酶活性对碳、磷添加的响应
刘玉槐1, 2,魏晓梦2,魏亮2,祝贞科2,葛体达2,张艳杰1,鲁顺保1,吴金水2
(1江西师范大学生命科学学院,南昌 330022;2中国科学院亚热带农业生态研究所/亚热带农业生态过程重点实验室,长沙 410125)
【目的】研究外源养分添加对稻田土壤磷酸酶活性影响的特征,明确水稻根际和非根际土壤胞外磷酸酶活性对碳、磷添加的响应过程,为稻田土壤水肥管理,实现农业可持续利用提供理论指导。【方法】选取湖南长期种植水稻的典型缺磷水稻土,进行盆栽试验。试验设置4个处理,分别为不添加碳磷(CK)、添加碳(C)、添加磷(P)和添加碳磷(CP)。采用96微孔荧光法测定根际土与非根际土的酸性磷酸酶(ACP)和碱性磷酸酶(ALP)活性,同时基于生物可利用性的磷分级方法(BBP法)测量4种磷组分(CaCl2-P、Citrate-P、Enzyme-P和HCl-P),探讨碳、磷添加对4种生物有效性的磷组分的影响和土壤磷酸酶活性的响应特征。【结果】与CK相比,C、P添加和CP配施处理水稻地上部分生物量分别增加29.76%、84.03%和87.94%(<0.05),地下部分生物量分别减少20.13%、增加57.49%和56.53%(<0.05);植物全磷(TP)含量与生物量变化规律一致,C、P和CP添加处理地上部分TP含量比CK分别增加57.23%、95.21%和95.91%(<0.05),地下部分TP含量比CK分别减少26.12%,增加45.45%和38.01%(<0.05)。根际土pH、NH4+-N和Olsen-P的含量低于非根际土,CP配施处理中根际土微生物量磷(MBP)含量高于非根际土;碳、磷添加对4种基于生物有效性磷组分具有显著调控作用(<0.05);Olsen-P和MBP与ALP呈极显著负相关(<0.05),与ACP无显著相关性,表明微生物对速效养分利用明显。冗余分析表明非根际土壤中的酶活性变化主要受Olsen-P、MBP、CaCl2-P和Citrate-P含量影响;而土壤中含水量、pH、NH4+-N、根系生物量、HCl-P和Enzyme-P含量主要影响水稻根际土壤中的酶活性。【结论】P和CP配施处理能提高缺磷水稻土微生物活性,显著增加水稻生物量,提升根际微生物效应,改善土壤环境,有利于稻田生态系统的健康。
磷酸酶活性;根际;BBP法;磷循环;缺磷水稻土;生物量
0 引言
【研究意义】土壤酶主要来自微生物、土壤动物和植物根系分泌以及植物残体的分解[1],能在一定程度上反映土壤养分状况、物质周转和有机体生长代谢[2]。在土壤-植物系统的养分循环中,土壤酶活性与施肥密切相关[1]。碳是植物和微生物生长的能量元素,磷是植物细胞膜和核酸的重要组成元素,对细胞分裂和植物组织分化起关键作用,二者均为植物体生理代谢活动中不可缺少的元素。植物和微生物的生长代谢大多为酶促反应,土壤磷酸酶作为与磷相关的水解酶,其主要组分磷酸单酯酶能够作用于低分子量的磷酸酯键化合物,把磷酸单酯化合物中磷酸单酯键切断而使磷酸基游离,从而提高土壤磷的生物有效性[3]。根据磷酸酶来源,可将其划分为酸性磷酸酶(ACP)和碱性磷酸酶(ALP)[4]。ACP酶由植物和微生物共同产生,ALP酶仅由微生物产生[3-4]。通常在未施肥的土壤中,植物根系和微生物为了利用土壤中的磷元素,相应地增加对这2类磷酸酶的分泌,因而活性较高[5]。因此,研究外源养分添加对稻田土壤磷酸酶活性影响的特征,明确水稻根土磷酸酶活性对碳、磷添加的响应过程,对于指导稻田土壤施肥和管理,实现农业可持续发展具有重要意义。【前人研究进展】磷素对植物和微生物的生长具有复杂的影响,已有研究表明磷添加可以增加[6]或减少[7]植物生物量,亦能增加或减少磷酸酶的活性[3-4]。在植物-微生物-土壤系统中,微生物能够通过增加磷酸酶的分泌将磷从有机养分转化为无机养分,实现对土壤中磷的活化,为植物提供速效养分(Olsen-P)。植物能够对不同生物活性的磷进行利用,它和微生物互利共生,又相互竞争[5,8],因此,土壤中磷的存在形态直接决定其生物有效性[9]。Deluca等[10]根据生物学利用难易程度提出了基于磷素生物有效性的磷分级方法(biologically based phosphor,BBP),其原理是利用CaCl2,微生物分泌有机酸和ACP酶等磷提取剂区分不同生物活性的磷形态,具体分为4种组分:0.01 mol·L-1CaCl2提取的可溶性磷(CaCl2-P)(表征能被根系和微生物直接利用的磷);10 mmol·L-1柠檬酸提取的磷(Citrate-P)(表征能被有机酸活化的无机磷);0.2酶单位提取的磷(Enzyme-P)(表征易被微生物矿化有机磷);1 mol·L-1盐酸提取的无机磷(HCl-P)(表征能被植物分泌的质子活化磷)[11-12]。这4个磷组分均能在一定程度上反映磷的生物有效性,但关于各组分与磷酸酶的关系目前尚无报道。根际微环境是微生物-土壤-植物系统中最为活跃的区域,也是磷矿化的热区[5],植物根系通过分泌有机酸等物质释放植物和微生物生长必需元素,刺激微生物生长进而增加酶活性[13]。系列生化反应均为酶促反应,因此酶活性对土壤养分添加极为敏感[14]。植物根际酶活性一般大于非根际,这是由于根际受微生物和植物根系分泌物的影响程度显著高于非根际[15]。因此,根际土壤酶是植物根系和微生物对养分元素利用的驱动因子,对植物的健康产生直接的影响[16]。【本研究切入点】目前,大多数生态系统都受人类活动影响[17],特别是农业生态系统养分元素的大量输入[18]导致农田土壤中关键酶活性改变[19]。在稻田生态系统中,磷可利用性是水稻和土壤微生物生长的限制因子,但关于植物根际和非根际土中磷酸酶活性的研究报道较少。【拟解决的关键问题】本研究选取长期种植水稻的典型红壤,进行盆栽实验,添加纤维素(C)和磷肥(P),以纤维素(C)模拟秸秆还田,研究有无秸秆还田两种稻田管理措施下,磷元素可利用性对水稻根际和非根际根土2种磷酸酶(ACP和ALP)活性的影响,并基于BBP法区别4种磷组分,进一步区分各组分和2种磷酸酶的联系。分析水稻根际和非根际土2种磷酸酶(ACP和ALP)活性对养分添加(C、P和CP)和根际效应等因素的响应,探讨不同生物有效性磷与磷酸酶活性的关系,以期为稻田土壤磷肥的合理施用提供科学参考。
1 材料与方法
1.1 研究区域概况
供试土壤样品采自中国科学院桃源农田生态系统国家野外科学观测研究站(111°27′E,28°55′N),该地区属典型亚热带湿润气候,海拔92.2—125.3 m,年均气温16.5℃,年均降水量1 400 mm。水稻种植为一年两熟制,土壤母质为第四纪红黏土的水稻土(简育水耕人为土)。
1.2 土壤采集与预处理
2016年11月,在采样区域选择熟化程度基 本相近的典型低磷水稻土(Olsen-P:4.5 mg·kg-1;TP:0.8 g·kg-1),采集耕作层(0—20 cm)土壤,湿润条件(含水率为27.93%)下过4 mm筛去除植物残体,淹水2—3 cm,于25℃条件下预培养14 d后,倒掉上层水并将所有土样混合均匀,同时取200 g风干过筛(2 mm和0.149 mm)用于理化性质测定。
1.3 土壤养分添加和水稻种植
取上述处理好的土壤,依据农业部2014年水稻施肥技术指导(一般亚热带稻田按照100 g K·kg-1干土,40—80 g P·kg-1干土,120—150 g N·kg-1干土施肥,纤维素按有机碳的5%添加)和盆栽试验施肥量一般是大田实验室的1.5—3倍进行养分添加。试验先以416.21 kg·hm-2干土(KCl)和650.33 kg·hm-2干土(NH4NO3)作为基肥,混合均匀后用四分法分装。试验设置4个处理:(1)不添加碳磷(CK);(2)添加1 950.98 kg·hm-2干土纤维素(C);(3)加入208.1 kg·hm-2干土NaH2PO4(P);(4)添加1 950.98 kg·hm-2干土纤维素和208.1 kg·hm-2干土NaH2PO4(CP),混合均匀。
将处理好的土壤分装在根箱(20 cm×2 cm×32 cm)中,每盒1.2 kg干土,每个处理设9个重复,共36箱水稻。水稻品种为9311,水培育苗,当幼苗长至15 cm时移栽到预先准备好的试验根箱中,每箱移栽2株,1周左右留下长势较好的一株,之后保持淹水2—3 cm,于恒温气候室中进行培养(室内温度28℃;CO2浓度400μl·L-1;湿度50%;光照强度10 000 lx,周期12 h﹕12 h)。根箱倾斜60°,使根系贴壁(玻璃面)生长,方便根际土和非根际土采样,且根箱用铝箔纸包裹,避免玻璃面藻类繁殖。
1.4 指标测定及室内样品采集
1.4.1 土壤基本理化指标测定方法 采用Mettler- toledo320 pH计测定土壤pH(水土比为2.5﹕1);碳氮元素分析仪(VARIO MAX C/N,德国)测定土壤全氮(TN)、有机碳(SOC)的含量和C/N;氢氧化钠溶融法-紫外分光光度计(UV-2450,日本)测定土壤全磷(TP);NaHCO3溶液浸提-钼锑抗比色法[20]测定Olsen-P;激光粒度仪(Mastersizer 2000,英国)测定土壤机械组成。供试土壤基本理化性质见表1。
玉米和水稻均为禾本科作物,本文参考Ma等[21]和梁国鹏等[22]在旱地玉米中区分根际土和非根际土的方法,结合本试验水稻根系的生长环境,以及类似试验借助原位酶谱的结果[23],认为离根2—3 mm区域是受微生物影响的活性热区,并将其定义为根际土,其余为非根际土。水稻移栽后第45天,根系生长基本稳定,从每个处理中随机选取3箱,倾去上层水后打开根箱,采集离根2—3 mm区域为根际土,具体做法是用消毒的刀片和镊子根据根的生长区域画出根际大致区域,再尽可能小心地取出,避免和非根际区域交叉污染。之后从分离出的根际土和非根际土中各取土样约5 g,用于测定土壤中的ACP和ALP酶活性,以及4种不同生物活性磷组分,另取50 g风干过筛(2 mm),用于基本理化指标测定。
1.4.2 植物样生理指标测定方法 采集植物鲜样后,立即放入105℃烘箱(Binder-FD115,德国)杀青,2 h后于65℃烘干称得重量为其生物量。植物样全磷(TP)含量采用浓H2SO4-H2O2消煮-钼锑抗比色法,紫外分光光度计(UV-2450,日本)测定[24]。
1.4.3 根际土和非根际土相关生理指标测定方法 土壤NH4+-N采用0.5 mol·L-1K2SO4溶液浸提[25-26],流动注射分析仪(AA3,德国)测定。土壤微生物量磷(MBP,mg·kg-1)含量采用氯仿熏蒸-NaHCO3溶液浸提-钼锑抗比色法[20],紫外分光光度计(UV-2450,日本)测定,同时以未熏蒸土样作为速效磷(Olsen-P)。土壤胞外酶活性采用96微孔荧光分析法[19,27],通过多功能酶标仪(Infinite M20,PRO,瑞士)于激发波长365 nm、发射波长450 nm条件下测定,结果用米氏方程拟合得到土壤最大潜在活性(V)和土壤酶亲和力(K),计算得到催化效率(K)[27]。基于生物活性的磷分级采用BBP法[10],为避免该有机磷组分受无机磷影响,采用纯水代替醋酸钠缓冲溶液。同时采用纯水提取无机磷,利用差减法扣除纯水提取的无机磷[12]。
1.5 数据处理与分析
采用SPSS 16.0 进行数据处理和统计分析,运用单因素方差分析法(One-way ANOVA)进行检验,采用Duncan多重比较分析组间差异,Canoco 5.0 软件进行冗余分析(RDA)。Origin 8.5 软件作图,图表中数据均为平均值±标准差。
2 结果
2.1 碳、磷添加对水稻生物量、磷含量和土壤理化性质的影响
碳和磷作为植物生长的必需养分元素,显著增加了植物地上部生物量。C、P和CP配施处理地上部生物量比CK处理分别显著增加29.76%、84.03%和87.94%(<0.05)(图1-a);C处理地下部分生物量显著减少20.13%,P和CP处理分别显著增加57.49%和56.53%(<0.05)(图1-b)。植物全磷(TP)含量与生物量变化规律一致,C、P和CP添加处理地上部分含量比CK分别显著增加57.23%、95.21%和95.91%(<0.05)(图1-c);C处理地下部含量显著减少26.12%,P和CP处理分别显著增加45.45%和38.01%(<0.05)(图1-d)。水稻移栽45 d后,各处理水稻根际土pH、NH4+-N和Olsen-P含量以及MBP含量(除CP配施处理)均显著低于非根际土(<0.05)(图2)。

Stem:水稻地上部分;Root:水稻地下部分。不同小写字母表示不同处理差异显著(P<0.05)。下同

RS:根际土;BS:非根际土 RS: Rhizosphere soil; BS: Bulk soil
2.2 碳、磷添加对土壤磷组分的影响
碳和磷添加对水稻根际和非根际土4个磷组分(HCl-P、Enzyme-P、CaCl2-P、Citrate-P)含量具有显著的调控作用(图3)。C添加处理能显著增加水稻根际和非根际土CaCl2-P的含量(<0.05),且根际土含量小于非根际土。P添加和CP配施处理显著增加水稻根际和非根际土HCl-P和Citrate-P的含量(<0.05),显著减少水稻根际和非根际土的Enzyme-P含量(<0.05),且根际土含量大于非根际土。
2.3 根际和非根际土壤酶活性对碳和磷添加的响应
动力学结果显示,在CK、C和P添加处理中ACP和ALP酶活性(V)表现为根际大于非根际,而CP配施处理酶活性表现为根际小于非根际(表2,图4),其中C、P和CP配施处理显著降低了根际ALP酶活性(<0.05)。不同处理水稻土中ACP和ALP酶的催化效率(K)有不同程度的响应,根际和非根际土催化效率与土壤最大潜在酶活性的大小规律一致,且各处理间差异显著(<0.05)。
2.4 土壤理化因子对土壤酶活性的影响
对水稻移栽后第45天根际土酶活和土壤理化性质进行Pearson相关分析(表3),结果表明ALP与含水量、pH和NH4+-N呈显著正相关(<0.05),与Olsen-P和MBP极显著负相关(<0.01),而ACP与土壤理化性质相关性都不显著。方差分解发现根际效应对水稻生长过程中磷酸酶活性有重要作用(图5)。对影响水稻根际和非根际土壤磷酸酶活性的主要因子和基于BBP法的磷组分分别做冗余分析(RDA)(图6),发现非根际土壤中的酶活性变化主要受Olsen-P和MBP以及CaCl2-P和Citrate-P含量影响;而土壤中pH、NH4+-N和根系生物量(RB)以及HCl-P和Enzyme-P含量主要影响水稻根际土壤中的酶活性。
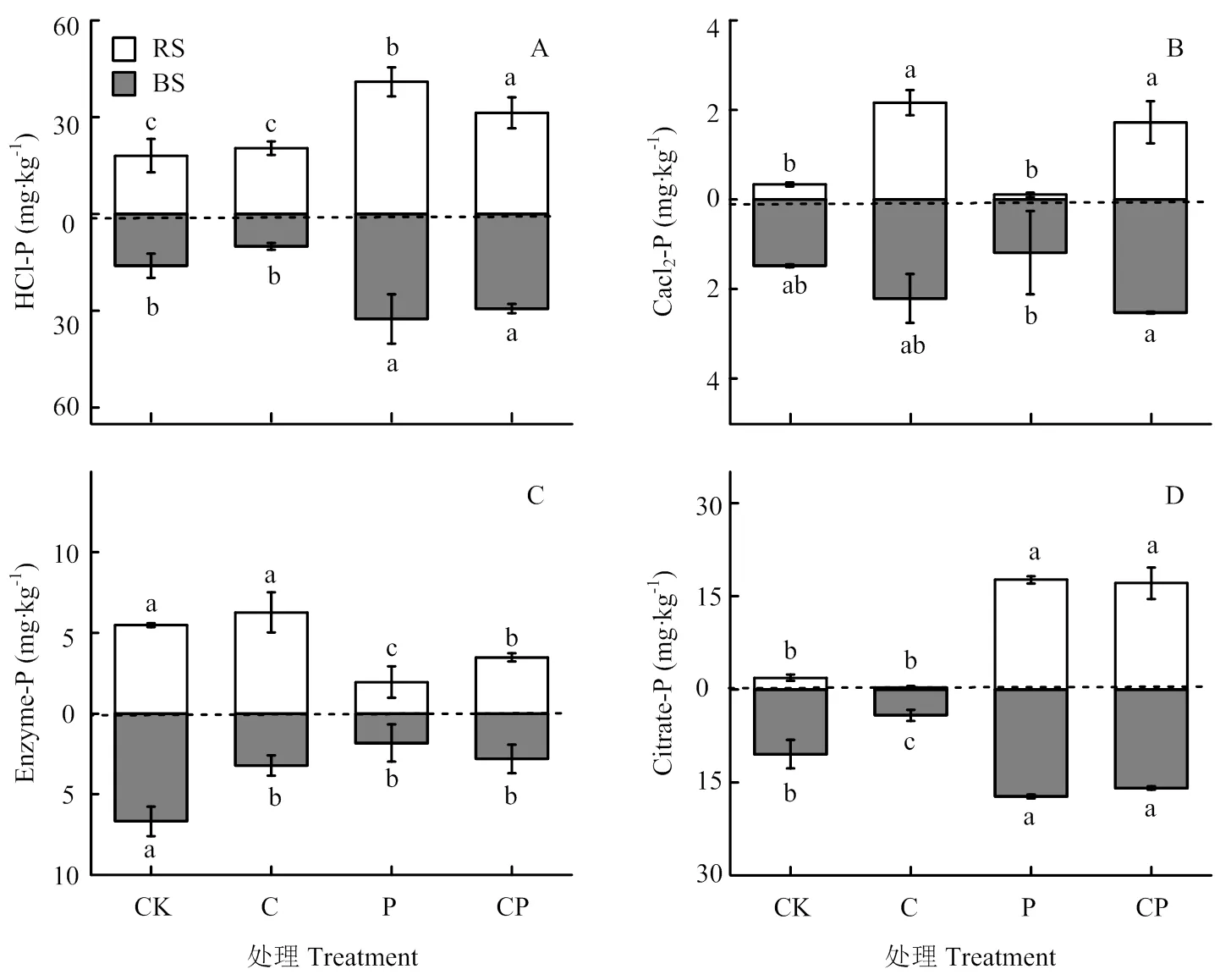
图3 水稻移栽45 d后不同处理基于生物有效性的水稻根际和非根际土壤磷素组分含量
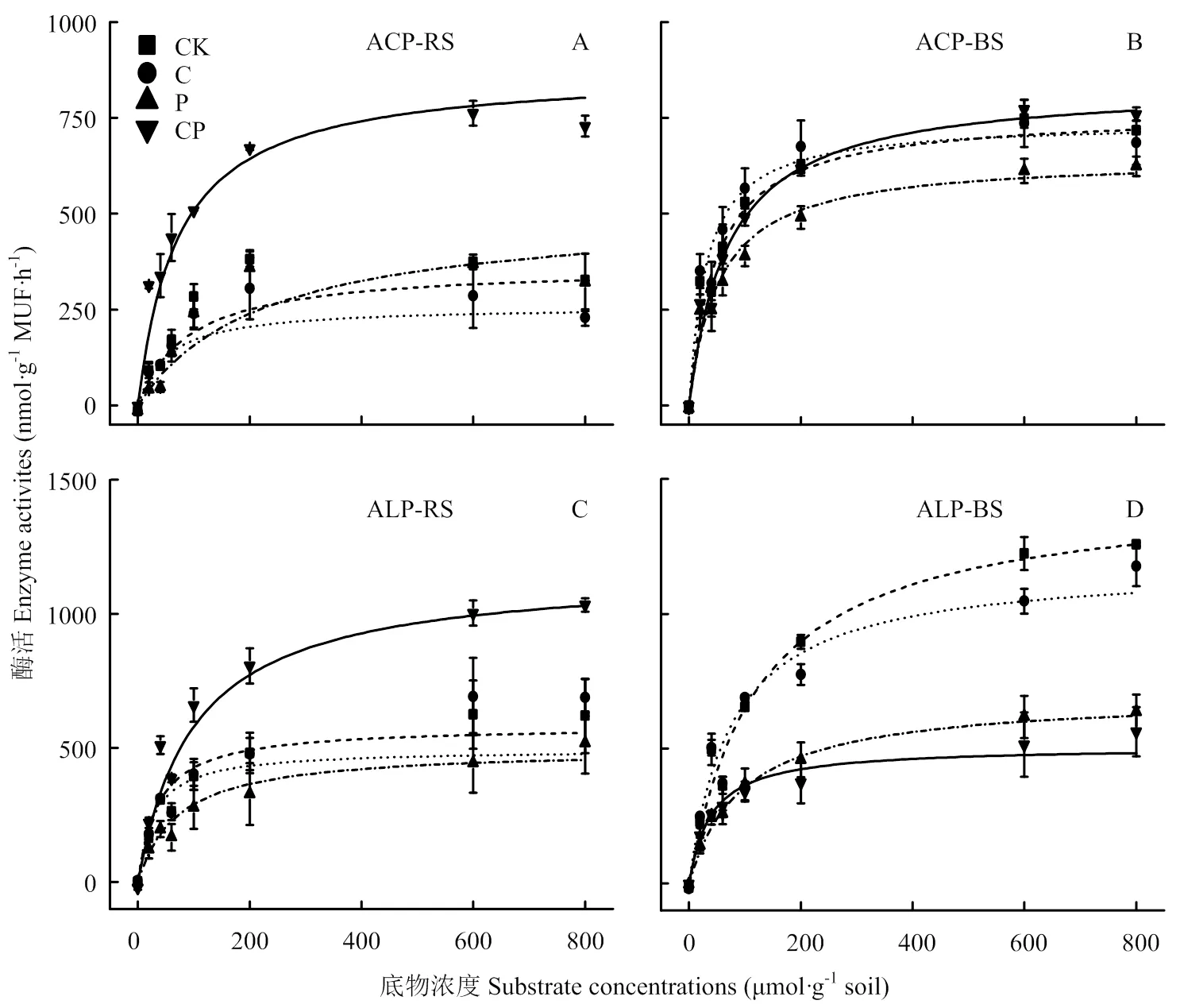
图4 水稻移栽45 d后不同处理水稻根际与非根际土壤胞外磷酸酶活性动力学曲线
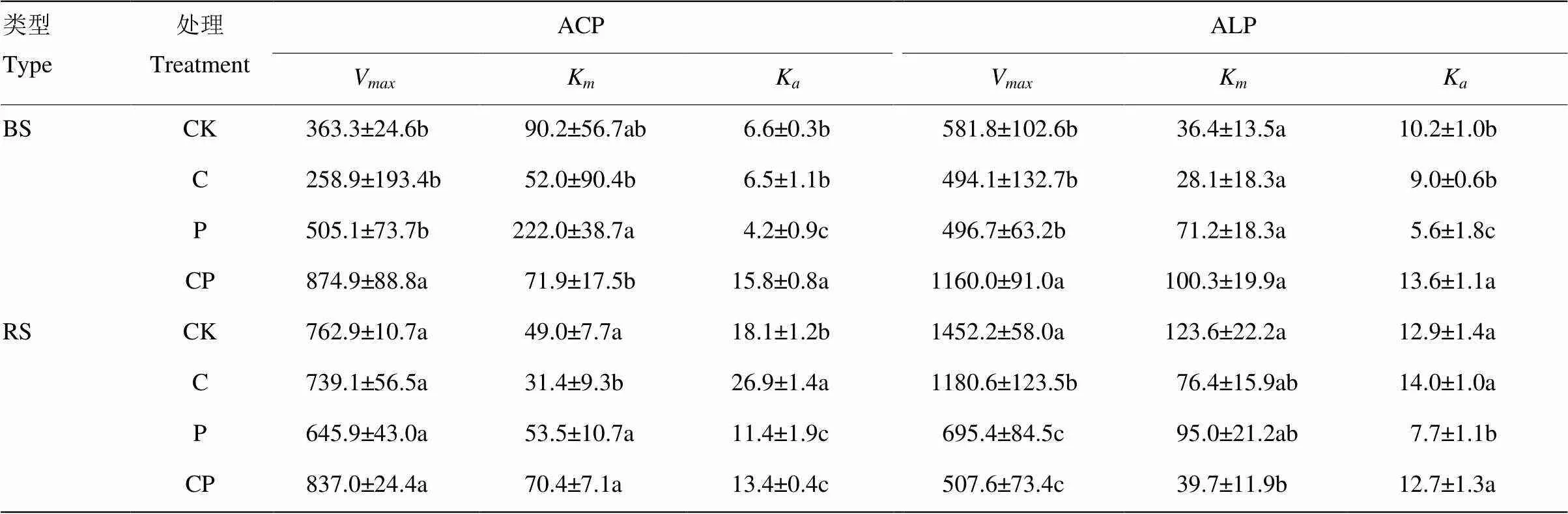
表2 水稻移栽45 d后不同处理根际和非根际土壤酶活动力学参数

表3 水稻移栽45天后根际土壤酶活和土壤基本理化指标的Pearson相关分析
*显著(<0.05);**极显著(<0.01)
*Significant(<0.05);** Extremely significant(<0.01)

图5 二组解释变量(根际因素和施肥)对土壤磷酸酶活性(ACP和ALP)变化贡献的韦恩分布图
3 讨论
3.1 碳、磷添加及根际因素对水稻土壤酶活性的影响
在水稻-土壤系统中,碳和磷是植物和微生物生长的必要元素。水稻和微生物相互竞争磷,同时微生物能够通过分泌磷相关酶释放土壤中固持的非生物有效性磷,从而满足微生物C﹕P化学计量比的需求[28-29],并对土壤中的磷进行反调控。本研究中C、P添加处理使根际土ACP酶活性大于非根际土(图4),这与Spohn等[30]研究相一致。因为ACP酶通过植物根系分泌产生,主要分布于根系附近[3]。在缺磷土壤中,解磷微生物需将有机养分转化为共植物吸收利用的无机养分,故磷添加减少非根际土ACP酶活性,在植物根系和微生物共同作用下,磷的添加促使根表大量微生物繁殖提高酶活性。Hofmann等[4]发现施磷会减少根际ACP酶的活性,缺磷土壤中微生物相对更容易产生磷酸酶(ACP和ALP)。但P添加和CP配施处理显著促进了缺磷土壤中水稻的生长(图1),对土壤酶活性产生间接影响。一方面,随着植物生物量的增加,植物根系分泌物和周围微生物活性显著增加,从而增强ACP酶活性[3];另一方面,外源添加的磷能促进根系有机酸的分泌,微酸性土壤环境有利于含磷有机化合物及矿物释放生物有效性磷。

RB:水稻根系生物量;M:含水率
磷酸酶的活性不仅与磷元素有关,还与碳元素密切相关[4,30]。玉米和水稻均为禾本科植物,但二者生长环境不同(水分条件和Eh等),前者以菌根真菌作为固氮菌分泌相关胞外酶[22],后者利用解磷细菌分泌大量磷酸酶转化的无机养分供其生长[31-32],且水稻土部分有机磷矿化可通过微生物对碳的需求来驱动[29-30]。外源碳和磷的添加,能够满足植物生长和微生物的需求,从而使根际磷酸酶活性降低。相对于单一养分添加,CP配施处理更能改善土壤原有养分状况及植物生长的营养条件,从而促进植物根系生长,加速根系分泌物向土壤中的输入,提高ACP酶的活性[4,22,33]。本研究Pearson相关分析(表3)显示,Olsen-P和MBP与ACP无显著性相关,表明ACP活性受微生物的影响较小。然而Olsen-P和MBP与ALP呈极显著负相关(<0.01),这可能是由于土壤磷酸酶不仅具有活化无机磷的功能,而且能将有机化合物脱磷酸化作为碳源[28,34-35]。
根际微环境作为土壤微生物活性区域,酶活性对土壤环境变化的响应明显[36-37]。Hydrolytic[15]认为根际效益导致根际土壤酶活性大于非根际,植物根系周围常分布大量微生物,有利于根际土ALP酶活性的增加[4,30]。这与本研究结果一致,P添加处理较小程度地减少根际ALP酶的活性,而大幅度减少非根际土ALP酶活性,这种差异可能是由于酶活性受根际效应的影响,在碳可利用性低的非根际土中,磷酸酶的活性更高[29]。在根际区域植物根系分泌物可被微生物利用,相比非根际土则有更少的碳限制,可能在CP配施处理中减小根际土磷酸酶的活性。另外,在磷受限制的土壤中,微生物对低磷环境具有长期适应效应,外源磷的添加使微生物胞外酶从磷限制转换为受碳限制,可能导致与磷相关的ALP酶活性降低。相对于CK处理,C和P处理非根际土壤ACP和ALP的酶催化效率(K)小于根际土壤,CP配施处理非根际土的K大于根际土壤,这说明养分添加能促使根系分泌物从根际扩散到非根际区域,增加土壤磷酸酶的活性[30];同时土壤酶受各种生物和非生物因素共同影响,适当碳输入对土壤磷具有活化作用,使根际土壤区域有效态磷含量较高,减少微生物对磷酸酶的分泌[38],因此CP配施处理的磷酸酶活相对较低。Pearson相关分析(表3)发现,根际土壤ACP与MBP和土壤理化性质无显著相关,说明根际土壤ACP活性可能与水稻自身生长状况有关[37];根际土壤ALP与MBP极显著负相关(<0.01),这说明根际土壤ALP酶与微生物活性有较密切关系[3-4]。根际土ALP与Olsen-P呈极显著负相关(<0.01),并且根际土壤Olsen-P含量低于非根际土壤,说明水稻植株与微生物竞争养分,减少了可利用态磷在根际区域的含量[13];与NH4+-N呈极显著正相关(<0.01),且根际土壤NH4+-N含量低于非根际土壤,表明充足的可利用氮素可能是ALP合成的必要条件。
3.2 生物有效性土壤磷素对酶活的影响
土壤有效磷主要指土壤中全部水溶性磷、部分吸附态磷、有机磷和某些沉淀态磷[12]。本研究中,Olsen-P与MBP显著正相关(<0.05)(图2,表3),表明水稻生长期根系分泌物多,微生物生长繁殖强,水稻与微生物相互竞争,促使微生物分泌更多的胞外酶,水解土壤有机质为水稻和微生物提供更多的养分和能量[32,37]。Hinsinger等[39]发现植物和微生物在矿化磷的过程中,会释放质子和有机配体(如草酸盐和柠檬酸盐),同时产生胞外酶分解有机磷[40]。碳、磷添加一方面会造成水稻的根系沉积物增加,植物能够直接吸收利用CaCl2-P,同时与微生物竞争;根系微生物通过促进ALP酶产生将Citrate-P活化为无机磷。另一方面根系分泌物扩散到非根际区域,能显著提高土壤中HCl-P的微生物活性,微生物增加对酸性磷酸酶的分泌将Enzyme-P矿化为无机磷,进而增加非根际土的酶活性[10-12]。
水稻在淹水微厌氧条件下生长,土壤微生物分泌更多的有机阴离子,在磷酸根离子的专性吸附位点进行吸附竞争,通过配位交换提高有效磷含量[41],并且根际土壤中的微生物能强烈的矿化有机磷和溶解无机磷[31,34]。微生物还可以将磷固定在生物量中,通过根将有机磷矿化降解或者通过氨化期间的质子消耗降低pH,使植物对磷的可利用性降低,进而影响酶活[42-43]。本研究所用材料为亚热带地区风化度较高的红壤,大量无机磷以吸附、沉淀态固定在土壤颗粒中。施磷条件下,土壤中有机酸交换态(HCl-P和Citrate-P含量)显著升高(图3-a和图3-d)。随着水稻的生长和根系生物量的增加,水稻根系有机酸分泌量增大,有利HCl-P于和Citrate-P溶出,使土壤可利用性磷显著提高,在需求不变的情况下减缓微生物对磷的释放,导致ACP酶活性降低。但此过程中磷酸酶活性仍然相对较高,不需要通过水解作用矿化出有机磷,从而使Enzyme-P含量显著降低(图3-c)。本研究只是初步做了基于磷素生物有效性的4组分与酶活关系的研究,有待结合其他分子生物学技术做更深入的研究。
4 结论
碳和磷添加显著增加了水稻生物量,纤维素对磷具有显著的活化作用,速效养分对根际2种磷酸酶活(ACP和ALP)有显著影响,根际微生物效应显著。
非根际土壤中的磷酸酶活性变化主要受Olsen-P和MBP以及CaCl2-P和Citrate-P含量影响;而土壤含水率、pH、NH4+-N和根系生物量以及HCl-P和Enzyme-P含量主要影响水稻根际土壤磷酸酶活性。
致谢:感谢中国科学院亚热带农业生态研究所提供的科研平台和江西师范大学研究生国内访学项目的资助。
[1] 孟立君, 吴凤芝. 土壤酶研究进展. 东北农业大学学报, 2004, 35(5): 622-626.
MENG L J, WU F Z. Advances on soil enzymes., 2004, 35(5): 622-626. (in Chinese)
[2] 王理德, 王方琳, 郭春秀, 韩福贵, 魏林源, 李发明. 土壤酶学研究进展. 土壤, 2016, 48(1): 12-21.
WANG L D, WANG F L, GUO C X, HAN F G, WEI L Y, LI F M. Review: Progress of soil enzymology., 2016, 48(1): 12-21. (in Chinese)
[3] Nannipieri P, Giagnoni L, Landi L, Renella G. Role of phosphatase enzymes in soil//Bünemann E, Oberson A, Frossard E.. Berlin: Springer, 2011: 26.
[4] Hofmann K, Heuck C, Spohn M. Phosphorus resorption by young beech trees and soil phosphatase activity as dependent on phosphorus availability., 2016, 181(2): 369-379.
[5] Spohn M, Carminati A, Kuzyakov Y. Soil zymography-a novel in situ method for mapping distribution of enzyme activity in soil., 2013, 58(2): 275-280.
[6] 赵钢, 苏幸枝, 石秀兰, 张雅君. 施肥条件下柱花草生长早期构件生长规律的研究. 中国草地学报, 2012, 34(6): 32-35.
ZHAO G, SU X Z, SHI X L, ZHANG Y J. Effects of fertilization on growth law of module ofat early stage., 2012, 34(6): 32-35. (in Chinese)
[7] 张仁, 徐当会, 杨智永, 杨莹博, 王刚. 植物N﹕P化学计量特征对亚高寒草甸限制类型的指示作用研究. 中国草地学报, 2014, 36(3): 79-83.
ZHANG R, XU D H, YANG Z Y, YANG Y B, WANG G. The indicative function of N:P stoichiometry characteristics on the nutrient limitation on the sub-alpine grassland., 2014, 36(3): 79-83. (in Chinese)
[8] Heuck C, Weig A, Spohn M. Soil microbial biomass C:N:P stoichiometry and microbial use of organic phosphorus., 2015, 85: 119-129.
[9] 雷宏军, 刘鑫, 朱端卫. 酸性土壤磷分级新方法建立与生物学评价. 土壤学报, 2007, 44(5): 860-866.
LEI H J, LIU X, ZHU D W. Development of a new phosphorus fractionation scheme in acid soils and biological evaluation., 2007, 44 (5): 860-866. (in Chinese)
[10] Deluca T H, Glanville H C, Harris M, Emmett B A, Pingree M R A, Sosa L L D. A novel biologically-based approach to evaluating soil phosphorus availability across complex landscapes., 2015, 88: 110-119.
[11] Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in anforest soil., 2002, 34(9): 1309-1315.
[12] 蔡观, 胡亚军, 王婷婷, 袁红朝, 王久荣, 李巧云, 葛体达,吴金水. 基于生物有效性的农田土壤磷素组分特征及其影响因素分析. 环境科学, 2017, 38(4): 1606-1612.
CAI G, HU Y J, WANG T T, YUAN H Z, WANG J R, LI Q Y, GE T D, WU J S. Characteristic and influence of biologically-based phosphorus fractions in the farmland soil., 2017, 38(4): 1606-1612. (in Chinese)
[13] Kuzyakov Y, Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept & review., 2015, 83: 184-199.
[14] 张艺, 王春梅, 许可, 杨欣桐. 模拟氮沉降对温带森林土壤酶活性的影响. 生态学报, 2017, 37(6): 1956-1965.
ZHANG Y, WANG C M, XU K, YANG X T. Effect of simulated nitrogen deposition soil enzyme activities in a temperate forest., 2017, 37(6): 1956-1965. (in Chinese)
[15] Hydrolytic L. Enzymes of importance to rhizosphere processes., 2015, 15(2): 283-306.
[16] Gunina A, Kuzyakov Y. Sugars in soil and sweets for microorganisms: review of origin, content, composition and fate., 2015, 90: 87-100.
[17] Canseld D E, Glazer A N, Falkowski P G. The evolution and future of Earth’s nitrogen cycle., 2010, 330(6001): 192-196.
[18] Zang H D, Wang J Y, Kuzyakov Y. N fertilization decreases soil organic matter decomposition in the rhizosphere., 2016, 108: 47-53.
[19] 何建州, 杨金燕, 田丽燕, 李廷强. 用紫外-荧光微孔板酶检测技术测定两种土壤的酶活性. 四川农业大学学报, 2012, 30(2): 181-185.
HE J Z, YANG J Y, TIAN L Y, LI T Q. Soil enzyme assay using ultraviolet and fluorescence microplate., 2012, 30(2): 181-185. (in Chinese)
[20] Wu J S, Huang M, Xiao H A, SU Y R, TONG C L, HUANG D Y, SYERS J K. Dynamics in microbial immobilization and transformations of phosphorus in highly weathered subtropical soil following organic amendments., 2007, 290(1/2): 333-342.
[21] Ma X M, Razavi B S, Holz M, Blagodatskaya E, Kuzyakov Y. Warming increases hotspot areas of enzyme activity and shortens the duration of hot moments in the root-detritusphere., 2017,107: 226-233.
[22] 梁国鹏, Albrt H A, 吴会军, 武雪萍, 蔡典雄, 高丽丽, 李景, 王碧胜, 李生平. 施氮量对夏季玉米根际和非根际土壤酶活性及氮含量的影响. 应用生态学报, 2016, 27(6): 1917-1924.
LIANG G P, Albrt H A, WU H J, WU X P, CAI D X, GAO L L, LI J, WANG B S, LI S P. Soil nitrogen content and enzyme activities in rhizosphere and non-rhizosphere of summer maize under different nitrogen application rates., 2016, 27(6): 1917-1924. (in Chinese).
[23] Razavi B S, Hoang D, Blagodatskaya E, Kuzyakov Y. Mapping the footprint of nematodes in the rhizosphere: Cluster root formation and spatial distribution of enzyme activities., 2017, 115: 213-220.
[24] 鲍士旦. 土壤农化分析.3版. 北京: 中国农业出版社, 2000: 268-270.
Bao S D... Beijing: China Agricultural Press, 2000: 268-270.(in Chinese)
[25] Wu J S, Joergensen R G, Pommering B, Chaussod R, Brookes P C. Measurement of soil microbial biomass C by fumigation extraction an automated procedure., 1990, 22(8): 1167-1169.
[26] Jenkinson D S. Determination of microbial biomass carbon and nitrogen in soil//Wilson J R.. Wallingford: CAB International, 1988: 368-385.
[27] Tischer A, Blagodatskaya E, Hamer U. Microbial community structure and resource availability drive the catalytic efficiency of soil enzymes under land-use change conditions., 2015, 89: 226-237.
[28] Kumar A, Kuzyakov Y, Pausch J. Maize rhizosphere priming field estimates using13C natural abundance., 2016, 49(1/2): 87-97.
[29] 吴金水, 葛体达, 祝贞科. 稻田土壤碳循环关键微生物过程的计量学调控机制探讨. 地球科学进展, 2015, 30(9): 1006-1017.
WU J S, GE T D, ZHU Z K. Discussion on the key microbial process of carbon cycle and stoichiometric regulation mechanisms in paddy soils., 2015, 30(9): 1006-1017. (in Chinese)
[30] Spohn M, Treichel N S, Cormann M, Schloter M, Fischer D. Distribution of phosphatase activity and various bacterial phyla in the rhizosphere ofLdepending on P availability., 2015, 89: 44-51.
[31] Chen Y P, Rekha P D, Arun A B, SHEN F T, LAI W A, YOUNG C C. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities., 2006, 34(1): 33-41.
[32] 关松荫. 土壤酶与土壤肥力. 土壤通报, 1980, 1(6): 41-44.
GUAN S Y. Soil enzyme and soil fertility., 1980, 1(6): 41-44. (in Chinese)
[33] Spohn M, Ermak A, Kuzyakov Y. Microbial gross organic phosphorus mineralization can be stimulated by root exudates–A33P isotopic dilution study., 2013, 65(3): 254-263.
[34] Steenbergh A K, Bodelier P L E, Hoogveld H L, Slomp C P, Laanbroek H J. Phosphatases relieve carbon limitation of microbial activity in Baltic Sea sediments along a redox-gradient., 2011, 56(6): 2018-2026.
[35] Nardi S, Concheri G, Pizzeghello D, STURARO A, RELLA R, PARVOLI G. Soil organic matter mobilization by root exudates., 2000, 41(5): 653-658.
[36] 魏亮, 汤珍珠, 祝贞科, 蔡观, 葛体达, 王久荣, 吴金水. 水稻不同生育期根际与非根际土壤胞外酶对施氮的响应. 环境科学, 2017, 38(8): 3489-3496.
WEI L, TANG Z Z, ZHU Z K, CAI G, GE T D, WANG J R, WU J S. Responses of extracellular enzyme to nitrogen application in rice of various ages with rhizosphere and bulk soil., 2017, 38(8): 3489-3496. (in Chinese)
[37] Zhang L, Ding X, Chen S, He X, Zhang F, Feng G. Reducing carbon: Phosphorus ratio can enhance microbial phytin mineralization and lessen competition with maize for phosphorus., 2014, 9(1): 850-856.
[38] Zhu B, Gutkenecht J L M, Herman D J, KECK D C, FIRESTONE M K, CHENG W. Rhizosphere priming effects on soil carbon and nitrogen mineralization., 2014, 76(1): 183-192.
[39] Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: A review., 2001, 237(2): 173-195.
[40] Spohn M, Kuzyakov Y. Distribution of microbial- and root- derived phosphatase activities in the rhizosphere depending on P availability and C allocation-Coupling soil zymography with14C imaging., 2013, 67(3): 106-113.
[41] Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in anforest soil., 2002, 34(9): 1309-1315.
[42] Richardson A, Barea J M, McNeill A,Prigent- Combaret C. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms., 2009, 321(2): 305-339.
[43] Marschner P, Crowley D, Rengel Z. Rhizosphere interactions between microorganisms and plants govern iron and phosphorus acquisition along the root axis-model and research methods., 2011, 43(5): 883-894.
(责任编辑 杨鑫浩)
Responses of Extracellular Enzymes to Carbon and Phosphorus Additions in Rice Rhizosphere and Bulk Soil
LIU YuHuai1,2, WEI XiaoMeng2, WEI Liang2, ZHU ZhenKe2, GE TiDa2, ZHANG YanJie1, LU ShunBao1, WU JinShui2
(1College of Life Sciences, Jiangxi Normal University, Nanchang 330022;2Institute of Subtropical Agriculture, Chinese Academy of Sciences/Key Laboratory of Subtropical Agriculture Ecology, Changsha 410125)
【Objective】the objective of this experiment was to study the effects of exogenous nutrient input on soil microbial activity and phosphatase activity which was closely related to the phosphorus cycle in paddy soil, so as to clarify the responses of the phosphorus activity to carbon and phosphorus additions in rice rhizosphere and bulk soils. It is of great significance to guide the fertilization and management of rice soil and to realize the sustainable utilization of farmland. 【Method】The typical phosphorus- limited rice soil in Hunan was selected for pot experiment. The treatments included: no carbon and phosphorus additions (CK), carbon addition (C), phosphorus addition (P), and carbon and phosphorus additions (CP). Acid phosphatases (ACP) and alkaline phosphatases (ALP) of the rhizosphere and bulk soils were determined by 96-microtiter plateau method. 4 soil phosphorus (CaCl2-P, Citrate-P, Enzyme-P and HCl-P) were measured by biologically based phosphor (BBP) method to investigate the response of carbon and phosphorus addition and 4 soil phosphorus components based on the biological availability to soil enzyme activity.【Result】Compared with CK, the above-ground biomass of C, P and CP significantly increased by 29.76%, 84.03% and 87.94%, respectively (<0.05), and the underground biomass significantly decreased by 20.13% and increased by 57.49% and 56.53%, respectively (<0.05), which was consistent with the content of plant total phosphor (<0.05). The results showed that pH, the contents of NH4+-N and Olsen-P in rhizosphere soil were significantly lower than those in bulk soil (<0.05). The content of microbial biomass phosphorus (MBP) in rhizosphere soil (except CP treatment) was significantly lower than that in bulk soil (<0.05). Carbon and phosphorus additions had a significant regulatory effect on 4 soil phosphoruscomponents based on the biological availability in paddy rhizosphere and bulk soils (<0.05). Olsen-P and MBP had a significant negative correlation with ALP (<0.05), but no significant correlation with ACP, indicating it was obvious for microbes to utilize available nutrients. Phosphatase activity in bulk soil was mainly affected by Olsen-P and MBP, as well as CaCl2-P and Citrate-P content, while soil water content, pH, NH4+-N and root biomass, as well as HCl-P and Enzyme-P contentsosphatase activity in rhizosphere soil. 【Conclusion】The application of P and CP addition could improve the microbial activity of phosphorus-limited rice soil, increase the biomass significantly, and improve the rhizosphere microbes benefit and amendment the soil environment as well as benefit the health of paddy field ecosystem.
phosphatases activity; rhizosphere soil; BBP method; phosphorus cycle; phosphorus-limited rice soil; biomass
10.3864/j.issn.0578-1752.2018.09.004
2017-09-01;
2018-03-06
国家自然科学基金(31560168,31760136)、江西省自然科学基金(20161BAB204175)、江西省教育厅基金(GJJ160312)
刘玉槐,E-mail:liuyh2018@yeah.net。
鲁顺保,E-mail:luxunbao8012@126.com
