芥蓝BC3代Ogura CMS育性恢复材料的创制及Rfo基因传递和背景分析
2018-05-14于海龙李志远杨丽梅刘玉梅庄木吕红豪李占省方智远张扬勇
于海龙,李志远,杨丽梅,刘玉梅,庄木,吕红豪,李占省,方智远,张扬勇
芥蓝BC3代Ogura CMS育性恢复材料的创制及基因传递和背景分析
于海龙1,2,李志远2,杨丽梅2,刘玉梅2,庄木2,吕红豪2,李占省2,方智远1,2,张扬勇2
(1西北农林科技大学园艺学院,陕西杨凌 712100;2中国农业科学院蔬菜花卉研究所,北京 100081)
【目的】创制Ogura细胞质不育(Ogura CMS)的恢复系是利用Ogura CMS种质资源的有效途径。本研究基于已获得的BC2代育性恢复单株15Q23,继续用芥蓝进行回交,通过分析育性恢复基因的传递效率,及BC3代阳性株的遗传背景、育性表现、结实性和倍性,从而加速甘蓝类蔬菜Ogura CMS恢复材料的创制,获得甘蓝类蔬菜Ogura CMS恢复系。【方法】以BC2代育性较好的单株15Q23为父本,Ogura CMS芥蓝15Y102为母本进一步回交,利用特异分子标记对所有回交后代进行筛选,计算BC3代传递效率,并调查BC3代阳性单株的形态特征、育性恢复情况、结实性、倍性;选取遗传背景近于芥蓝、结实较好的重点单株继续回交获得BC4代,分析BC4代传递效率和阳性单株倍性。【结果】在开花的不同时期,单株15Q23花粉活力差异明显,以不同时期的花粉进行回交的结实性也存在极显著差异(<0.01),平均结实率为0.07粒/授粉花蕾(7%)。利用特异标记对获得的BC3代单株进行苗期筛选,结果表明,可稳定传递,遗传背景分析结果表明,BC3代单株与芥蓝15Y102遗传相似系数在0.81—0.92,遗传背景比BC2代单株15Q23(0.73)更近于芥蓝,形态标记聚类结果与遗传背景标记聚类结果一致。形态观察发现,BC3单株形态特征都近于芥蓝,但生长势较亲本芥蓝更强;倍性鉴定结果表明,多数BC3后代接近于四倍体。开花后观察34个BC3后代单株的育性,有标记的单株育性均得到恢复。但不同单株间花粉活力存在差异,单株16Q1-4、16Q1-7、16Q1-10在整个花期花粉活力一直在75%以上。利用亲本芥蓝对花粉活力较好的阳性单株(花粉活力>50%)进行回交,以单株16Q1-4和单株16Q1-10当父本时结实性最好,结实率分别为15%和9%,显著高于BC2代阳性单株15Q23(7%,<0.05)。BC4代单株中可以稳定传递,传递效率接近33%;对以16Q1-4为父本回交获得的24株阳性株进行倍性检测,不同单株间倍性差异较大,其中3株的荧光峰值和亲本芥蓝相近,倍性近于芥蓝。【结论】利用芥蓝对种间杂交六倍体阳性株进行第3、第4代回交,可稳定传递,成功获得了遗传背景、形态特征近于亲本芥蓝,结实性较BC2代单株15Q23显著提升的BC3代Ogura CMS育性恢复材料16Q1-4和16Q1-10。
芥蓝;育性恢复;传递效率;遗传背景
0 引言
【研究意义】针对甘蓝类蔬菜()中缺乏Ogura细胞质雄性不育(Ogura cytoplasmic male sterility,Ogura CMS)育性恢复材料的问题,利用远缘杂交结合胚挽救将育性恢复基因(restorer- of-fertility gene)从甘蓝型油菜导入芥蓝中[1]。对加倍后的种间杂种进行回交,已分别获得BC1和BC2代育性恢复材料[2]。但这些材料遗传背景还与芥蓝有较大差异,仍需进一步回交,保留的同时尽可能消除甘蓝型油菜的遗传背景,这对最终实现Ogura CMS甘蓝类蔬菜的育性恢复、打破国外公司利用Ogura CMS对特异种质的垄断具有重要意义。【前人研究进展】甘蓝类蔬菜是芸薹属中典型的异花授粉植物,杂种优势十分明显,利用雄性不育系进行杂交种生产是甘蓝类蔬菜杂种优势利用的主要途径之一[3]。Ogura细胞质雄性不育系由于其不育性稳定,转育容易,已成为甘蓝类蔬菜可实用的主要不育源[4]。早在20世纪70年代,Bannerot等[5]利用远缘杂交将萝卜中的Ogura胞质不育转到甘蓝类蔬菜中,并经过原生质体融合将其改良后[6],Ogura CMS已逐渐成为甘蓝类蔬菜杂交制种中广泛应用的细胞质不育类型[7]。但随着Ogura CMS的推广利用,近几年来越来越多的优异品种是胞质不育育成,不能自交分离,无法继续进行材料的创新利用[8-10]。而创制Ogura CMS的恢复系是解决这一问题的有效途径,但在甘蓝中不存在天然的Ogura CMS恢复材料。甘蓝型油菜Ogura CMS恢复系的研究历经30余年[11-12],已将从萝卜属中导入到甘蓝型油菜,并整合到了甘蓝型油菜的C09染色体上[13-14],成功创制出恢复系并应用于甘蓝型油菜Ogura CMS制种,Ogu-CMS/育种体系开始成为甘蓝型油菜杂交种生产的主要技术之一,这为研究者将甘蓝型油菜中向甘蓝类蔬菜转移提供了可能。为缩短转育年限,Yu等[1-2]选择甘蓝类蔬菜中容易春化、繁殖周期短的变种芥蓝作为转育材料,利用远缘杂交结合胚挽救技术,将导入Ogura CMS芥蓝中,并对加倍的F1代(种间六倍体杂种)多代回交,结合形态、育性、遗传背景分析,筛选获得育性恢复、结实性好的BC2代阳性单株。【本研究切入点】选育的BC2代阳性单株(15Q23)的遗传背景与芥蓝仍有不少差异,需要进一步回交以减少背景的干扰;且15Q23自然结实性仍很低(<0.1粒/种荚),远达不到正常水平,自然授粉结实性有待进一步提升。【拟解决的关键问题】利用芥蓝对BC2代育性较好的单株15Q23进一步回交,分析BC3代和BC4代的传递效率(transmission rate,TR),分析BC3代单株遗传背景,获得育性恢复、花粉活力好、结实性强的BC3代单株。
1 材料与方法
1.1 试验材料
回交母本:Ogura CMS芥蓝15Y102。第3代回交父本:芥蓝与甘蓝型油菜杂交后的BC2代中育性较好的单株15Q23,这是前期试验中利用芥蓝和含的甘蓝型油菜进行种间杂交,获得的种间杂种加倍后,回交两代后利用特异分子标记筛选结合形态、遗传背景分析获得的,该单株育性恢复、花粉活力显著优于其余单株,形态更接近于亲本芥蓝且结实性良好[1-2]。第4代回交父本:第3代回交后用标记筛选获得的育性恢复、背景更接近芥蓝母本的优良单株。
上述材料均由中国农业科学院蔬菜花卉研究所甘蓝课题组提供,于2015年、2016年秋季定植于本所南圃场,常规栽培管理。
1.2 BC3代单株的获得及Rfo阳性单株的筛选
2016年3月,在盛花期进行人工剥蕾去雄授粉,并挂牌标记杂交组合、授粉花蕾数,计算结实率(seed setting)等,结实率=饱满种子数/授粉花蕾数×100%。
将收获的BC3代种子分两批播种,第一批挑选少量种子于2016年7月底播种(编号为16Q),用于初筛,调查阳性株比例、形态特征和分析遗传背景;第二批在10月初播种,筛选阳性单株用于大规模的回交转育(编号为16QW)。所有BC3单株成苗后,采用改良CTAB法提取基因组DNA[15]。利用已开发的特异标记[1](-2F/-NEW-R)对两批BC3群体进行筛选,PCR扩增方法、体系及检测方法参照Yu等[1],计算的传递效率,传递效率=阳性单株数目/群体总单株数×100%。
1.3 16Q群体形态学性状调查及遗传背景分析
将16Q群体于9月初定植于温室,对各单株成熟期的形态特征进行观察和调查。共对16个形态特征进行调查,其中10个性状采取分级赋值法(表1),包括株型、基生叶颜色、基生叶形状、基生叶叶缘、基生叶叶面、叶面蜡粉、叶面光泽、基生叶翼、基生叶叶脉、花瓣颜色。另外6个性状利用刻度尺进行测量,包括株高、基生叶长、基生叶宽、叶柄长、花直径、花蕾长,这些测量数据根据王述民等[16]方法进行10级分类转化,1级<M-2σ,10级≥M+2σ,M代表平均值,σ为标准差,每一级差0.5σ。对统计的性状数据进行标准化,利用NTSYSpc2.11a软件,采用非加权类平均法(UPGMA)进行聚类分析。
利用于海龙等[17]开发的芥蓝与甘蓝型油菜之间的32对SSR多态性背景标记,对16Q群体的遗传背景进行分析。PCR反应体系及PCR扩增产物的检测方法均参照于海龙等[17]。针对引物扩增产生的每个等位变异,不同材料在该等位变异处有带记为1,无带记为0。利用NTSYSpc2.11a软件计算亲本和各世代单株间的遗传相似系数,采用UPGMA进行聚类分析。
1.4 BC3代Rfo阳性单株花粉活力评估和倍性分析
于盛花期对16Q群体中筛选的阳性单株的育性进行观察,并测定花粉活力。花粉活力测定采用醋酸洋红染色法,取植株新开的3朵花,将其花粉均匀涂于载玻片上,用1%的醋酸洋红染色,观察3个视野(视野内花粉粒数≥300)。为方便数据处理,对花粉活力进行分级,共划分4个等级,1级:≤25%;2级:25%<花粉活力≤50%;3级:50%<花粉活力<75%;4级:花粉活力≥75%。
利用流式细胞仪对16Q群体中的阳性单株采用流式细胞术(flow cytometry,FCM)方法进行倍性鉴定。参照Dolezel等[18]关于植物DNA相对含量测定的方法,略有改动,具体方法如下:取待测样品叶片200 mg,分别加入1—1.5 ml细胞裂解液(Galbraith’s buffer),以一次性锋利刀片切碎组织,混合匀浆,利用400目滤网将匀浆过滤到1.5 mL离心管中,滤液体积应>500 μL,弃上清,加入PI染液(工作浓度50 μg·mL-1)对核进行染色,避光处理30 min后,上机(BD FACSCaliburTM,BD Biosciences,San Jose,CA,USA)测量。以芥蓝2C DNA相对含量为参照,将其G0/G1期对应峰值调整到200通道处,根据杂种后代G0/G1期峰值的位置,判断其倍性。

表1 芥蓝和甘蓝型油菜杂交后回交后代的性状调查分级标准
1.5 BC4回交后代的获得、Rfo阳性单株的筛选及倍性分析
结合背景分析和育性调查结果,挑选16Q群体中育性较好、背景近于芥蓝的阳性单株为重点,与芥蓝15Y102进行第4代回交,统计每单株授粉花蕾数及结籽情况,计算各阳性单株的结实率。将获得的部分BC4代种子于2017年1月初播种,成苗后利用特异标记筛选阳性株,计算传递效率。
选取部分BC4代阳性单株利用流式细胞仪对其倍性进行鉴定。
1.6 数据统计与分析
数据统计和计算利用Microsoft Office Excel 2003,不同组合间方差分析、相关性分析和显著性检验均使用SPSS 11.0软件(SPSS,Chicago,IL,USA)。
2 结果
2.1 BC3代单株的获得及Rfo阳性单株的筛选
以15Q23为父本,利用Ogura CMS芥蓝15Y102为母本进行回交。在整个花期对15Q23的育性观察发现,15Q23在整个花期的不同阶段,该单株育性的差异较大,整体表现为开花后20 d内15Q23育性较好,花粉活力较高,平均花粉活力87%(表2、图1-a);20 d后,该单株花粉活力43%,部分花朵的花药上甚至观察不到花粉(表2、图1-b)。两个时期结实率存在极显著差异(<0.01),开花20 d内共收获种子265粒,结实率为13%,而开花20 d后,这段时期仅收获种子40粒(表2)。相关性分析表明,结实率和花粉活力间存在极显著正相关(<0.01)。
将收获的305粒种子分两批播种,第一批播种43粒,成苗34株(即16Q群体),利用特异标记筛选,17株为阳性(图1-c),传递效率为50%;第二批播种262粒,成苗229株(即16QW群体),特异标记检测结果表明,109株为阳性,传递效率为48%。两个群体阳性株与不含单株比值都近于1﹕1。

表2 15Q23单株在开花前期及后期的结实性比较
**代表在= 0.01水平上存在极显著差异
** represents extremely significant difference at=0.01 level

图c中1、2:芥蓝Chinese kale;3、4:Rfo甘蓝型油菜rapeseed with Rfo;5:15Q23;6—16:16Q群体部分单株(6、10、12、13、14、16为Rfo阳性株)Some individuals of 16Q group (6, 10, 12, 13, 14, 16 are Rfo-positive individuals)
2.2 BC3后代的遗传背景、形态和倍性分析
利用背景标记分析16Q群体的34株成苗后代的遗传背景,并观察其形态特征,期望获得形态学特征和遗传背景近于亲本芥蓝的单株。
将16Q群体的34株单株于2016年9月初定植于温室,对各单株的形态进行观察比较。34株BC3单株的形态整体上都近于芥蓝,如株型(半直立),叶型(卵圆、椭圆),叶面(微皱),叶色(深绿),叶面蜡粉(中),花瓣颜色(白)等性状基本与芥蓝一致(图2)。较亲本芥蓝,BC3代阳性单株的生长势较强,最大外叶长、最大外叶宽、茎粗、株高、花朵直径等性状的值均略高于亲本芥蓝。

苗期Seedling stage(a:15Y102;d:16Q1-4)、成熟期Mature stage(b:15Y102;e:16Q1-4)、开花期flowering stage(c:15Y102;f:16Q1-4)
对34株BC3代单株进行遗传背景聚类,结果表明在遗传相似系数0.74处,34株BC3后代和芥蓝15Y102聚为一类,与芥蓝15Y102遗传相似系数在0.81—0.92,高于其回交用父本15Q23(0.73)。其中,单株16Q1-34与芥蓝间遗传相似系数最高,为0.92,17个阳性株中,单株16Q1-8、16Q1-13、16Q1-18与亲本芥蓝间的遗传相似系数为0.90(图3-a)。
利用形态学数据对BC3后代植株的表型进行聚类分析,结果表明34株BC3后代与芥蓝15Y102聚为一个分支,甘蓝型油菜单独聚成一个分支,背景标记和形态学标记都表明所有BC3后代遗传背景近于亲本芥蓝。与背景标记聚类结果相比,利用形态数据聚类时,16Q群体中部分单株无法区分,表明形态学数据聚类分辨率较低(图3-b)。
利用流式细胞术,对34株BC3后代(16Q)的倍性进行鉴定,结果如图4所示,34株BC3后代单株倍性仍为多倍体形式。以芥蓝为参照标准(200),34个BC3后代中,只有单株16Q1-13的荧光峰值位于300通道处,推测倍性接近于三倍体;其余33个单株(包括阳性单株和不含的单株)的荧光峰值都位于400通道处,推测倍性接近于四倍体。
2.3 BC3代Rfo阳性单株的育性调查
开花后对所有单株育性进行调查,34个单株育性表现与标记筛选结果完全一致,所有阳性单株均有不同程度的花粉出现(图2-f),其余单株均为不育,标记筛选准确率达到100%。不同单株间育性表现存在差异,对阳性单株的花粉活力进行测定,单株16Q1-4、16Q1-7、16Q1-10在整个花期育性较好,花粉活力一直在75%以上(表3)。利用芥蓝对育性较好的阳性单株(16Q1-4、16Q1-7、16Q1-8、16Q1-10、16Q1-13、16Q1-19、16Q1-25、16Q1-27、16Q1-35,花粉活力>2级)进行回交,结实率统计结果表明(表3),单株16Q1-4和单株16Q-10结实性最好,结实率分别为15%和9%。显著性分析结果表明,较回交用父本BC2代阳性单株15Q23,单株16Q1-4和单株16Q-10结实率显著提高(<0.05)。相关性分析表明,BC3代阳性单株的结实率与花粉活力显著正相关(<0.05,=0.697*)。
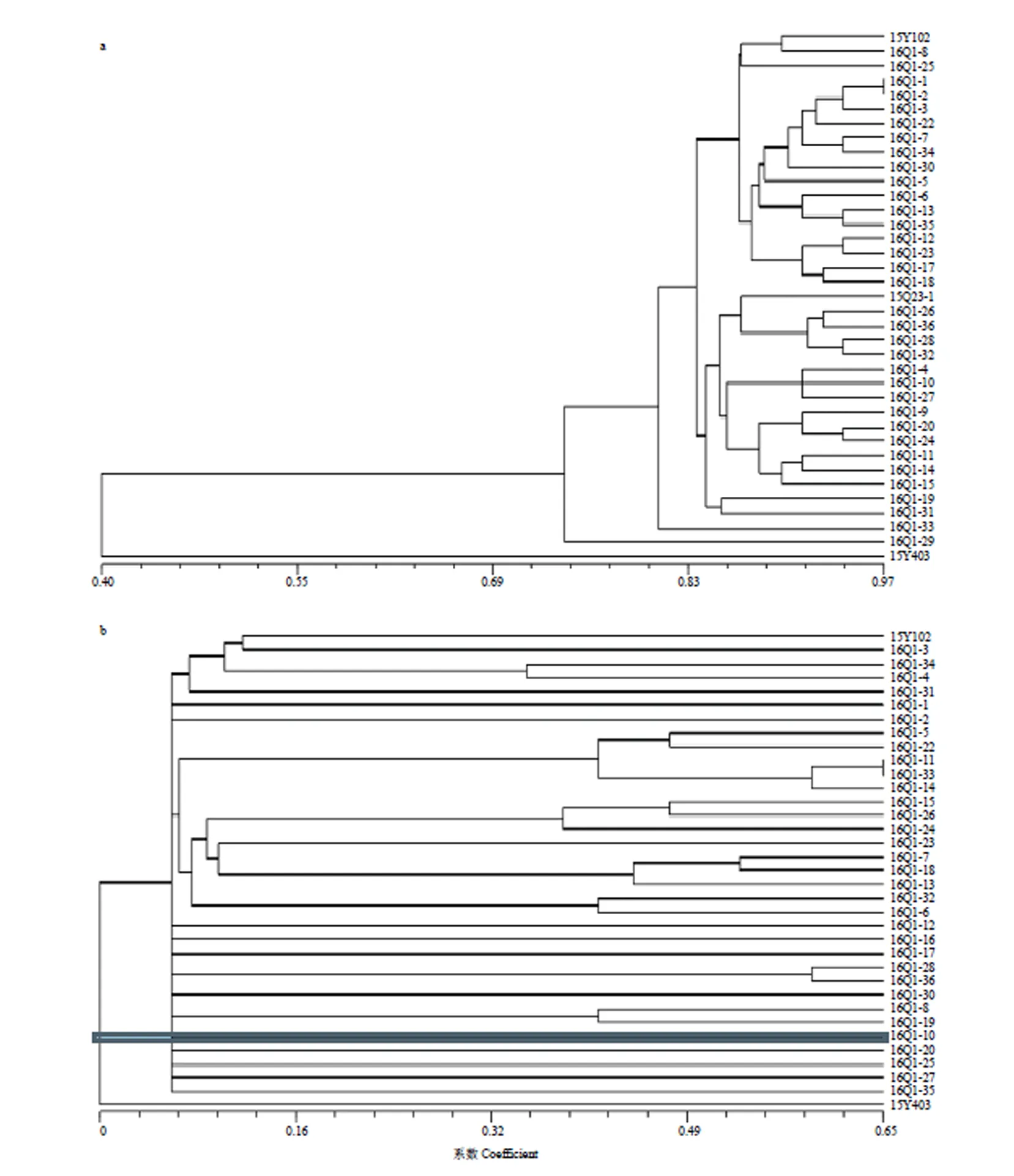
图3 SSR背景标记(a)和形态标记(b)用于34株BC3后代的聚类分析
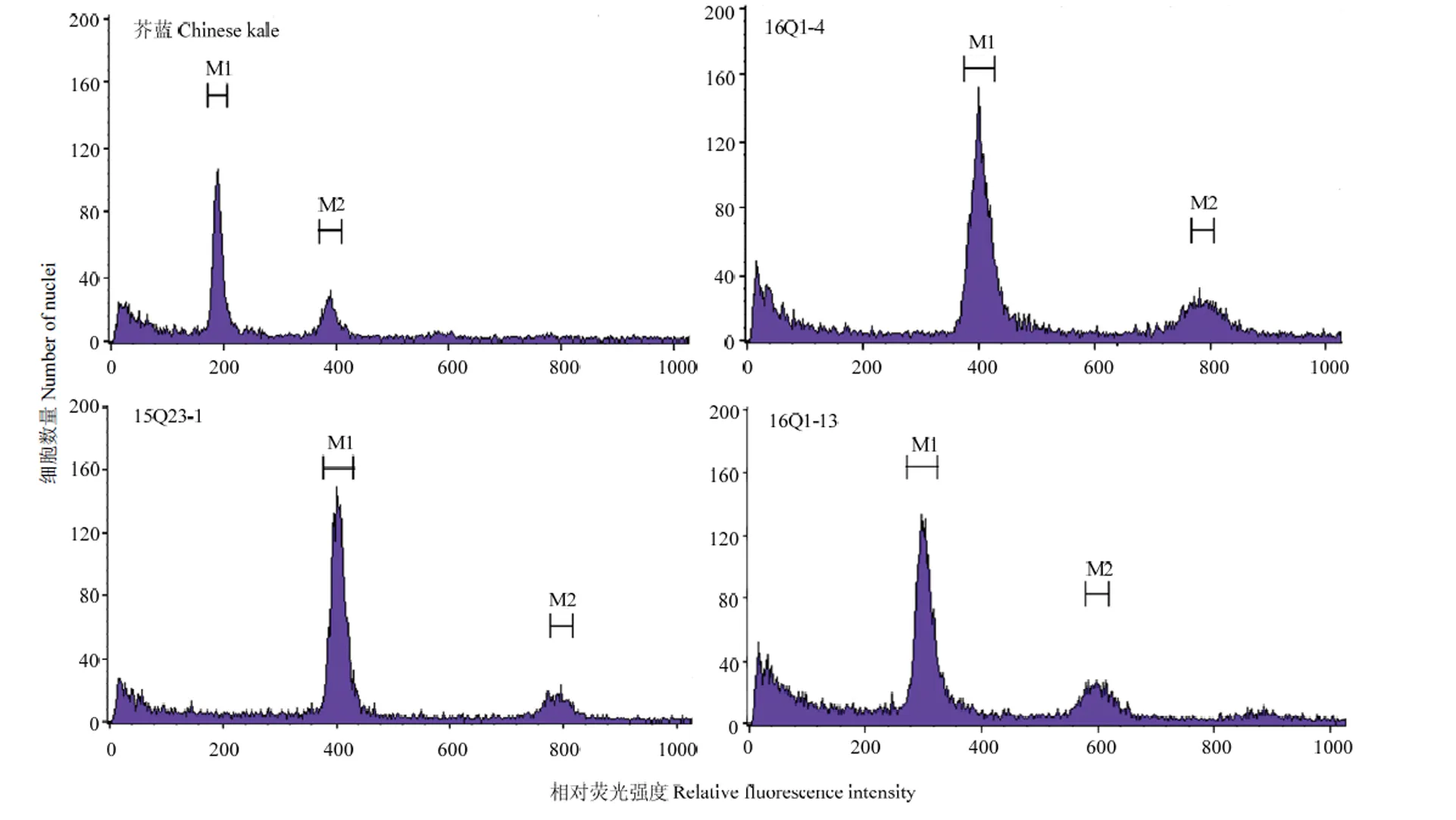
图4 BC2后代15Q23及BC3后代16Q1-4和16Q1-13的倍性鉴定
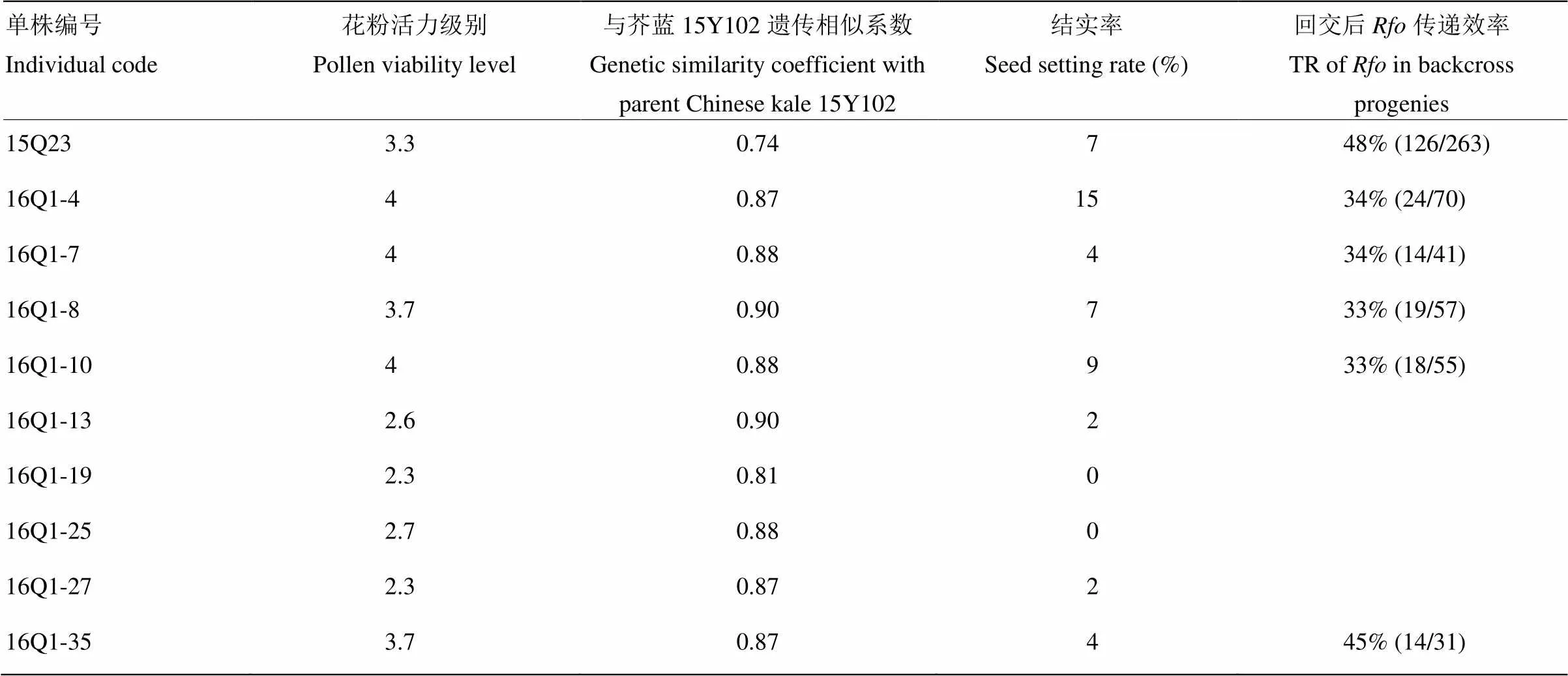
表3 BC3代花粉活力>2级的单株的遗传相似系数、结实率及其回交后代Rfo传递效率
2.4 BC4代的获得及Rfo传递效率
收获16Q群体中阳性单株16Q1-4、16Q1-7、16Q1-8、16Q1-10、16Q1-35回交获得的种子,播种成苗后利用特异标记进行检测,结果表明(表3、图5-a),不同单株回交后获得的BC4代中均含有阳性株,5株BC3代阳性株中除16Q1-35外(TR=45%),其余4株的传递效率均接近33%。该结果表明在BC4代可以稳定传递,但传递效率仍不正常,这可能是由于BC3代阳性单株的染色体组成仍为多倍体所导致。
对16Q1-4的24株阳性株进行倍性检测(图5),不同单株间倍性差异较大,3株位于180—200(图5-b),14株阳性株峰值位于200—300(图5-c),7株位于300—400(图5-d)。上述结果表明,利用芥蓝对种间六倍体阳性株多代回交,其倍性存在分离,可从中获得倍性近于亲本芥蓝的材料,但其遗传组成仍需进一步分析。
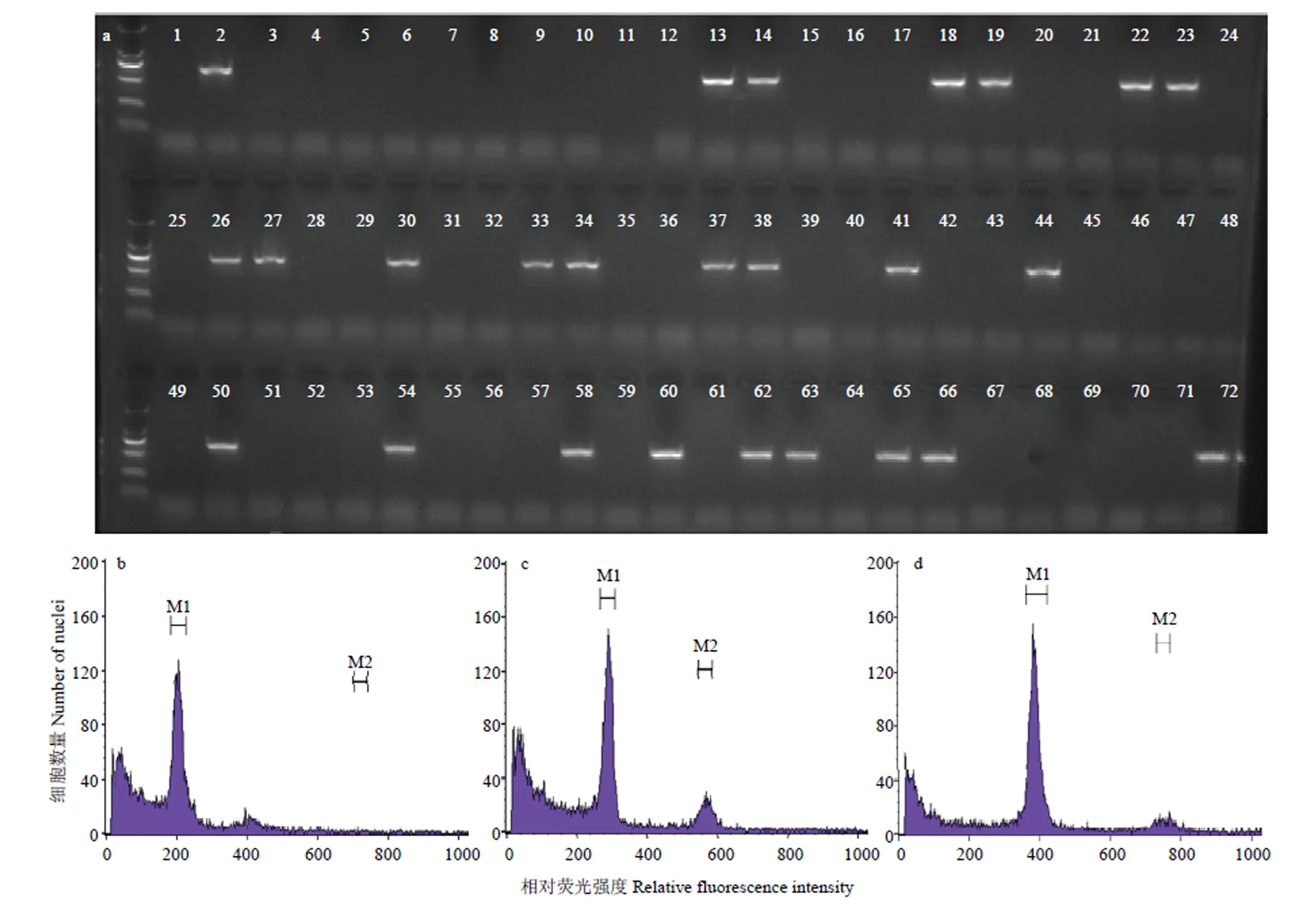
a:16Q1-4的70个回交后代Rfo筛选Rfo screening of 70 backcross progenies of 16Q1-4。1:芥蓝Chinese kale 15Y102;2:15Q23;3—72:16Q1-4的回交后代70 backcross progenies of 16Q1-4。b:单株的荧光峰值位于200 the peaks of G0/G1 peak on 200 channels;c:单株的荧光峰值位于290 the peaks of G0/G1 peak on 290 channels;d:单株的荧光峰值位于390 The peaks of G0/G1 peak on 390 channels
3 讨论
3.1 芸薹属远缘杂交中种间三倍体的利用
甘蓝型油菜(AACC)是由甘蓝(CC)和白菜(AA)杂交后自然加倍获得的,三者同属十字花科芸薹属,亲缘关系较近[19](U,1935)。远缘杂交已成为三者间遗传背景拓展和种质资源改良的重要手段,但往往表现出杂交亲和障碍,杂种后代育性较差等问题,需要进行多轮胚挽救,多代回交和大量授粉工作才能克服[20-24]。白菜(AA)与甘蓝型油菜(AACC)间亲和性较强,较易获得F1种间杂种AAC,利用两者间远缘杂交后多代自交是甘蓝型油菜遗传背景拓展的重要手段之一[25-26],且前人研究表明F1后代AAC育性较高,花粉活力>50%,且在减数分裂时期,A染色体间配对稳定,整倍体配子出现频率较高(5%—15%,A/AC,n=10/19)[27-28]。不同于白菜AA和甘蓝型油菜AACC远缘杂交较易获得后代,甘蓝类蔬菜CC和甘蓝型油菜之间进行远缘杂交很难获得后代,前人相关研究较少,且很少进行多代回交转育[20-21,29]。此外,CC×AACC杂交后获得的种间杂种ACC单株育性较差,很难进行回交得到后代,张玉成等[30]利用结球甘蓝做父本与ACC单株进行杂交,结荚正常,但后代结实率仅为0.01%;Yang等[31]对ACC单株的育性和减数分裂行为进行调查,试验结果表明,ACC单株减数分裂时期染色体分离异常,且在A和C染色体组之间常出现异源联会,植株不育,无法获得后代;Li等[32]观察到ACC的花粉母细胞终变期配对形式多为9Ⅱ+10Ⅰ或10Ⅱ+8Ⅰ形式,在减数分裂后期多为不均等分离,配子以13﹕15和14﹕14的分离形式比例最高,有观察到出现9﹕19的分离形式,这表明ACC单株在花粉母细胞减数分裂时期可能会出现整倍体配子(C/AC)。在前期研究中,利用芥蓝对获得的种间F1三倍体育性恢复单株YL2进行了回交[1],获得了形态特征近于母本芥蓝的后代,但经特异标记检测,没有阳性株,全为不育类型。目前没有研究报道ACC可以与CC回交获得CC型后代。今后,在甘蓝与甘蓝型油菜的远缘杂交试验中,可尝试对种间杂种F1(ACC)进行大量正反交,期望直接分离出整倍体C型配子,从而缩短异源基因的转育年限。
3.2 六倍体AACCCC在Rfo基因转育中的影响
前人研究表明,对CC和AACC获得的ACC杂种进行染色体加倍,获得AACCCC单株,可有效提高与AA或AACC基因型材料杂交的结实性[33-34]。AACCCC多数花粉母细胞在减数分裂时期多是28﹕28(18C+10A﹕18C+10A)分离,分离规律相对稳定[34],钱伟等[35]发明了以甘蓝型油菜与甘蓝杂交,染色体加倍获得的六倍体为桥梁再与白菜杂交,创建新型甘蓝型油菜的方法。利用该桥梁,将野生甘蓝中的菌核病抗性分别转移到白菜型油菜和甘蓝型油菜中,且后代结实正常[33-34];不同于AACCCC与CC或AACC杂交,AACCCC与CC杂交很难正常结实,且回交两代后染色体仍分离异常[2],在前期研究中,为保证传递,提高种间杂种单株育性,笔者将获得F1代种间阳性株进行加倍处理,并利用芥蓝对加倍后AACCCC单株进行第二代回交,20 733个种荚中仅获得98个单株,其中5株为阳性,结合形态、背景和育性比较,筛选出1株遗传背景、形态特征近于芥蓝、育性恢复稳定、可不进行胚挽救自然少量结实(结实率=7%)的BC2代单株15Q23[2]。本研究以该单株15Q23为父本,利用芥蓝对其进一步回交后获得126株阳性单株,可稳定传递(表2,TR=48%),BC3后代遗传背景较上一代单株15Q23更近于芥蓝,部分单株育性稳定,花粉活力>75%(表3,16Q1-4、16Q1-7、16Q1-10),单株16Q1-4和16Q1-10结实性较15Q23有显著提高(<0.05)。后期倍性鉴定结果表明,15Q23为BC1代单株(AnCnCoCo)与芥蓝回交后获得,倍性近于四倍体(图4),是对照芥蓝的2倍,DNA相对含量高于甘蓝型油菜(AnCnAnCn)。根据倍性推测,15Q23组成形式可能为CoCoCnC*A*(C*和A*表示非整套染色体组),其中一套完整的Co来源于回交芥蓝,其余染色体是由于BC1代AnCnCoCo染色体配对异常,导致染色体不均等分离,BC1单株形成了CoCnC*A*型的配子,根据染色体组成形式和15Q23后代阳性株比例,推测位点的基因型可能为,分别位于4套C染色体组上。而15Q23回交后产生的BC3代阳性单株的倍性介于三倍体和四倍体之间,传递效率均接近33%(表3、图4),推测染色体组成形式可能为CoCoC*A*,位点的基因型可能为,分别位于3套C染色体组上。因此,对ACC进行染色体加倍有利于提高杂种后代的育性以及保证的稳定传递,但BC3后代的染色体倍性还比较混杂,杂种后代的染色体要完全恢复到亲本芥蓝的水平仍需多代回交和大量授粉。然而,当利用BC3代育性较好的单株进一步回交获得BC4后代时,发现不仅可以继续稳定传递(表3),而且还有部分单株的倍性非常接近于亲本芥蓝(图5)。因此,在后续试验中,设想可结合小孢子培养和遗传组成分析,期望在多倍体阳性后代中分离出正常的CC配子;或对杂种后代中倍性近于二倍体的后代进行自交和正反交,加快甘蓝类蔬菜(2C=18)Ogura CMS恢复材料的获得。
4 结论
利用芥蓝对芥蓝-甘蓝型油菜BC2代育性较好单株15Q23进一步回交,获得了BC3和BC4后代。特异标记筛选结果表明,在两个世代可稳定传递。倍性鉴定结果表明,BC4代倍性存在分离,部分阳性单株倍性接近于亲本芥蓝。结合背景分析、形态观察、育性比较,获得了两株育性稳定、形态特征近于芥蓝、遗传背景和结实性较上一代显著提升的BC3单株16Q1-4和16Q1-10。
[1] Yu H L, Fang Z Y, Liu Y M, Yang L M, Zhuang M, Lv H H, Li Z S, Han F Q, Liu X P, Zhang Y Y. Development of a novel allele-specificmarker and creation of Ogura CMS fertility- restored interspecific hybrids in., 2016, 129(8): 1625-1637.
[2] Yu H L, Li Z Z, Yang L M, Liu Y M, Zhuang M, Lv H H, Li Z S, Han F Q, Liu X P, Fang Z Y, Zhang Y Y. Morphological and molecular characterization of the second backcross progenies of Ogu-CMS Chinese kale and rapeseed., 2017, 213(2): 55.
[3] 方智远, 刘玉梅, 杨丽梅, 王晓武, 庄木, 张扬勇, 孙培田. 我国甘蓝遗传育种研究概况. 园艺学报, 2002, 29(增刊): 657-663.
Fang Z Y, Liu Y M, Yang L M, Wang X W, Zhuang M, Zhang Y Y, Sun P T. A survey of research in genetic breedings of cabbage in China., 2002, 29(Suppl.): 657-663. (in Chinese)
[4] 方智远. 中国蔬菜育种学. 北京: 中国农业出版社, 2017: 582-588.
Fang Z Y.. Beijing: China Agriculture Press, 2017: 582-588. (in Chinese)
[5] Bannerot H, Boulidard L, Couderon Y, Temple J. Transfer of cytoplasmic male sterility fromto//Wills A B, North C.. Scottish Horticultural Research Institute, 1974: 52-54.
[6] Walters T W, Mutschler M A, Earle E D. Protoplast fusion-derived Ogura male-sterile cauliflower with cold tolerance., 1992, 10(12): 624-628.
[7] 杨丽梅, 方智远, 刘玉梅, 庄木, 张扬勇, 孙培田. “十一五”我国甘蓝遗传育种研究进展. 中国蔬菜, 2011(2): 1-10.
Yang L M, Fang Z Y, Liu Y M, Zhuang M, Zhang Y Y, Sun P T. Advances of research on cabbage genetics and breeding during ‘the eleventh five-year plan’ in China., 2011(2): 1-10. (in Chinese)
[8] 张德双, 陈斌, 张凤兰, 余阳俊, 赵岫云, 于拴仓, 徐家炳. 一种紫色大白菜细胞质不育系的分子鉴定. 华北农学报, 2009, 24(3): 174-178.
Zhang D S, Chen B, Zhang F L, Yu Y J, Zhao X Y, Yu S C, Xu J B. Molecular identification of a purple Chinese cabbage CMS material., 2009, 24(3): 174-178. (in Chinese)
[9] 张小丽. 青花菜抗根肿病遗传分析与种质创制[D]. 北京: 中国农业科学院, 2014.
Zhang X L. Genetic analysis and created germplasm of clubroot resistance in broccoli (L. var.)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)
[10] 陈静, 任雪松, 宋洪元, 李成琼, 袁天成, 司军. 4个不同地区十字花科根肿病菌生理小种鉴定及甘蓝新组合的抗性鉴定. 西南大学学报(自然科学版), 2016, 38(1): 67-72.
Chen J, Ren X S, Song H Y, Li C Q, Yuan T C, Si J. Identification of races offrom four different regions and resistance identification of new cabbage cross combinations., 2016, 38(1): 67-72. (in Chinese)
[11] Delourme R, Eber F, Renard M. Radish cytoplasmic male sterility in rapeseed: breeding restorer lines with a good female fertility//University of Saskatchewan, Saskatoon, Canada, 1991: 1506-1510.
[12] Primard-Brisset C, Poupard J P, Horvais R, Eber F, Pelletier G, Remard M, Delourme R. A new recombined double low restorer line for the-INRA cms in rapeseed (L.)., 2005, 111(4): 736-746.
[13] Hu X, Sullivan-Gilbert M, Kubik T, Danielson J, Hnatiuk N, Marchione W, Greene T, Thompson S A. Mapping of the Ogura fertility restorer geneand development ofallele-specific markers in canola (L.)., 2008, 22(4): 663-674.
[14] Feng J, Primomo V, Li Z, Zhang Y, Jan C C, Tulsieram L, Xu S S. Physical localization and genetic mapping of the fertility restoration genein canola (L.)., 2009, 52(4): 401-407.
[15] Saghai-Maroof M A, Soliman K M, Jorgensen R A, Allard R W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics., 1984, 81(24): 8014-8018.
[16] 王述民, 曹永生, Redden R J, 胡家蓬, Usher T. 我国小豆种质资源形态多样性鉴定与分类研究. 作物学报, 2002, 28(6): 727-733.
Wang S M, Cao Y S, Redden R J, Hu J P, Usher T. The morphological diversity and classification of Adzuki bean [gularis (Wil ld.) Ohwi & Ohashi] germplasm resources in China., 2002, 28(6): 727-733. (in Chinese)
[17] 于海龙, 方智远, 杨丽梅, 刘玉梅, 庄木, 李占省, 吕红豪, 张扬勇. SSR标记辅助芥蓝×甘蓝型油菜种间杂交后代的遗传背景筛选. 中国蔬菜, 2015(8): 14-21.
Yu H L, Fang Z Y, Yang L M, Liu Y M, Zhuang M, Li Z S, Lü H H, Zhang Y Y. Genetic background screen of inter-specific hybrids between SSR marker assisted Chinese kale and rapeseed., 2015(8): 14-21. (in Chinese)
[18] Dolezel J, Greilhuber J, Suda J. Estimation of nuclear DNA content in plants using flow cytometry., 2007, 2(9): 2233-2244.
[19] NAGAHARU U. Genomic analysis inwith special reference to the experimental formation ofand peculiar mode of fertility., 1935, 7: 389-452.
[20] Ayotte R, Harney P M, Machado V S. The transfer of triazine resistance fromL. toL. I. Production of F1hybrids through embryo rescue., 1987, 36(2): 615-624.
[21] Ripley V L, Beversdorf W D. Development of self-incompatible(I) introgression of S-alleles fromthrough interspecific hybridization., 2003, 122(1): 1-5.
[22] Wen J, Tu J X, Li Z Y, Fu T D, Ma C Z, Shen J X. Improving ovary and embryo culture techniques for efficient resynthesis offrom reciprocal crosses between yellow-seeded diploidsand., 2008, 162(1): 81-89.
[23] Mei J, Liu Y, Wei D, Wittkop B, Ding Y, LI Q, LI J, WAN H, LI Z, GE X, Frauen M, Snowdon R J, Qian W, Friedt W. Transfer of sclerotinia resistance from wild relative ofintousing a hexaploidy step., 2015, 128(4): 639-644.
[24] Li Q F, Mei J Q, Zhang Y J, Li J N, Ge X H, Li Z Y, Qian W. A large-scale introgression of genomic components ofintoby the bridge of hexaploid derived from hybridization betweenand., 2013, 126(8): 2073-2080.
[25] Lu C, Kato M. Fertilization fitness and relation to chromosome number in interspecific progeny betweenand: a comparative study using natural and resynthesized., 2001, 51(2): 73-81.
[26] Qian W, Chen X, Fu D, Zou J, Meng J. Intersubgenomic heterosis in seed yield potential observed in a new type ofintrogressed with partialgenome., 2005, 110(7): 1187-1194.
[27] Leflon M, Eber F, Letanneur J C, Chelysheva L, Coriton O, Huteau V, Ryder C D, Barker G, Jenczewski E, ChÈvre A M. Pairing and recombination at meiosis of(AA) ×(AACC) hybrids., 2006, 113(8): 1467-1480.
[28] Pelé A, Trotoux G, Eber F, Lodé M, Gilet M, Deniot G, Falentin C, Nègre S, Morice J, Rousseau-Gueutin M, Chèvre A M. The poor lonesome A subgenome ofvar.(AACC) may not survive without its mate., 2017, 213(4): 1886-1897.
[29] Quazi M H. Interspecific hybrids betweenL. andL. developed by embryo culture., 1988, 75(2): 309-318.
[30] 张玉成, 王彦华, 陈雪平, 申书兴. 异源三倍体(ACC)与结球甘蓝回交的受精及胚胎发育. 河北农业大学学报, 2008, 31(6): 13-15.
Zhang Y C, Wang Y H, Chen X P, Shen S X. Fertilization and embryo development in the backcross of cabbage with allotriploid., 2008, 31(6): 13-15. (in Chinese)
[31] Yang Y, Wei X, Shi G, WEI F, Braynen j, Zhang J, Tian B, Cao G, Zhang X. Molecular and cytological analyses of A and C genomes at meiosis in synthetic allotriploidhybrids (ACC) between(AACC) and(CC)., 2017, 60(2): 181-188.
[32] Li Q, Zhou Q, Mei J, Zhang Y, Li J, Li Z, Ge X, Xiong Z, Huang Y, Qian W. Improvement ofvia interspecific hybridization betweenand., 2014, 34(4): 1955-1963.
[33] 刘瑶, 丁一娟, 汪雷, 万华方, 梅家琴, 钱伟. 甘蓝型油菜与AnAnCnCnCoCo六倍体的可交配性及杂种菌核病抗性. 中国农业科学, 2015, 48(24): 4885-4891.
LIU Y, DING Y J, WANG L, WAN H F, MEI J Q, QIAN W. Crossability betweenwith hexaploid AnAnCnCnCoCoandresistance in the hybrids., 2015, 48(24): 4885-4891. (in Chinese)
[34] 李勤菲, 陈致富, 刘瑶, 梅家琴, 钱伟. 六倍体(AnAnCnCnCoCo)与白菜型油菜杂交可交配性及后代菌核病抗性. 中国农业科学, 2017, 50(1): 123-130.
LI Q F, CHEN Z F, LIU Y, MEI J Q, QIAN W.Crossability andresistance among hybrids between hexaploid (AnAnCnCnCoCo) and, 2017, 50(1): 123-130. (in Chinese)
[35] 钱伟, 李勤菲, 梅家琴, 付东辉, 李加纳. 一种利用白菜型油菜拓宽甘蓝型油菜遗传变异的方法: ZL. 201010607185.4[P] (2012-07- 11)[2018-03-06].
QIAN W, LI Q F, MEI J Q, FU D H, LI J N. A strategy of usingto widen genetic variance of: Zl. 201010607185. 4[P]. (2012-07-11)[2018-03-06]. (in Chinese)
(责任编辑 岳梅)
Development of fertility-restored BC3progenies in Ogura CMS Chinese kale and analysis on Gene transmission rate ofand genetic background
YU HaiLong1,2, LI ZhiYuan2, YANG LiMei2, LIU YuMei2, ZHUANG Mu2, LÜ HongHao2, LI ZhanSheng2, FANG ZhiYuan1,2, ZHANG YangYong2
(1College of Horticulture, Northwest A&F University, Yangling 712100, Shaanxi;2Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】Development of Ogura cytoplasmic male sterility (Ogura CMS) restorer lines is an effective way to utilize Ogura CMS germplasm resources. In order to obtain the Ogura CMS fertility-restored lines in, BC2fertility-restored individuals 15Q23 were backcrossed with Chinese kale parent, and the transmission rate (TR) ofrestorer gene, genetic background, seed setting and ploidy were investigated in the BC3-positive progenies, which will accelerate the creation the Ogura CMS fertility restorer lines in. 【Method】The BC2fertility-restored individual 15Q23 with better fertility performance was chosen as male parent to backcross with Ogura CMS Chinese kale 15Y102. The BC3progenies were produced and screened by thespecific markers. The TR ofin BC3generations was calculated. Morphological identification, fertility observation, seed setting ability and ploidy evaluation were performed to select BC3-positive individuals with better seed setting and genetic background similar to the parent Chinese kale; these individuals were then used as pollen donors to develop the BC4generation. The TR ofand ploidy of the-positive individuals in BC4generations were evaluated. 【Result】The pollen viability and seed setting of 15Q23 differed at different flowering periods, with an average of 0.07 seeds per pod (7%). The BC3generations individuals were screened by-specific marker and thecould be transmitted stably. The genetic similarity coefficients between BC3individuals and Chinese kale 15Y102 were 0.81-0.92, higher than that of 15Q23 (0.73), indicating that the genetic background of BC3individuals was closer to the parent Chinese kale. These results were further confirmed by the clustering result of morphological markers. Morphological observation revealed that the BC3individuals were very similar to the parent Chinese kale 15Y102, whereas the growth vigor of BC3individual was higher than that of the parent Chinese kale. Ploidy identification showed that most of the BC3individuals were still close to tetraploid. During the flowering stage, all of the BC3-positive individuals were fertility-restored and the pollen viability of them was different among different BC3individuals. The individuals 16Q1-4, 16Q1-7, 16Q1-10 showed better fertility performance during the whole flowering period, and their pollen viability was above 75%. The individuals with >50% pollen viability were chosen as pollen donors to backcross with Chinese kale and their seed setting was calculated. Compared with other BC3-positive individuals, the seed setting of individual 16Q1-4 and 16Q1-10 was 15% and 9%, respectively, much higher than other BC3-positive individuals, and significantly higher than that of 15Q23 (7%,<0.05). Furthermore, thecould be transmitted in BC4generation and the TR ofwas nearly 33%. Ploidy identification was performed among the 24 BC4-positive individuals, which were derived from 16Q1-4. The results indicated that the ploidy differed in the 24 BC4-positive individuals and the peaks of G0/G1period in three individuals were close to that of parent Chinese kale. 【Conclusion】The interspecific hexaploid hybrid was further backcrossed with Chinese kale to produce the BC3and BC4generations. The results indicated that thecan be stably transmitted. Two individuals, 16Q1-4 and 16Q1-10, morphologically similar to parent Chinese kale 15Y102, have been successfully created with closer genetic background to Chinese kale compared with BC2pollen donor 15Q23, and significantly improved seed setting.
Chinese kale; fertility restoration; transmission rate (TR) of; genetic background
10.3864/j.issn.0578-1752.2018.09.012
2018-01-11;
2018-03-06
国家重点研发计划(2016YFD0101702)、国家自然科学基金(31572141)、国家现代农业产业技术体系建设专项(CARS-25)、农业部园艺作物生物学与种质创制重点实验室项目
于海龙,E-mail:yuhailongnet@163.com。李志远,E-mail:lizy1992@126.com。于海龙和李志远为同等贡献作者。
方智远,E-mail:cabbage8756@126.com。通信作者张扬勇,E-mail:zhangyangyong@caas.cn
