中国蒽环类药物治疗淋巴瘤专家共识
2018-05-14石远凯孙燕马军王华庆双跃荣白鸥孙秀华何小慧宋永平李玉富吴密璐沈丽达张会来张明智张清媛苏航邹立群陈国安金川林桐榆胡建达姜文奇高玉环黄昱姜时雨
石远凯 孙燕 马军 王华庆 双跃荣 白鸥 孙秀华 何小慧 宋永平 李玉富 吴密璐沈丽达 张会来 张明智 张清媛 苏航 邹立群 陈国安 金川 林桐榆 胡建达 姜文奇高玉环 黄昱 姜时雨
蒽环类药物(anthracyclines)是在肿瘤内科治疗发展历程中具有里程碑意义的药物,也是霍奇金淋巴瘤(Hodgkin's lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)化疗的基本和重要药物,得到广泛应用,即使在靶向治疗、免疫治疗等新疗法不断出现的今天,仍然是很多实体肿瘤和血液淋巴系统恶性肿瘤的基础性治疗药物。为了进一步规范蒽环类药物在肿瘤治疗中的合理应用,中国抗癌协会肿瘤临床化疗专业委员会组织专家制定了系列的《中国蒽环类药物治疗恶性肿瘤专家共识》,包括《中国蒽环类药物特性专家共识》《中国蒽环类药物治疗淋巴瘤专家共识》《中国蒽环类药物治疗白血病专家共识》《中国蒽环类药物治疗乳腺癌专家共识》《中国蒽环类药物治疗泌尿系统恶性肿瘤专家共识》《中国蒽环类药物应用心脏毒性处理专家共识》等。这些专家共识将陆续发表,本文是《中国蒽环类药物治疗淋巴瘤专家共识》。
1 淋巴瘤治疗中各蒽环类药物的选择
阿霉素是淋巴瘤化疗方案中最经典的蒽环类药物,因临床研究的证据最为充分,推荐在此类药物中作为首选药物。表阿霉素的心脏毒性和骨髓毒性较阿霉素轻。吡喃阿霉素的脱发、心脏毒性和骨髓毒性弱于阿霉素。米托蒽醌的心脏毒性较轻,可用于老年患者,但一线治疗的疗效似乎较阿霉素差,多用于解救治疗。脂质体阿霉素的心脏毒性轻于阿霉素,多用于老年淋巴瘤、皮肤淋巴瘤患者。
2 含蒽环类药物方案在淋巴瘤中的适用范围
化疗是淋巴瘤的主要治疗手段之一,蒽环类药物是许多联合化疗方案的重要组成部分,有时需要与生物免疫治疗药物或靶向治疗药物联合使用。淋巴瘤是一大类疾病,不同病种间的治疗方案有所不同。
2.1 霍奇金淋巴瘤
HL包括以下分型:1)经典型HL:经典型HL的主要一线化疗方案均包括蒽环类药物。初治患者可选择的化疗方案包括阿霉素+博来霉素+长春花碱+达卡巴嗪(ABVD)方案、阿霉素+长春花碱+氮芥+长春新碱+博来霉素+依托泊苷+泼尼松(Stanford V)方案[1-2],增高剂量的依托泊苷+阿霉素+环磷酰胺+长春新碱+博来霉素+泼尼松+甲基苄肼(BEACOPP)方案[3]、增高剂量的BEACOPP方案继之以ABVD方案联合放疗[4]。推荐ABVD方案作为我国经典型HL的标准方案。Stanford V方案和BEACOPP方案虽得到国外指南推荐,但在我国尚未得到普遍应用,今后可在有条件的中心使用。复发难治经典型HL患者可选择的化疗方案较多,常用的含蒽环类药物的方案有美司钠+异环磷酰胺+米托蒽醌+依托泊苷(MINE)方案。2)结节性淋巴细胞为主型HL:一线化疗方案可选择ABVD和环磷酰胺+阿霉素+长春新碱+泼尼松(CHOP)方案等。
2.2 非霍奇金淋巴瘤
NHL是一组恶性疾病的总称,起源于B淋巴细胞、T淋巴细胞或自然杀伤(NK)细胞。分为淋巴母细胞淋巴瘤和成熟B细胞淋巴瘤、成熟T和NK细胞淋巴瘤。
NHL的临床病程可以表现为惰性、侵袭性或高度侵袭性。一般而言,对于高度侵袭性和侵袭性淋巴瘤,无论分期如何,化疗均是主要的治疗手段。对于高度侵袭性淋巴瘤和B细胞侵袭性淋巴瘤,蒽环类是一线化疗方案中的重要药物。对于外周T细胞淋巴瘤,化疗方案各异。CHOP方案是治疗侵袭性淋巴瘤的经典方案。对于惰性淋巴瘤,化疗方案不一定包含蒽环类药物。对于有些类型的B细胞淋巴瘤,推荐在化疗基础上加用利妥昔单抗,以提高疗效。
对于各种类型的NHL,解救治疗有多种方案可供选择。含蒽环类药物的方案仅是多种治疗中的一种选择,米托蒽醌常出现在此类方案中。以下按病理类型分别介绍含蒽环类药物方案的治疗指征。
2.2.1 成熟B细胞淋巴瘤 1)弥漫大B细胞淋巴瘤:弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是NHL中最常见的类型,临床表现为侵袭性病程。DLBCL的治疗模式包括内科治疗和放疗等在内的综合治疗,内科治疗包括化疗和生物靶向治疗。治疗策略应根据年龄、国际预后指数(inter⁃national prognostic factors index,IPI)评分和分期等进行相应的调整。利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松(R-CHOP)方案是DLBCL标准的一线免疫化疗方案,少数医疗中心选用剂量密集的R-CHOP方案、剂量调整的利妥昔单抗+依托泊苷+环磷酰胺+阿霉素+长春新碱+泼尼松(R-EPOCH)方案。对于左心室功能差或非常虚弱的患者,可选择利妥昔单抗+环磷酰胺+依托泊苷+泼尼松+甲基苄肼(R-CEPP)、利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+泼尼松(R-CDOP)、利妥昔单抗+环磷酰胺+米托蒽醌+长春新碱+泼尼松(R-CNOP)、剂量调整的R-EPOCH或利妥昔单抗+环磷酰胺+依托泊苷+长春新碱+泼尼松(R-CEOP)方案。对于有合并症的年龄80岁以上患者,可采用R-mini-CHOP方案。对于伴中枢神经系统受侵的患者,需要在以上方案的基础上加用甲氨蝶呤全身化疗或鞘注药物。解救治疗含有蒽环类药物的方案为MINE方案。2)滤泡性淋巴瘤:1级和2级滤泡性淋巴瘤(follicular lympho⁃ma,FL)属于惰性淋巴瘤,3级FL特别是3b级FL的治疗等同于DLBCL。对于有治疗指征的1级和2级FL患者,可选择化疗、免疫化疗或放疗[5-6]。含有蒽环类药物的化疗方案有CHOP方案,可与利妥昔单抗联合应用。二线治疗方案中含蒽环类药物的方案有利妥昔单抗+氟达拉滨+米托蒽醌+地塞米松(RFND)方案。3)套细胞淋巴瘤:套细胞淋巴瘤(mantle cell lymphoma,MCL)自然病程可以表现为侵袭性和惰性。初始治疗可选择的含蒽环类药物的化疗方案包括硼替佐米+利妥昔单抗+环磷酰胺+阿霉素+泼尼松(VR-CAP)、R-CHOP、调整剂量的利妥昔单抗+地塞米松+长春新碱+环磷酰胺+阿霉素并与高剂量甲氨蝶呤和阿糖胞苷交替(R-Hyper CVAD)方案[5-6]等。对于年轻患者可以采用高强度化疗方案。4)伯基特淋巴瘤:伯基特淋巴瘤(Burkitt lymphoma,BL)属于高度侵袭性NHL,治疗以化疗为主,但CHOP方案疗效不理想,高剂量强化化疗可提高疗效。联合利妥昔单抗可以改善患者长期生存,特别是对年龄60岁以上的患者获益更大。但需进行中枢神经系统预防性治疗,并充分预防肿瘤溶解综合征的发生。BL可选择的含蒽环类药物的化疗方案包括:CAL⁃GB10002(环磷酰胺+泼尼松继以含异环磷酰胺或环磷酰胺治疗数周期;大剂量甲氨喋呤+亚叶酸+长春新碱+地塞米松+阿霉素或依托泊苷或阿糖胞苷;或鞘内甲氨喋呤+阿糖胞苷+氢化可的松三联治疗方案[7]联合利妥昔单抗、CODOX-M(环磷酰胺+阿霉素+长春新碱,鞘内注射甲氨喋呤+阿糖胞苷,继以高剂量全身甲氨喋呤治疗)/IVAC(异环磷酰胺+阿糖胞苷+依托泊苷及鞘内注射甲氨喋呤)交替应用方案[8-9]±利妥昔单抗、剂量调整的R-EPOCH或调整剂量的R-Hyper CVAD。二线治疗方案中含蒽环类药物有剂量调整的R-EPOCH。
2.2.2 成熟T细胞淋巴瘤 成熟T细胞淋巴瘤亦称外周T细胞淋巴瘤。对于间变性淋巴瘤激酶(ana⁃plastic lymphoma kinase,ALK)阳性的间变大细胞淋巴瘤,推荐方案包括CHOP-21和环磷酰胺+阿霉素+长春新碱+依托泊苷+泼尼松(CHOEP-21)方案。对于外周T细胞淋巴瘤非特指型、ALK阴性的间变大细胞淋巴瘤、血管免疫母T细胞淋巴瘤和肠病型T细胞淋巴瘤,化疗方案首先考虑CHOEP、CHOP-14、CHOP-21或剂量调整的EPOCH;也可考虑Hyper CVAD方案[5-6]。二线治疗中包含蒽环类药物的方案有剂量调整的EPOCH方案和MINE方案。鼻型结外NK/T细胞淋巴瘤(extranodal NK/T cell lymphoma,EN⁃KL)对CHOP方案化疗疗效欠佳,目前不推荐含蒽环类化疗方案用于此类型淋巴瘤的治疗。
3 含蒽环类方案的药物组成与剂量
淋巴瘤对化疗敏感,蒽环类药物的剂量与淋巴瘤疗效明确相关。在患者可耐受的情况下,应尽量给予足够剂量和足够疗程的药物。对于一些高强度的化疗方案,应在有经验的医疗中心按合适的剂量给予。
淋巴瘤常用的含蒽环类药物化疗方案的组成和推荐的剂量见表1。由于临床上患者的情况各异,应根据每个患者的具体情况决定药物剂量。临床上如用其他蒽环类药物替代阿霉素,则CHOP方案推荐表阿霉素剂量为60~90 mg/m2、吡喃阿霉素剂量为25~40 mg/m2、脂质体阿霉素剂量为20~25 mg/m2。
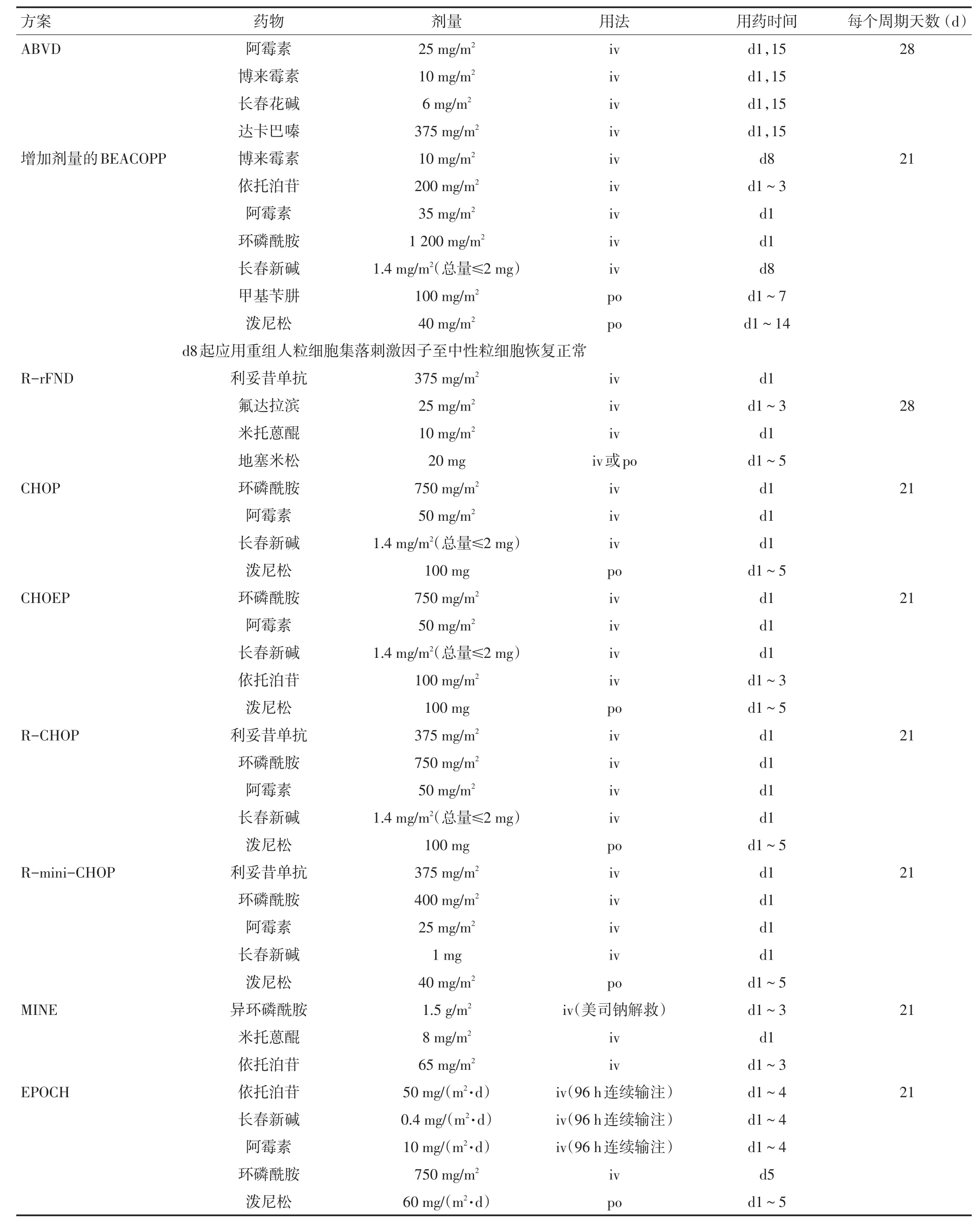
表1 淋巴瘤常用的含蒽环类药物的化疗方案
4 蒽环类药物不良反应及处理
心脏毒性是蒽环类药物重要的不良反应,用药前应进行心功能的检查和评估,包括心电图、超声心动、心肌酶谱检查等,特别是对于有心绞痛、心律失常和心功能不全病史者,更应该全面评估,用药过程中应实时监测心功能。蒽环类药物的心脏毒性预防和治疗及其他不良反应的处理详见《中国蒽环类药物特性专家共识》及相关专著等。
专家组成员
顾问
孙 燕 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
组长
石远凯 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
委员
马 军 哈尔滨血液病肿瘤研究所
王华庆 南开大学天津人民医院
双跃荣 江西省肿瘤医院
白 鸥 吉林大学第一医院
孙秀华 大连医科大学附属第二医院
何小慧 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
宋永平 河南省肿瘤医院
李玉富 河南省肿瘤医院
吴密璐 青海大学附属肿瘤医院
沈丽达 云南省肿瘤医院
张会来 天津医科大学肿瘤医院
张明智 郑州大学第一附属医院
张清媛 哈尔滨医科大学附属肿瘤医院
苏 航 中国人民解放军307医院
邹立群 四川大学华西医院
陈国安 南昌大学第一附属医院
金 川 广州医科大学附属肿瘤医院
林桐榆 中山大学附属肿瘤医院
胡建达 福建省血液病研究所,福建医科大学附属协和医院
姜文奇 中山大学附属肿瘤医院
高玉环 河北医科大学第四医院
执笔人
何小慧 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
石远凯 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
学术秘书
黄 昱 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
姜时雨 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院,抗肿瘤分子靶向药物临床研究北京市重点实验室
[1]Gordon LI,Hong F,Fisher RI,et al.Randomized phase III trial of ABVD versus Stanford V with or without radiation therapy in locally extensive and advanced-stage Hodgkin lymphoma:an intergroup study coordinated by the Eastern Cooperative Oncology Group(E2496)[J].J Clin Oncol,2013,31(6):684-691.
[2]Advani RH,Hoppe RT,Baer D,et al.Efficacy of abbreviated Stanford V chemotherapy and involved-field radiotherapy in early-stage Hodgkin lymphoma:mature results of the G4 trial[J].Ann Oncol,2013,24(4):1044-1048.
[3]Engert A,Haverkamp H,Kobe C,et al.Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin's lymphoma(HD15 trial):a randomised,open-label,phase 3 non-inferiority trial[J].Lancet,2012,379(9828):1791-1799.
[4]von Tresckow B,Plutschow A,Fuchs M,et al.Dose-intensification in early unfavorable Hodgkin's lymphoma:final analysis of the German Hodgkin Study Group HD14 trial[J].J Clin Oncol,2012,30(9):907-913.
[5]石远凯,孙燕,刘彤华.中国恶性淋巴瘤诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(2):148-158.
[6]中国抗癌协会肿瘤临床化疗专业委员会.中国淋巴瘤诊治专家共识(2016年版)[M].北京:人民卫生出版,2016.
[7]Rizzieri DA,JohnsonJL,ByrdJC,et al.Improvedefficacyusingrituximab and brief duration,high intensity chemotherapy with filgrastim support for Burkitt or aggressive lymphomas:cancer and Leukemia Group B study 10 002[J].Br J Haematol,2014,165(1):102-111.
[8]Mead GM,Sydes MR,Walewski J,et al.An international evaluation of CODOX-M and CODOX-M alternating with IVAC in adult Burkitt's lymphoma:results of United Kingdom Lymphoma Group LY06 study[J].Ann Oncol,2002,13(8):1264-1274.
[9]Barnes JA,Lacasce AS,Feng Y,et al.Evaluation of the addition of rituximab to CODOX-M/IVAC for Burkitt's lymphoma:a retrospective analysis[J].Ann Oncol,2011,22(8):1859-1864.
