水稻咪草烟抗性的遗传分析及其紧密连锁分子标记的筛选与应用
2018-05-14费云燕范方军王芳权李文奇朱金燕仲维功
费云燕 杨 杰,2,* 范方军,2 王芳权,2 李文奇,2 王 军,2 朱金燕,2 仲维功,2
水稻咪草烟抗性的遗传分析及其紧密连锁分子标记的筛选与应用
费云燕1杨 杰1,2,*范方军1,2王芳权1,2李文奇1,2王 军1,2朱金燕1,2仲维功1,2
1江苏省农业科学院粮食作物研究所, 江苏南京 210014;2扬州大学 / 江苏省粮食作物现代产业技术协同创新中心, 江苏扬州 225009
抗除草剂水稻的培育及推广能够提高除草效率, 取得巨大经济效益。本研究中金粳818为抗咪草烟资源, 以其与常规粳稻苏垦118杂交产生的F2群体对抗性基因进行遗传分析与分子定位表明, 其抗性表型受1对显性核基因控制, 位于水稻第2染色体SSR分子标记RM7413和RM7426之间。对该区间候选基因预测和测序发现, 咪草烟靶基因-乙酰乳酸合酶基因()在重要功能位点发生1个碱基的突变(G变为A), 导致一个氨基酸由丝氨酸(S)突变为天冬酰胺(N), 初步确定是抗性表型的重要候选基因。标记RM7413、RM7426与的物理距离分别为165 kb、1612 kb。以金粳818与南粳9108为亲本, 检测标记RM7413在辅助育种实践中的应用潜力, 对杂交种及其自交后代进行连续表型及标记选择, F7群体能够稳定遗传抗咪草烟性状, 表明RM7413在粳稻抗咪草烟辅助育种中具有巨大应用潜力。本研究结果为粳稻抗除草剂分子标记辅助改良奠定了基础。
粳稻; 分子标记辅助育种; RM7413; 金粳818; 咪草烟
草害是影响水稻产量的主要因素之一。杂草不仅与作物争夺水分、光照等, 同时易于寄生病虫害, 影响作物生长发育, 降低作物产量、品质, 影响收获效率, 造成巨大经济损失[1-2]。近年, 由于免耕、直播、抛秧、旱育秧等栽培技术的推广, 使稻田杂草危害加剧[3]。化学除草剂作为一种快速、有效、经济、实用的除草措施, 为全球农作物高产做出了巨大贡献。而除草剂对常规作物同样具有杀害性, 一定程度上限制了其使用范围, 培育和利用抗除草剂作物是推动化学除草剂发展的动力, 除草剂和抗性作物的配合使用是目前最为经济有效解决稻田杂草问题的方式。
培育抗除草剂作物的方法主要包括自然选择、人工诱变、杂交育种及转基因育种等。目前, 在抗不同种类除草剂的作物中, 只有抗草甘膦、草铵膦及抗咪唑啉酮类除草剂作物获得大面积的种植[4], 最受人们青睐的为用非转基因手段获得的抗咪唑啉酮类除草剂作物, 商业化的该类抗性作物主要有水稻、玉米、油菜、小麦和向日葵[5]。咪唑啉酮类除草剂由美国氰胺公司开发, 已有6个商业化品种, 包括咪唑烟酯、咪唑乙烟酸、咪唑喹啉酸、甲氧咪草烟、甲基咪草烟和咪草酸。这是一类广谱性除草剂, 通过抑制靶标酶——乙酰乳酸合酶(acetolactate synthase, ALS), 影响植物体内支链氨基酸合成, 进而影响植物生长, 具有活性高、杀草谱广、用量少、对哺乳动物低毒等特点[6]。咪草烟是咪唑乙烟酸家族成员, 可播前混土使用, 也可苗前、出苗后及插秧后使用, 适用于水稻整个生育期[7]。抗咪草烟水稻品种主要包括XL729、XL745、XP756和XP534[8], 美国通过推广抗咪草烟水稻获得巨大收益, 至2011年抗咪草烟水稻及其杂交稻已占美国水稻的50%[8], 该类水稻品种应用潜力巨大。
分子标记辅助选择与传统表型选择相比能精确跟踪目标性状, 减少育种的盲目性, 选择过程不受环境及人为因素影响; 减少田间工作, 节约育种成本; 且可在作物早世代进行目标性状的选择, 节约时间, 缩短育种周期[9]。分子标记辅助育种与传统育种手段结合在各作物的抗病、优质、高产等选育中发挥着重要作用, 抗除草剂作为一种优良性状, 越来越多的研究者着眼于筛选相关分子标记。胡茂龙等[10]开发了AP15F/AP18R、AP15F/AP19R标记用于抗咪唑啉酮类除草剂油菜的育种; 李志江等[11]筛选了水稻抗除草剂“拿捕净”的SSR标记并选育了抗除草剂材料; Bulos等[12]开发了向日葵抗除草剂的分子标记; Mithila等[13]筛选了芥子抗植物生长素类除草剂的分子标记, 这些标记为作物抗除草剂育种提供了便利。
本研究对筛选得到的抗咪草烟水稻品种金粳818进行遗传分析, 利用获得的连锁标记进行分子标记辅助育种, 并验证其在长江中下游常规粳稻中的应用潜力。该研究为粳稻抗除草剂分子标记辅助选择育种奠定了基础。
1 材料与方法
1.1 试验材料
金粳818、苏垦118、南粳9108及91份粳稻(表1)均为长江中下游主要推广的粳稻品种, 具有高产、稳产、优质等显著特点, 其中, 金粳818是本团队鉴定的具有抗咪草烟特性的粳稻品种。
1.2 表型鉴定
于江苏省农业科学院试验基地种植所有材料, 采用完全随机区组设计, 每行10株, 株行距为18 cm´22 cm, 以常规方法栽培。水稻种子催芽后播种, 在幼苗长至二叶一心时调查群体抗性, 利用咪草烟(70 g ai hm–2)喷洒筛选, 2周后调查表型, 将正常生长的幼苗记为抗咪草烟的个体, 将死亡的幼苗记为对咪草烟敏感的个体。
1.3 遗传分析
以金粳818与苏垦118杂交获得的F2群体作为遗传分析群体, 采用分群法定位基因[14]。根据F2群体的表型, 分别随机选取死亡与存活单株各5株, 取等量叶片, 构建抗性基因池与感性基因池, 以CTAB法提取DNA[15]。参照Gramene数据库(http://www.gramene.org/)中的SSR引物序列, 随机选择500对均匀分布于水稻12对染色体上的SSR分子标记, 筛选多态性标记。PCR体系(20mL)含2´PCR Green Mix, 10mL; SSR标记引物对(2mmol L–1), 各2mL; 模板DNA, 2mL; dH2O, 4mL。PCR条件为预变性94℃, 5 min; 变性94℃, 30 s; 退火60~50℃ (温度与引物相关), 30 s; 延伸72℃, 30 s; 30个循环; 延伸72℃, 5 min; 保温15℃。PCR产物经非变性聚丙烯酰胺凝胶电泳, 快速银染后观察[16]。利用多态性标记随机检测F2群体中的100株敏感单株, 构建遗传图谱。查询定位区间内所有基因信息, 筛选候选基因, 以日本晴的DNA序列设计引物, 扩增候选基因并测序, 分析测序结果。
1.4 连锁标记在育种中的应用
以金粳818为供体, 南粳9108为受体, 配制杂交组合, 杂交种自交得到F2群体, 利用1.3中连锁标记对F2群体单株进行鉴定并选择。对选择的植株连续自交并进行表型及标记筛选, 在F7获得稳定材料。随机选择F7群体中若干单株进行标记及表型鉴定, 确定连锁标记在抗咪草烟辅助育种中的可行性。进一步利用连锁标记对91份常规粳稻品种(表1)及金粳818进行多态性分析。若存在多态性, 则标记可应用于辅助改良常规粳稻的抗咪草烟性状, 获得抗咪草烟粳稻新品种。
2 结果与分析
2.1 表型鉴定
粳稻品种金粳818为抗咪草烟品种, 在幼苗期喷洒除草剂后仍能够正常生长, 叶片无枯萎变黄现象。常规粳稻品种为咪草烟敏感品种, 喷洒除草剂后, 植株停止生长, 叶片变黄并逐渐枯萎死亡(图1)。
表1 长江中下游主要推广的91份粳稻品种
2.2 遗传分析
以金粳818为供体, 苏垦118为受体, 收获F1种子, F1幼苗长至二叶一心时喷洒咪草烟, 结果显示F1植株全部存活, 表明杂种F1抗咪草烟。F2幼苗以相同的方式处理, 580株F2植株中, 430株抗性苗能够正常生长, 150株敏感苗立即枯萎死亡(图2), 抗、感植株符合3∶1理论分离比例(χ2=0.1862< χ20.05,1=3.84)。以上结果说明金粳818抗咪草烟性状由一对显性核基因控制。
2.3 基因定位
随机选择500对均匀分布于水稻12对染色体上的SSR分子标记, 对金粳818、苏垦118、抗、感DNA混合池进行多态性分析, 发现位于第2染色体上的SSR标记RM7632、RM7413、RM7426、RM5221在样本中主条带清晰, 多态性明显, 重复性好, 能够清楚分辨不同基因型。进一步利用这4对标记筛选F2群体中100株咪草烟敏感(隐性)单株, 发现重组个体分别为5、1、6和11, 将目标基因定位于RM7413和RM7426之间(图3)。经相关软件预测基因, 在定位区间内存在咪草烟靶基因, 测序分析发现该基因在重要功能位点第1880位碱基处G突变为A, 即第627位氨基酸由丝氨酸(Ser, S)突变为天冬酰胺(Asn, N)(图3)。
2.4 标记在实际育种中的应用
分子标记辅助育种为目前重要的育种手段, 因此本实验拟利用获得的抗咪草烟标记用于实际育种,验证其利用价值, 鉴于RM7413距离靶基因最近, 因此选其为目的标记。以金粳818为供体, 南粳9108为受体, 杂交组配收获F1, F1自交获得F2群体。选取F2个体50株, 利用标记RM7413(F: 5¢-GTCTGG TTGGCAGCTCTCTC-3¢; R: 5¢-CGACACACATCCA CGCAC-3¢)分析单株基因型, 选择与抗性亲本金粳818带型完全一致的单株, 选择的单株连续自交并通过表型及标记选择, 在F7获得稳定材料。为验证标记在抗咪草烟辅助育种中的可行性, 对F7群体进行表型分析, 同时对随机个体进行基因型鉴定, 结果表明F7植株在咪草烟处理下全部存活且生长良好,利用标记RM7413随机鉴定的10株苗均呈现与抗性亲本金粳818完全一致的带型(图5)。上述结果表明, SSR分子标记RM7413能够辅助选育抗咪草烟粳稻新品种。
若标记RM7413在常规粳稻及金粳818中存在多态, 则该标记可用于常规粳稻的除草剂抗性改良。本试验选取91份近年来在长江中下游推广的主要粳稻品种进行多态性鉴定。鉴定结果如图6所示, 91份推广品种均与金粳818存在多态性, 表明分子标记RM7413在长江中下游常规粳稻抗咪草烟改良中具有非常大的应用潜力。

图1 抗咪草烟水稻和咪草烟敏感水稻的表型
R: 抗咪草烟水稻金粳818; S: 感咪草烟水稻苏垦118。
R: imazethapyr-resistant rice Jinjing 818; S: imazethapyr-sensitive rice Suken 118.

图2 亲本金粳818、苏垦118和F2群体中咪草烟抗性及感性苗表型
R: 抗咪草烟幼苗; S: 感咪草烟幼苗。
R: imazethapyr-resistant seedlings; S: imazethapyr-sensitive seedlings.
3 讨论
长江中下游粳稻生产方式近年来向机械化、轻简化、规模化方向发展, 直播稻面积逐年扩大, 伴随直播的杂草稻危害也日趋严重, 本试验鉴定获得的抗咪草烟粳稻品种金粳818为直播稻田杂草稻防除提供了基因资源, 同时丰富了作物抗除草剂类型, 降低了单一使用草甘膦等除草剂的生态风险[17]。
长江中下游地区是我国粳稻主要生产区之一, 然而在由于育种过程中长期依赖于少数核心亲本, 导致江苏地区粳稻间亲缘关系较近, 遗传相似性较高[18-19]; 另有分析表明黑龙江、宁夏地区, 甚至全国范围内的粳稻材料同样存在该现象[20-22]; Viviana等[23]对智利的249份粳稻分析表明驯化瓶颈导致粳稻遗传多样性较低。这些研究都表明同一生态区粳稻遗传背景相近, 因此在开展粳-粳杂交品种后代的分子标记辅助选择育种中, 可用的多态性分子标记较少。本试验发现金粳818的咪草烟抗性与RM7413紧密连锁, 该标记与长江中下游主要推广的粳稻品种间存在多态性, 为长江中下游粳稻的抗咪草烟分子育种奠定了基础。
自1996年转基因作物正式商品化以来, 转基因技术被广泛应用于作物育种, 性状涉及抗除草剂、抗虫、抗干旱等, 其中在抗除草剂相关领域最为成功[24], 但转基因作物一直存在较大的争议使其不能够被广泛接受, 同时通过传统育种手段获得的抗除草剂作物极少, 导致中国在抗除草剂作物育种方面存在较大的空白。本试验结果证明粳稻资源金粳818与连锁标记RM7413能够用于抗咪草烟粳稻常规育种, 可极大简化育种过程, 为中国抗除草剂作物育种奠定基础。

图3 SSR标记RM7326、RM7413、RM7426、RM5221在咪草烟敏感植株中的基因型(部分图)
1: 抗性对照金粳818的基因型; 2: 敏感对照苏垦118的基因型; 其余为咪草烟敏感植株中基因型。
1: the genotype of Jinjing 818; 2: the genotype of Suken 118; others are the genotype of imazethapyr-sensitive seedlings.
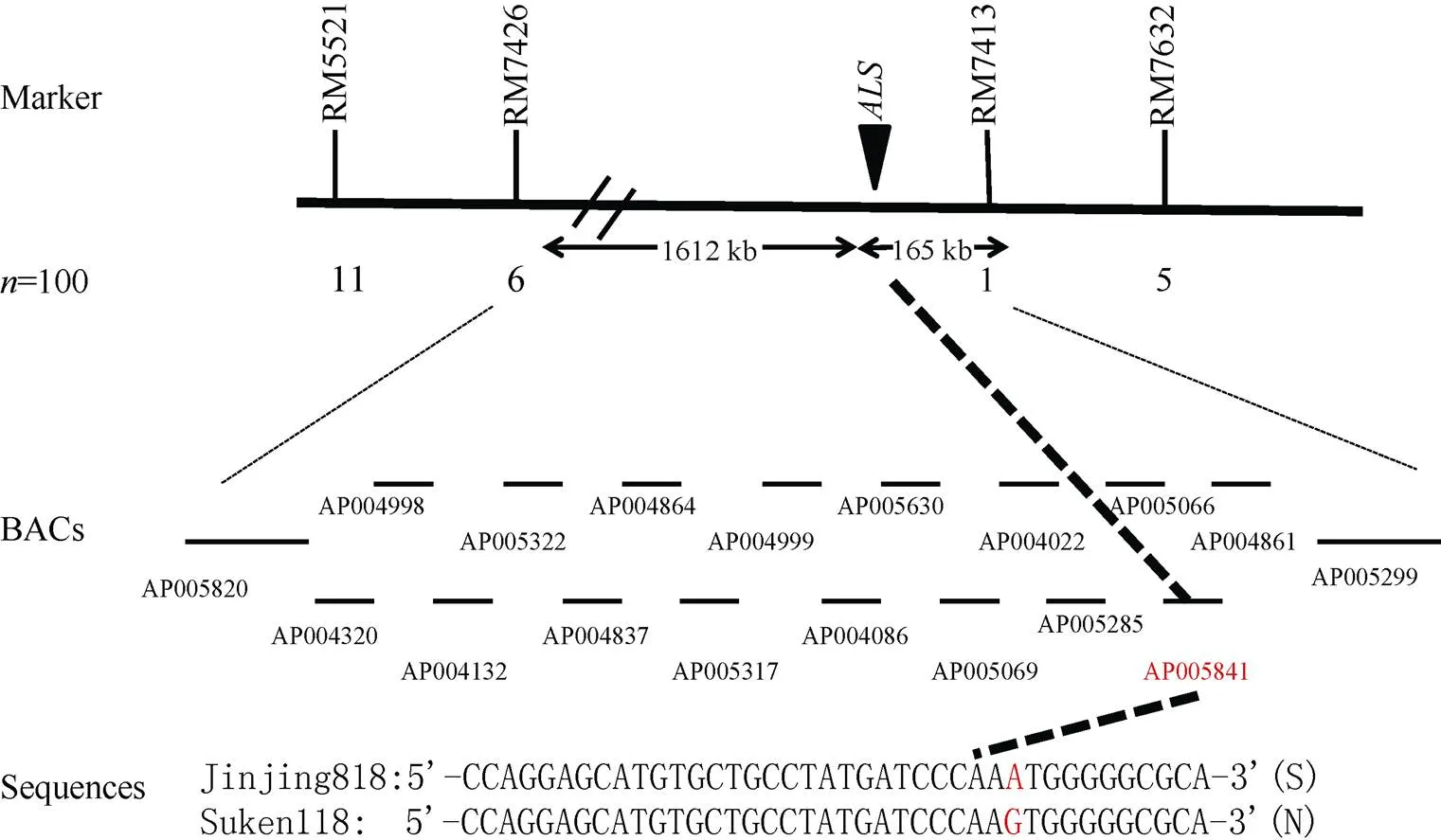
图4 抗咪草烟基因的标记连锁图

图5 SSR标记RM7413在F7的随机10个个体中的基因型
1: 抗性对照金粳818的基因型; 2: 敏感对照南粳9108的基因型; M: DNA marker; 3~12: 10个随机个体的基因型。
1: the genotype of Jinjing 818; 2: the genotype of Nanjing 9108; M: DNA marker; 3-12: the genotype of ten seedlings.

图6 SSR标记RM7413在常规粳稻中的基因型(部分图)
1: 抗性对照金粳818的基因型; 2: 敏感对照苏垦118的基因型; M: DNA marker; 其余为常规粳稻的基因型。
1: the genotype of Jinjing 818; 2: the genotype of Suken 118; M: DNA marker; others are the genotype of conventionalrice.
4 结论
金粳818抗咪草烟特性是由单基因控制的显性性状, 初步确定乙酰乳酸合酶基因()的突变是金粳818产生抗性的主要原因。筛选获得的SSR分子标记RM7413与抗性基因紧密连锁, 该标记与金粳818在抗咪草烟粳稻新品种的选育中应用潜力巨大。
[1] Camargo E R, Senseman S A, Mccauley G N, Guice J B. Rice (L.) response and weed control from tank-mix applications of saflufenacil and imazethapyr., 2012, 31: 94–98
[2] Norsworthy J K, Scott R C, Bangarwa S K, Griffith G M, Wilson M J, Mccelland M. Weed management in a furrow-irrigated imidazolinone-resistant hybrid rice production system., 2011, 25: 25–29
[3] Kumar V, Bellinder R R, Gupta R K, Malik R K, Brainard D C. Role of herbicide-resistant rice in promoting resource conservation technologies in rice–wheat cropping systems of India: a review., 2008, 27: 290–301
[4] 苏少泉. 抗除草剂水稻品种的创制与发展. 农药研究与应用, 2010, (5): 6–8Su S Q. The herbicide-resistant rice varieties expected and development., 2010, (5): 6–8 (in Chinese with English abstract)
[5] Tan S, Dahmer M L, Singh B K, Shaner D L. Imidazolinone-tolerant crops: history, current status and future., 2010, 61: 246–257
[6] Kawai K, Kaku K, Izawa N, Shimizu T, Fukuda A, Tanaka Y. A novel mutant acetolactate synthase gene from rice cells, which confers resistance to ALS-inhibiting herbicides., 2007, 32: 89–98
[7] Masson J A, Webster E P. Use of imazethapyr in water-seeded imidazolinone-tolerant rice (L.)., 2001, 15: 103–106
[8] 肖国樱, 陈芬, 孟秋成, 周浩, 李锦江, 于江辉, 邓力华, 翁绿水. 我国转基因抗除草剂水稻的生态风险与控制. 农业生物技术学报, 2015, 23: 1–11Xiao G Y, Chen F, Meng Q C, Zhou H, Li J J, Yu J H, Deng L H, Weng L S.Ecological risk and management of herbicide-resistant transgenic rice (L.) in China., 2015, 23: 1–11(in Chinese with English abstract)
[9] 李余生, 陈涛, 虞秋成, 黄宝才, 王才林. 水稻抗条纹叶枯病基因连锁分子标记的鉴定及利用. 江苏农业学报, 2009, 25: 459–463Li Y S, Chen T, Yu Q C, Huang B C, Wang C L.Identification and application of SSR markers linked to resistant geneStv-bfor, 2009, 25: 459–463 (in Chinese with English abstract)
[10] 胡茂龙, 龙卫华, 高建芹, 付三雄, 陈锋, 周晓婴, 彭琦, 张维, 浦惠明, 戚存扣. 油菜抗咪唑啉酮类除草剂基因等位基因特异PCR标记的开发与应用. 作物学报, 2013, 39: 1711–1719Hu M L, Long W H, Gao J Q, Fu S X, Chen F, Zhou X Y, Peng Q, Zhang W, Pu H M, Qi C K.Development and application of allele-specific PCR markers for imidazolinone-resistant genein., 2013, 39: 1711–1719 (in Chinese with English abstract)
[11] 李志江, 李延东, 马金丰, 李祥羽, 赵丽娟, 王绍滨. 谷子抗“拿捕净”基因的SSR标记. 黑龙江农业科学, 2013, (7): 5–7Li Z J, Li Y D, Ma J F, Li X Y, Zhao L J, Wang S B.SSR marker for “Napujing”-resistant gene in., 2013, (7): 5–7 (in Chinese)
[12] Bulos M, Sala C A, Altieri E, Ramos M L. Marker assisted selection for herbicide resistance in sunflower., 2013, 36(59): 1–16
[13] Mithila J, McLean M D, Chen S, Christopher H J. Development of near-isogenic lines and identification of markers linked to auxinic herbicide resistance in wild mustard (L.)., 2012, 68: 548–556
[14] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations., 1991, 88: 9828–9832
[15] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4325
[16] Luo Z, Yang Z, Zhong B, Li Y, Xie R, Zhao F, Ling Y, He G. Genetic analysis and fine mapping of a dynamic rolled leaf gene,, in rice (L.)., 2007, 50: 811–817
[17] Givens W A, Shaw D R, Newman M E, Weller S C, Young B G, Wilson R G, Owen M D, Jordan D L. Benchmark study on glyphosate-resistant cropping systems in the United States., 2011, 67: 758–770
[18] 王军, 宫丹妮, 范方军, 朱金燕, 李文奇, 王芳权, 仲维功, 杨杰. 不同类型江苏粳稻主推品种的遗传多样性分析. 中国农学通报, 2016, 32(36): 24–30Wang J, Gong D N, Fan F J, Zhu J Y, Li W Q, Wang F Q, Zhong W G, Yang J. Genetic diversity analysis of majorcultivars of different ecotypes in Jiangsu., 2016, 32(36): 24–30 (in Chinese with English abstract)
[19] 周振玲, 王宝祥, 樊继伟, 卢百关, 赵志刚, 江玲, 秦德荣, 万建民, 徐大勇. 江淮稻区不同生态型粳稻品种的籼粳分化度和遗传多样性. 中国水稻科学, 2012, 26: 431–437Zhou Z L, Wang B X, Fan J W, Lu B G, Zhao Z G, Jiang L, Qin D R, Wan J M, Xu D Y.-differentiation degree and genetic diversity ofcultivars belongs to different ecotypes from the Yangtza-Huaihe region., 2012, 26: 431–437 (in Chinese with English abstract)
[20] Wang C H, Zheng X M, Xu Q, Yuan X P, Huang L, Zhou H F, Wei X H, Ge S. Genetic diversity and classification ofwith emphasis on Chinese rice germplasm., 2014, 112: 489–496
[21] 程芳艳, 李春光, 刘永巍, 孙翊轩, 王继亮, 孟昭河, 徐正进. 寒地部分粳稻的遗传多样性及遗传结构分析. 沈阳农业大学学报, 2014, 45: 649–654Cheng F Y, Li C G, Liu Y W, Sun Y X, Wang J L, Meng Z H, Xu Z J. Analysis of genetic diversity and genetic structure about rice materials from cold region., 2014, 45: 649–654 (in Chinese with English abstract)
[22] 甘晓燕, 李苗, 关雅静, 陈晓军, 宋玉霞. 宁夏89份粳稻种质遗传多样性的SSR分析. 西北植物学报, 2009, 29: 1772–1778Gan X Y, Li M, Guan Y J, Chen X J, Song Y X. Genetic diversity of 89rice varieties in Ningxia province by using SSR., 2009, 29: 1772–1778 (in Chinese with English abstract)
[23] Becerra V, Paredes M, Ferreira M E, Gutiérrez E, Díaz L M. Assessment of the genetic diversity and population structure in temperaterice germplasm used in breeding in Chile, with SSR markers., 2017, 77: 15–26
[24] Beckie H J, Hall L M. Genetically-modified herbicide-resistant (GMHR) crops a two-edged sword? An Americas perspective on development and effect on weed management., 2014, 66: 40–45
Genetic Analysis of Imazethapyr Resistance in Rice and the Closely Linked Marker Selection and Application
FEI Yun-Yan1, YANG Jie1,2,*, FAN Fang-Jun1,2, WANG Fang-Quan1,2, LI Wen-Qi1,2, WANG Jun1,2, ZHU Jin-Yan1,2, and ZHONG Wei-Gong1,2
1Institute of Food Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China;2Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops / Yangzhou University, Yangzhou 225009, Jiangsu, China
Cultivation and extension of herbicide-resistant rice can increase the efficiency of weed control and obtain great economic benefits. Here, Jinjing 818 was identified as an imazethapyr-resistant line, F2population from the cross between Jinjing 818 and the conventionalrice Suken 118 was used for genetic analysis and gene mapping of the imazethapyr resistance in rice. The imazethapyr resistance in Jinjing 818 was controlled by a single dominant nuclear gene located between SSR markers RM7413 and RM7426 on the chromosome 2. Through gene-predicting and sequencing in this region, we found that the target gene of imazethapyr, acetolactate synthase gene (), had a nucleotide mutation (G mutated into A) in its coding region, leading to the mutation of serine into asparagine. It could be preliminarily deduced thatis the candidate gene for imazethapyr resistance. The physical distances between RM7413, RM7426 andwere 165 kb, 1612 kb, respectively. Jinjing 818 and Nanjing 9108 were used as parents to detect the application potential of RM7413 in molecular marker assisted selection breeding (MAS). On the basis of selecting phenotype and RM7413 in the hybrid and its selfing generation, F7population showed stable imazethapyr resistance, indicating that the great application potential of RM7413 in MAS and breeding for imazethapyr resistant rice. Our results will lay a foundation for breeding herbicide-resistantrice by MAS.
subsp. Keng; Molecular marker assisted selection; RM7413; Jinjing 818; Imazethapyr
2017-07-06;
2018-01-08;
2018-01-23.
10.3724/SP.J.1006.2018.00716
本项目由国家重点研发计划项目(2017YFD0100403), 江苏省现代农业重点研发项目(BE2015355), 江苏省农业科学院探索性项目(ZX(17)2014)和江苏省自然科学基金项目(BK20171326)资助。
This study was supported by the National Key Research and Development Program (2017YFD0100403), the Jiangsu Province Key Research and Development Program (Modern Agriculture) (BE2015355), the Exploratory Project of the Jiangsu Academy of Agricultural Sciences (ZX(17)2014), and the Project of Jiangsu Province Natural Science Foundation (BK20171326).
杨杰, E-mail: yangjie168@aliyun.com
E-mail: suiyiyixinyisi@163.com
http://kns.cnki.net/kcms/detail/11.1809.S.20180122.1429.034.html
