超微粉碎提高薇菜粉活性成分的生物利用率
2018-05-11符群李卉王振宇王路
符群,李卉,王振宇,王路
(1.东北林业大学林学院,黑龙江哈尔滨 150040)(2.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨 150090)
薇菜,学名紫萁(Osmunda japonica Thunb.),民间俗称野鸡头、大巢菜、扫帚菜,古时名为“巢菜”或“野豌豆”。紫萁科(Osmundaceae)紫萁属(Osmunda)多年生真蕨类植物。薇菜味苦性凉并富含多种蛋白质、氨基酸、维生素及微量元素[1],薇菜整株均可食,具有抗菌、凝血、消炎退热[2]、抗氧化、增进人体免疫力、抗癌防癌及延缓衰老的作用,其中促进细胞修复等功效明显[3]。
超微粉碎,是指利用机械或流体动力的方法克服固体内部凝聚力使之破碎,从而将3 mm以上的物料颗粒粉碎至10~25 μm的操作技术,分为干法粉碎和湿法粉碎,干法粉碎有气流式、高频率震动式、旋转球(棒)磨式、锤击式和自磨式等几种形式,湿法主要是用胶体磨和均质机粉碎[4]。超微粉碎具有速度快、时间短、粒径细、分布均匀、节省原料、提高生物利用率的优点。本试验选择干法粉碎中的球磨法及湿法粉碎中高压均质法对薇菜粉体原料进行处理,考察不同超微粉碎方法对薇菜粉体的影响。
胃肠道消化是很多营养物质吸收的重要部分之一,胃内有特殊的酸性环境,对少部分呈弱酸性的成分有很好的吸收作用。黄酮、多酚均具有弱酸性。某些黄酮类物质可以在胃部直接吸收,如:槲皮素[5]、大豆素和染料木素等[6]而多酚中的花色苷[7]也可以在胃部快速吸收,且黄酮苷元和多酚具有疏水性,可以通过被动扩散透过生物膜而被吸收[8]。近年一些研究发现通对食品的特定处理能显著改善活性成分在人体肠胃中的生物利用率[9]。通过体外模拟胃肠道消化可有效观察超微粉碎对薇菜营养物质的释放量和生物利用率的影响,为薇菜产品的加工提供试验依据。
1 材料与方法
1.1 材料与试剂
薇菜,吉林长白山。
MD34MM透析袋,美国Viskase;胃蛋白酶、胰蛋白酶,上海源叶生物科技有限公司;牛黄胆酸盐,上海金穗生物科技有限公司;Folin-酚试剂,上海蓝季科技发展有限公司;无水乙醇、Al(NO3)3、NaNO2、NaOH、Na2CO3均为分析纯,天津市致远化学试剂有限公司。
1.2 仪器与设备
JMF-80型胶体磨,温州市胶体磨厂;SRH60-70型高压均质机,上海申鹿均质机有限公司;ND7-2L行星球磨机,南京南大天尊电子有限公司;FW100高速万能粉碎机,天津泰斯特仪器公司;BILON-6000Y型喷雾干燥机,上海比朗仪器有限公司。
1.3 方法
1.3.1 薇菜粉体的常规碎处理
薇菜原料置于 60 ℃烘箱中烘干至残余水分低于3%。以间歇式高速粉碎机粉碎至60目,样品袋封闭于干燥器中放置备用。
1.3.2 薇菜超微粉碎处理
1.3.2.1 行星球磨法制备超微粉碎工艺
参照杨宏志[10]等人的方法并稍加修改,在玛瑙罐中装入处理好的常规粉碎薇菜样品10 g和直径9 mm刚玉材质小球100 g,球料质量比为10:1(g/g),转速为270 r/min。粉碎时间分别为7 h,所得薇菜粉末过200目筛,至于干燥器中备用。
1.3.2.2 高压均质法制备超微粉碎工艺
胶体磨预处理:准确称取16 g常规粉碎处理后的薇菜粉并加入去离子水搅拌,料液浓度为 2%,通过胶体磨预处理(10 min)。
将预处理后的原料,加入高压均质机中,在均质压力为25 MPa,进料温度为60 ℃的条件下均质15 min后进行喷雾干燥[11]。高压喷雾干燥进料速度为12.5 mL/min,进口温度为190 ℃,出口温度为80 ℃。所得粉末过200目筛,至于干燥器中备用。
1.3.3 薇菜总黄酮、总多酚的体外消化
1.3.3.1 体外模拟胃肠道消化
参照李俶的方法[12]并稍作修改取3个100 mL锥形瓶依次加入9 mg/mL NaCL溶液25 mL、0.1 mol/L盐酸溶液4 mL、4 mg/mL胃蛋白酶溶液4 mL(缓冲溶液:0.1 mol/L盐酸)混匀,测定溶液pH在2.0~2.5之间,分别在三个锥形瓶中加入行星球磨薇菜超微粉、高压均质薇菜超微粉和常规粉碎薇菜粉各 1 g,于37 ℃,100 r/min水浴震荡1 h。此过程模拟胃部消化,所得消化液留部分冷藏备用,其余参与下一步肠道消化。
1.3.3.2 体外模拟肠液消化
透析袋预处理:新袋在蒸馏水中沸水浴 5 min,冷却,浸泡在50%乙醇溶液中备用[13]。
使用前用生理盐水反复冲洗透析袋,清洗好后在透析袋中加入 9 mg/mL NaCL 8 mL,0.5 mol/L NaHCO32 mL,两端系紧,置于消化胃液中,于37 ℃,100 r/min恒温水浴45 min,此过程模拟胃部食物从胃部向肠道内转移的过渡阶段。
经处理后,锥形瓶中pH约在6.5~7.0范围内,在锥形瓶中加入 18 mL胰胆酶混合液(按照胰酶 0.2 mg/mL、胆汁酶1.2 mg/mL比例混合,缓冲溶液:0.1 mol/L碳酸氢钠),于37 ℃,100 r/min水浴震荡3 h,将透析袋内和锥形瓶内液体分别冷藏,待测。
1.3.4 薇菜活性成分的生物利用率
生物利用率是指食物中的活性成分被人吸收利用的量占其在食物中的百分比[14]。采用超微粉碎方法来处理食品原料,有利于营养物质在消化道的溶解、代谢和吸收。黄酮、多酚类物质通过肠胃吸收进入血液与其他组织器官再转运至肝脏进行分解代谢。通过公式(1)计算薇菜总黄酮、总多酚的生物利用率。
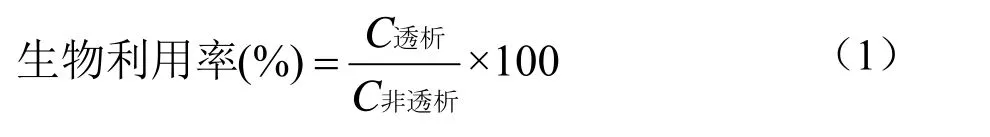
式中:C透析表示该成分在透析袋中的含量(mg/g);C非透析表示该成分在肠道内的总含量(mg/g)。
1.3.5 总黄酮释放量的测定
标准曲线的绘制:将芦丁标准品干燥至恒重后,准确称取0.0140 g定容于50 mL容量瓶中,得浓度0.28 mg/mL的芦丁标准溶液[15]。准确吸取芦丁标准溶液0.0、0.2、0.3、0.4、0.5、0.6 mL于25 mL容量瓶中,加入5% NaNO2溶液0.75 mL,摇匀,放置6 min再加入10%的Al(NO3)3溶液0.75 mL,摇匀,放置6 min后再加入4% NaOH溶液10 mL,蒸馏水定容,摇匀,静置10~15 min后于510 nm处测定吸光度A,以芦丁浓度X(mg/mL)对吸光度Y进行线性回归,得回归方程y=0.4367x-0.0006,R2=0.9996。
总黄酮释放量的测定:取样品1 mL按照上述方法进行测定,于510 nm处测定吸光度,并根据回归方程,按照公式(2)计算薇菜总黄酮释放量(以芦丁当量计)。
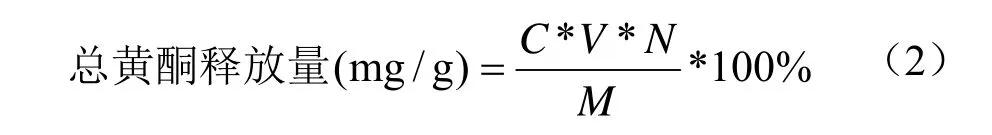
式中:C表示测定液总黄酮含量(mg/mL);N表示稀释倍数;V表示为样品体积(mL);M表示样品质量(g)。
1.3.6 总多酚释放量的测定
标准曲线的绘制:精确称取0.100 g干燥的没食子酸用蒸馏水溶解并定容于100 mL容量瓶中,配置成1000 μg/mL的没食子酸标准储备液;同时分别移取等体积的1.0 mL~7.0 mL的没食子酸标准溶液于100 mL容量瓶中并定容,配置成浓度分别为10、20、30、40、50、60、70 μg/mL的工作液。在10 mL棕色容量瓶中分别移取不同浓度的工作液1 mL,各加入10%福林酚试剂5 mL后充分振荡摇匀,反应5 min后加入7.5%的碳酸钠溶液4 mL并通过蒸馏水定容;置于25 ℃恒温水浴条件下反应 1 h,以蒸馏水为空白对照于 765 mm波长下测定混合体系吸光值[16]。以吸光度为纵坐标 y,没食子酸浓度(μg/ml)为横坐标 x,得到多酚浓度与吸光度的线性回归方程:y=0.0045x+0.004,R2=0.9987。
总多酚释放量的测定:取样品1 mL按照上述方法进行测定,于765 nm处测定吸光度,并根据回归方程,按照公式(3)计算薇菜总多酚释放量(以没食子酸当量计)。
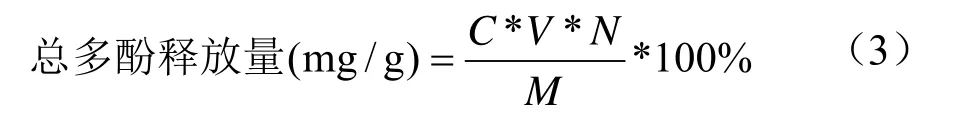
式中:C表示测定液总多酚含量(mg/mL);N表示稀释倍数;V表示为样品体积(mL);M表示样品质量(g)。
1.3.7 可溶性蛋白释放量的测定
标准曲线的测定[17]:考马斯亮蓝G-250溶液(称取100 mg考马斯亮蓝G-250,溶于50 mL 95%乙醇溶液中,加入85%磷酸100 mL,用蒸馏水定容于1 L棕色容量瓶中,呈棕红色),备用。精密称取牛血清白蛋白14.2 mg,定容于100 mL容量瓶,制得142 μg/mL蛋白质标准溶液,取7支10 mL具塞试管,分别精密吸取0.0、0.1、0.2、0.4、0.6、0.8、1.0 mL标准蛋白溶液于试管中,各管补加蒸馏水至1 mL,加入考马斯亮蓝G-250溶液5 mL,混匀,室温放置5 min后在595 nm 处测定溶液吸光度,以蛋白质质量 X(μg)对吸光度Y进行线性回归,得回归方程y=0.0082+0.0054x,R2=0.9998。
样品中可溶性蛋白含量测定:称取三种处理方式的薇菜粉体各40 mg按上述1.3.3方法进行体外消化。取供试样品溶液1 mL,按照1.3.7.1方法进行测定,于595 nm处测定吸光度,按照公式(4)计算薇菜样品中可溶性蛋白的含量。
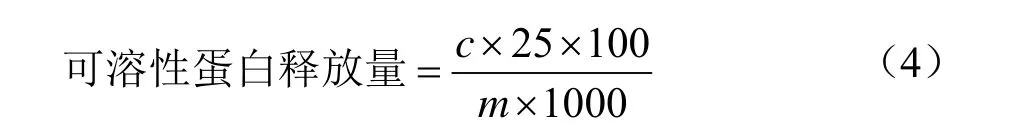
式中:c表示测得的样品溶液的可溶性蛋白质量(μg);m表示样品质量(mg)。
1.3.8 可溶性多糖释放量的测定
标准曲线的测定[18]:准确称取干燥恒重的葡萄糖标品0.5 g,用蒸馏水定容至500 mL,得到1 g/L的葡萄糖标准溶液。准确吸取葡萄糖标准溶液 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL于试管中,补加蒸馏水至3 mL,加入5%苯酚溶液1 mL,后迅速加入5 mL浓硫酸,摇匀,静置20 min后于490 nm处测定吸光值,以吸光度为纵坐标y,葡萄糖浓度(mg/mL)为横坐标 x,得到葡萄糖浓度与吸光度的线性回归方程:y=0.0233+2.5679x,R2=0.9969。
薇菜待测样品溶液制备:称取三种处理方式的薇菜粉体各1 g按上述1.3.3方法进行体外消化。取供试样品1 mL样液于试管中,加入4 mL蒸馏水,按照公式(5)中方法于490 nm处测定溶液吸光度,计算供试样品中可溶性多糖的含量。
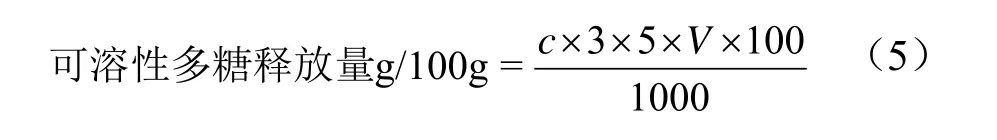
式中:c表示测得的样品溶液的葡萄糖质量浓度(mg/mL);V表示供试液体积(mL)。
1.4 超微粉碎处理对薇菜粉体物理性质影响
1.4.1 薇菜粉体平均粒径测定
采用扫描电子显微镜观察法,通过显微镜放大后的图案观察粉粒形态变化,并将显微镜放大后的颗粒图案通过摄像头及图形采集卡传输计算机中,由计算机对图像进行边缘识别处理,计算每个颗粒的投影面积。统计出设定粒径区间的颗粒数量,得到粒度分布情况[19]。
1.4.2 薇菜粉体流动性的测定
采用休止角法,实验将3 g样品经玻璃漏斗垂直流至玻璃平板上,漏斗尾端距玻璃平板垂直距离 3 cm,流下的样品在玻璃平板上形成圆锥体,测定圆锥表面和水平面的夹角即为样品休止角[19]。
1.4.3 薇菜粉体膨胀力的测定
准确称取1.00 g样品,放入带刻度的玻璃试管中记录体积Vl,加入10 mL蒸馏水,搅拌均匀后,在室温下静止24 h,读出样品此时的体积数为V2[20]。
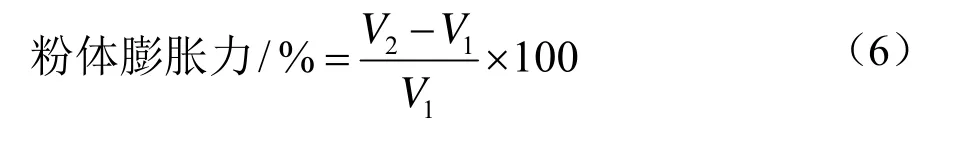
1.5 数据处理
所有实验结果均平行测定3次,采用Origin 8.6绘制柱状图,SPSS 17.0进行数据整理及Duncans’差异显著性分析,p<0.05为显著。
2 结果与分析
2.1 微粉碎处理对粉体物性的影响
2.1.1 粉体平均粒径
通过表1可以看出2种超微粉碎方法粉碎后的粉体粒径与常规粉碎粉体粒径差距极其显著(p<0.01),普通粉碎方法的粉体粒径分别是行星球磨法和高均质法的47.77倍和60.92倍。说明超微粉碎机通过机械力和流体动力等物理作用,打破了粉体内部分子的凝聚力使薇菜粉体达到破壁级别的粉碎。

表1 超微粉碎方法对粉体平均粒径的影响Table 1 Effects of three treatment methods on the average particle size of powders
2.1.2 粉体休止角
由表2可看出,通过超微粉碎处理的薇菜样品与常规粉碎处理的粉体休止角差异显著(p<0.05)经过粉碎处理的超微粉休止角比起初筛粉都有所增加,此结果与陈光静在冬桑叶超微粉制备[21]中的研究结果相似。由于超微粉碎后,粉粒的粒径变小,比表面积增大,孔隙度增加。这使得粉粒表面的聚合力增大,颗粒之间的摩擦力增加,导致其休止角增大。因此,超微处理后的超微粉在流动性上稍有欠缺,但可以通过工艺的优化以及造粒技术等进行改善。
2.1.3 粉体膨胀力
准确称取1.00 g样品,放入带刻度的玻璃试管中记录体积Vl,加入10 mL蒸馏水,搅拌均匀后,在室温下静止 24 h,读出样品此时的体积数为V2。按照“1.4.4”中所述公式进行计算,所得结果见表3。
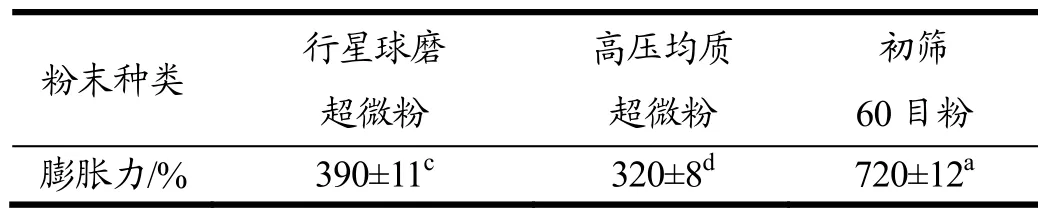
表3 超微粉碎方法对粉体膨胀力的影响Table 3 Effects of three treatment methods on powder expansion
由表3可看出,经超微粉制备后薇菜粉体膨胀力下降。这是由于薇菜原料中的纤维成分较多,粉碎前,较多水分被大量纤维束缚,经超微粉碎后,纤维的长链大幅度减少而短链增多,导致粉末对水分的束缚力降低,膨胀力减小[22]。高压均质法制备的超微粉膨胀力显著低于行星球磨法(p<0.05),这是由于喷雾时粉粒的团聚作用使其呈球形分布,短链纤维也随之减少,从而膨胀力减小。
2.2 超微粉碎法对薇菜活性成分的影响
2.2.1 薇菜总黄酮、总多酚释放量
胃肠道是黄酮类物质重要的分解代谢场所之一,在植物中黄酮大多与糖结合,以黄酮苷的形式存在,少部分以游离状态存在本试验通过几种蛋白酶的分解和pH的调节,并不能让黄酮类物质完全分解并释放,但是,通过简易模拟也可以直观的看出超微粉碎方法可以显著增加薇菜黄酮的释放量。由图1可知,将两种超微粉碎方法处理后的原料粉按照 1.3.3的方法进行体外模拟胃肠道消化。结果表明:以常规粉碎方法为对照,通过行星球磨法、高压均质法消化后经胃肠液消化薇菜总黄酮释放量分别增加了 9.47 mg/g和8.24 mg/g,总多酚释放量分别增加3.07 mg/g和3.23 mg/g。
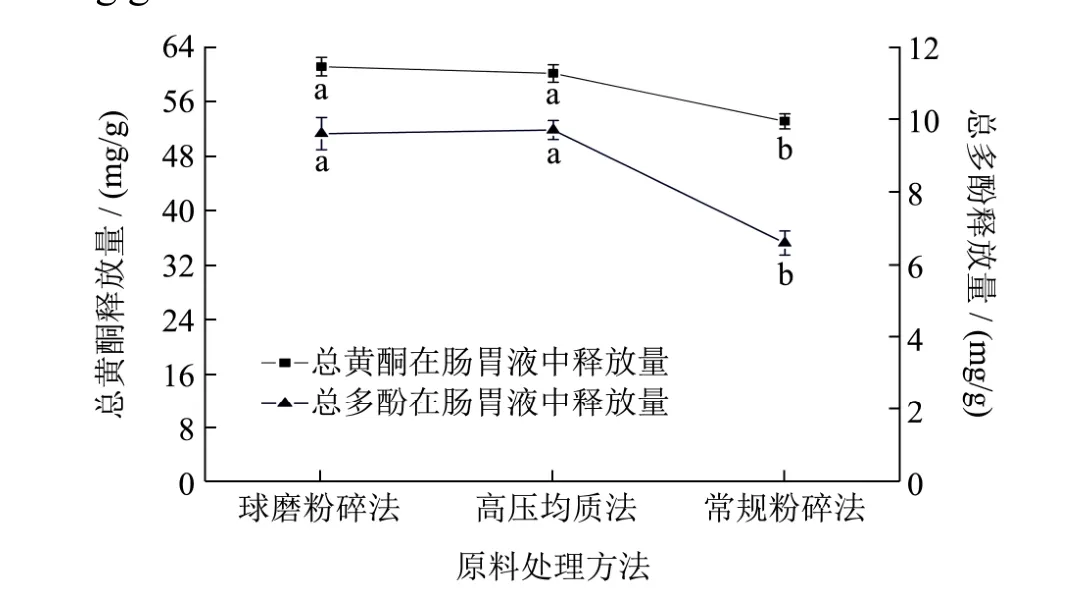
图1 薇菜超微粉总黄酮、总多酚释放量Fig.1 Total flavonoids andTotal polyphenols release from Osmunda japonica Thunb
2.2.2 薇菜总黄酮、总多酚的生物利用率
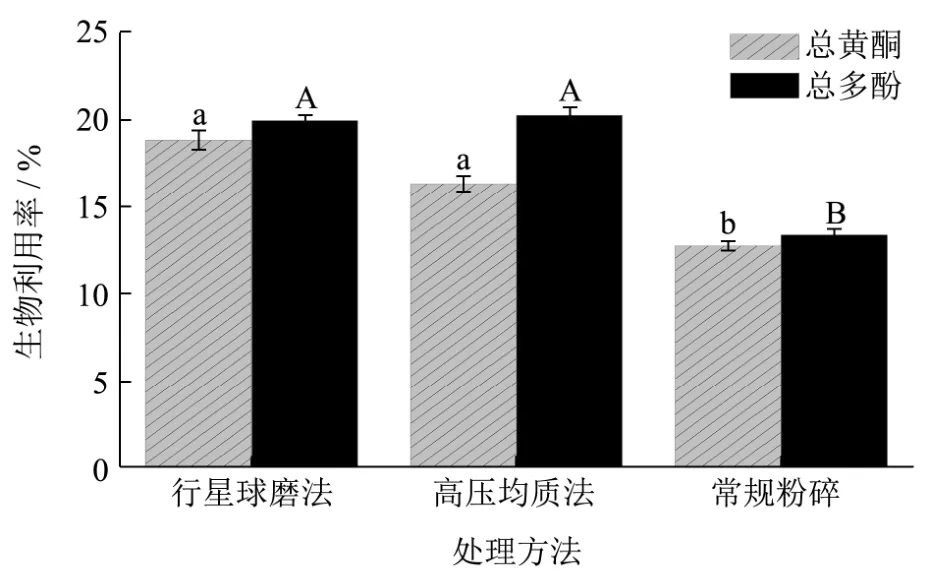
图2 薇菜总黄酮总多酚的生物利用率Fig.2 Bioavailability of total polyphenols and total flavonoids of Osmunda japonica Thunb
通过图2可知,通过构建一个简单的动力学模型利用透析袋模拟体内胃肠道消化吸收,研究超微粉碎对薇菜营养成分吸收利用的影响[23]。行星球磨法、高压均质法和常规粉碎后粉体的对总黄酮类物质的生物利用率分别为18.83%、16.32%和12.74%,相比常规粉碎方法,行星球磨法和高压均质法的总黄酮生物利用率分别提高了 6.09%和3.58%;行星球磨法、高压均质法和常规粉碎后的对总多酚类物质的生物利用率分别为19.93%、20.24%、13.52%,相比普通粉碎法,行星球磨法和高压均质法的总多酚生物利用率分别提高了6.41%、6.72%。通过SPSS进行显著性分析,所得结果表明:两种超微粉碎方法的总黄酮和总多酚生物利用率相比常规薇菜粉均有显著(p<0.05)提升。
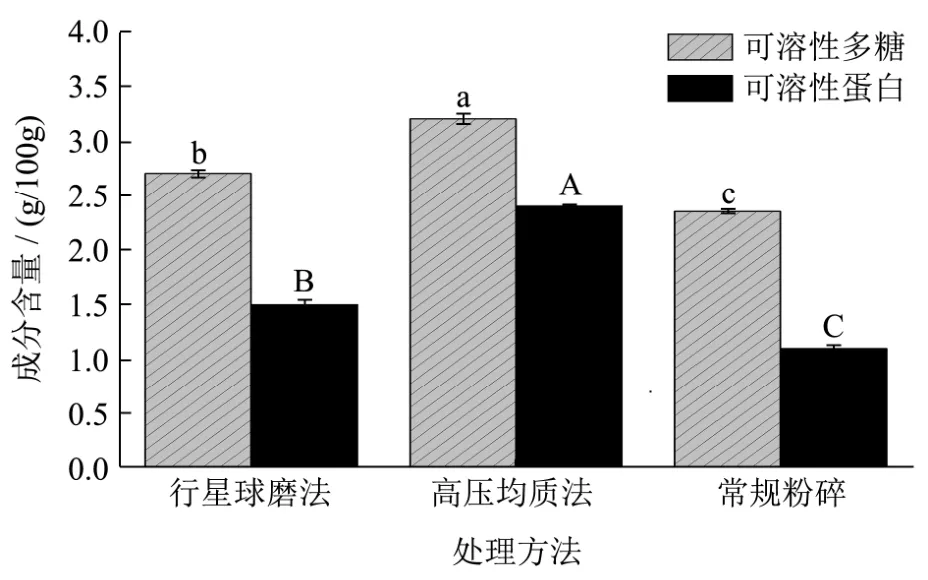
图3 薇菜可溶性成分含量测定Fig.3 Determination of soluble components of Osmunda japonica Thunb
2.2.3 薇菜可溶性成分含量测定通过图3可知通过两种超微粉碎方法处理后可溶性蛋白、可溶性多糖较常规粉碎后的样品释放量均有提升,薇菜经行星球磨法、高压均质法和常规粉碎处理后可溶性多糖分别为:2.73 g/100 mg、3.21 g/100 mg、2.35 g/100 mg;可溶性蛋白1.55 g/100 mg、2.47 g/100 mg、1.13 g/100 mg。相比常规粉碎,行星球磨法可溶性多糖和可溶性蛋白分别提高了 0.38 g/100 mg、0.42 g/100 mg;高压均质法提高了0.86 g/100 mg、1.34 g/100 mg。
3 结论
3.1 本实验通过模拟体外肠道消化,测定薇菜总黄酮总多酚的释放量、生物利用率及可溶性成分含量,并对超微粉碎后的物体物性进行比较分析,考察超微粉碎对薇菜营养物质吸收利用的作用。结果表明:以常规粉碎(60目)为对照,行星球磨法和高压均质法粉碎后薇菜总黄酮的生物利用率分别提高了 6.09%、3.58%;总多酚的生物利用率分别提高了 6.41%和6.72%;总黄酮释放量分别增加:16.47%、12.24%;总多酚释放量分别增加:50.07%,50.08%。可溶性多糖提取量分别提高了16.17%、36.60%;可溶性蛋白分别提高:37.17%、118.58%。
3.2 初筛(60目)的薇菜粉体粒径分别是行星球磨法和高压均质法粉碎后的47.77倍和60.92倍,粉体粒径变小,比表面积增加,粉体膨胀力显著(p<0.05)降低,说明粉体内部纤维被破坏,长链纤维减少短链增多,有利于活性成分溶出。
3.3 综合分析发现,通过超微粉碎处理后薇菜粉体活性成分更有理由人体消化吸收,且超微粉碎是常温物理生产工艺,通过此法破壁不仅有效提高提取量,而且无化学成分残留,有利于食品加工安全,可为薇菜或其他原料粉体功能性成分加工提供试验参考依据。
[1]黄祥丰,李道新,徐慎东,等.彭红林.我国森林薇菜研究进展[J].林业科技通讯,2015,10:75-77 HUANG Xiang-feng, LI Dao-xin, XU Shen-dong, et al.Research progress of forestOsmunda japonica Thunbin China [J]. Journal of Forestry Science and Technology, 2015,10: 75-77
[3]赵莉,杨文钰.蕨类植物的活性成分研究进展[J].中药材,2004,27(6):452-456 ZHAO Li, YANG Wen-yu. Research progress on the active components of pteridophytes [J]. Chinese Herbal Medicines,2004, 27(6): 452-456
[4]蓝海军,刘成梅,涂宗财,等.大豆膳食纤维的湿法超微粉碎与干法超微粉碎比较研究[J].食品科学,2007,28(6):171-174 LAN Hai-jun, LIU Cheng-mei, TU Zong-cai, et al.Comparative study on wet and ultrafine crushing of soybean dietary fiber [J]. Food Science, 2007 28(6): 171-174
[5]Crespy V, Morand C, Besson C, et al. Quercetin, but not its gly-cosides, is absorbed from the rat stomach [J]. Journal of Agricultural & Food Chemistry, 2002, 50(3): 618-621
[6]Piskula M K, Yamakoshi J, Iwai Y. Daidzein and genistein but not their glucosides are absorbed from the rat stomach [J].Febs Letters, 1999, 447(2-3): 287-291
[7]S Passamonti, U Vrhovsek, A Vanzo, et al. The stomach as A site for anthocyanins absorption from food [J]. Febs Letters,2003, 554(1-3): 210-213
[8]TM Liu, XH Jiang. Studies on the absorption kinetics of baicalin and baicalein in rats' stomachs and intestines [J].China Journal of Chinese Materia Medica, 2006, 31(12): 999
[9]雷菲,高彦祥,侯占群.体外消化过程中影响类胡萝卜素生物利用率的因素[J].食品科学,2012,33(21):368-373 LEI Fei, GAO Yan-xiang, HOU Zhan-qun. Factors influencing the bioavailability of carotenoids duringin vitrodigestion [J]. Food Science, 2012, 33(21): 368-373
[10]杨宏志,刘凤亮.球磨法微细化马铃薯淀粉工艺优化[J].食品安全质量检测学报,2014,7(5):2048-2053 YANG Hong-zhi, LIU Feng-liang. Micronization of potato starch by ball milling process optimization [J]. Journal of Food Safety and Quality Inspection, 2014, 7(5): 2048-2053
[11]胡婷婷,乐园,赵宏,等.高压均质技术结合喷雾干燥法制备布地奈德多孔微球[J].北京化工大学学报(自然科学版),2009,36(2):9-13 HU tingting, LE Yuan, ZHAO Hong, et al. High pressure homogenization technology combined with spray drying method to prepare budesonide porous microspheres [J].Journal of Beijing university of chemical technology (natural science edition),2009, 4 (2) : 9-13
[12]李俶,翟宇鑫,陈军,等.南酸枣皮中酚类化合物体外模拟消化与溶剂提取的比较研究[J].食品科学,2015,36(9):12-16 LI Chu, ZHAI Yu-xin, CHEN Jun, et al. Comparative study on the simulated digestion and solvent extraction of phenolic compounds in Chinese jujube skin [J]. Food science,2015,36(9):12-16.
[13]Fawole Olaniyi Amos, Opara Umezuruike Linus. Stability of total phenolic concentration and antioxidant capacity of extracts from pomegranate co-products subjected toin vitrodigestion [J]. Bmc Complementary & Alternative Medicine,2016, 16(1): 358
[14]Seung-Jae Lee, Seung Yuan Lee, Sun Jin Hur. Development of novelin vitrohuman digestion systems for screening the bioavailability and digestibility of foods [J]. Journal of Functional Foods, 2016, 22: 113-121
[15]萨茹丽,木其尔,王翠芳,等.沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用[J].食品科学,2014,35(24):1-8 SA Ru-li, MU Qi-er, WANG Cui-fang, et al. Total flavonoids from allium mongolicum regel: optimization of extraction process and antioxidant and antibacterial effectsin vitro[J].Food Science, 2014, 35(24): 1-8
[16]Blagoj Karakashov, Spyros Grigorakis, Sofia Loupassaki, et al. Optimisation of polyphenol extraction from Hypericum perforatum (St. John's Wort) using aqueous glycerol and response surface methodology [J]. Journal of Applied Research on Medicinal & Aromatic Plants, 2015, 2(1): 1-8
[17]杨静,白冰,王宁,等.考马斯亮蓝法对烟草薄片涂布液中蛋白质含量的测定[J].湖北农业科学,2017,5(56):946-950 YANG Jing, BAI Bing, WANG Ning, et al. Coomassie brilliant blue method for determination of protein content in tobacco flake coating solution [J]. Hubei Agricultural Sciences, 2017, 5(56): 946-950
[18]朱加进.苦菜中可溶性多糖的提取[J].农业工程学报,2002,18(1):138-141 ZHU Jia-jin. Extraction of soluble polysaccharides in bitter[J]. Journal of Agricultural Engineering, 2002, 18(1): 138-141
[19]GAO Y J, ZHANG M, CHENG F, et al. Effect of micronization on physieochemical properties of small yellow croaker skull [J]. Advanced Powder Technology, 2013, 24(6):1-7
[20]ZHAO Guowei, Wang Chunliu, Liao Zhenggen, et al.Comparative study of physicochemical properties of dragon’s blood powders [J]. Advanced Materials Research, 2011,311-313: 560-565
[20]陈光静,汪莉莎,张甫生,等.超微粉碎对桑叶粉理化性质的影响(英文)[J].农业工程学报,2015,24(31):307-314 CHEN Guang-jing, WANG Li-sha, ZHANG Fu-sheng, et al.Effect of superfine crushing on physicochemical properties of mulberry leaves [J]. Journal of Agricultural Engineering,2015, 24(31): 307-314
[21]郑慧,王敏,吴丹.超微处理对苦荞麸理化及功能特性影响的研究[J].食品与发酵工业,2006,32(8):5-9 ZHENG Hui, WANG Min, WU Dan. Effect of ultramicro treatment on physical and chemical properties and functional properties of tartary buckwheat [J]. Food and Fermentation Industries, 2006, 32(8): 5-9
[22]Olaniyi Amos Fawole, Umezuruike Linus Opara. Stability of total phenolic concentratio and antioxidant capacity of extracts from pomegranate co-products subjected to in vitro digestion [J]. Bmc Complementary & Alternative Medicine,2016, 16(1): 358
