胸腔温热灌注化疗在晚期胸腺肿瘤胸膜切除术中的应用
2018-05-11戴莉赵青颜美琼刘晓芯王玉吟
戴莉,赵青,颜美琼,刘晓芯,王玉吟
(上海交通大学附属胸科医院 护理部 手术室,上海 200030)
出现胸膜播散的胸腺肿瘤临床上属于局部晚期(Ⅳa期)胸腺肿瘤,其治疗策略目前尚存争议[1-2]。胸膜全肺切除(extra-pleural pneumonectomy,EPP)虽然可以达到手术根治切除,但巨大的手术创伤不仅与围术期并发症发生率及病死率显著相关,还会严重降低患者生活质量[3-4];而单纯切除胸膜转移病灶、保留肺组织的胸膜切除术又很难达到良好的局部控制效果,加之缺乏有效的术后辅助治疗,复发率较高,直接影响患者的生存率[5-7]。为此,我院纵隔外科采用胸膜切除术结合同期胸腔温热灌注化疗的治疗方式,通过手术切除转移病灶、区域温热灌注化疗的综合作用,在降低手术风险的同时最大限度控制术后复发,为局部晚期胸腺肿瘤患者获得长期生存、提高生活质量提供了新方法。2015年2月至2016年4月,我院为11例患者实施了胸腺肿瘤胸膜切除术同期联合胸腔温热灌注化疗,效果满意,现介绍如下。
1 临床资料
1.1 一般资料 选择2015年2月至2016年4月在上海胸科医院行胸膜切除术联合胸腔温热灌注化疗治疗的11例胸膜转移Ⅳa期胸腺肿瘤患者,其中男7例、女4例;年龄35~64岁,平均(49.1±10.3)岁。7例患者为初治,4例为既往胸腺瘤切除后胸膜播散复发;术前2例患者接受序贯放化疗、5例接受诱导化疗。术前病理诊断胸腺鳞癌2例、胸腺瘤9例。11例患者均为单侧胸膜转移。
1.2 方法
1.2.1 手术方法 所有患者在全身麻醉下行双腔气管插管,根据胸腺肿瘤侵犯范围选择手术径路和方式。6例患者先经胸腔镜(video-assisted thoracoscopic surgery,VATS)探查、游离肿瘤并切除可见转移胸膜,包括从胸膜顶到膈胸膜,从前折返处到后折返处,必要时切除被肿瘤侵犯的肺、心包、脂肪组织、无名静脉等,做到肉眼无肿瘤组织残留,翻转体位取后外切口或正中切口开胸进行原发病灶切除。2例仅有胸膜复发患者直接经VATS下切除转移胸膜。3例患者直接后外切口开胸进行纵隔原发病灶及转移胸膜切除。
1.2.2 灌注方法 7例患者取开放后外切口行单侧胸腔温热灌注;2例在VATS下行单侧胸腔温热灌注,于胸顶处放置灌注管、膈角处放置回流管;另2例患者取正中切口行双侧胸腔温热灌注,于前纵隔最高位放置灌注管、胸腔膈角处放置回流管进行循环灌注。灌注管与回流管分别固定于胸壁上,与体外循环机器管道紧密连接。利用体外循环机将预热到40℃的化疗液(平衡液+顺铂100 mg/m2)泵入胸腔,循环灌注60 min。持续监测灌注温度,确保灌注效果(见表1)。后外切口开放手术患者灌注时暂简单关胸,留1 cm大小的切口,观察灌注情况。灌注结束后,打开胸腔,蒸馏水再次冲洗胸腔并完全吸净残存的灌注液,放置引流管关胸。

表1 术中持续监测相关温度数值℃)
1.3 护理方法
1.3.1 术前准备 术前1 d,护士和外科医生及体外循环医生沟通,了解手术方式及术中特殊要求,充分了解手术过程及术中注意事项,为手术顺利进行做好完善的准备工作。
1.3.2 手术配合 11例患者参照常规胸腺瘤切除手术护理配合,具体方法参照参考文献[8]。
1.3.3 灌注配合 (1)配合医生分别在胸顶、膈角处放置灌注管及回流管,两管之间的距离越远越好,以增加灌注液的流动性,固定后连接体外管道进行循环灌注。灌注时,洗手护士严密观察灌注情况,即灌注管道是否通畅、灌注液有无溢出胸腔、胸腔内测温探头有无滑出等。每10 min晃动患者胸腔,使灌注液与胸膜腔充分紧密接触;加强胸腔局部的保温,对取开放切口灌注的患者,可在切口周围加盖纱布及无菌巾,减少灌注液温度的流失;及时将外渗的灌注液吸回至体外贮液罐内,避免药液的浪费及对切口皮肤的损害。灌注等待时间,要严格把关无菌区;灌注结束后,协同医生吸净残存的灌注液,并用蒸馏水进行胸腔冲洗。(2)巡回护士按100 mg/m2的标准剂量配制化疗药(顺铂),待预充液加热到40℃后,先进行胸腔的循环灌注,待灌入液和回流液达到平衡时(即保证预充液充满整个胸腔且不会溢出胸腔的状态),加入化疗药顺铂后开始计时。灌注流量为2000 ml/min,循环灌注60 min,利用液体的流动性,使加热后达40℃的化疗药物与胸膜腔充分接触,达到杀伤残存肿瘤细胞的目的。(3)术中必须配合麻醉医生严密观察患者的生命体征,准确记录灌入的液体量及尿量;持续监测鼻咽、胸腔、灌入液、回流液温度,15 min记录1次,胸腔、灌入液、回流液温度差异在1℃以上,要及时检查温度探头有无脱落及其他意外情况,确保灌注液的恒定温度;循环灌注过程中,若出现鼻咽温度高于39℃,可于头部及腋下放置冰袋,减少高热对大脑及心脏的损伤。
1.4 观察指标 (1)术后复发率,即术后6个月复查CT有无胸膜复发病灶。(2)术中生命体征,即胸腔热灌注前后的鼻咽温度、心率、平均动脉压、中心静脉压、血氧饱和度。(3)术后不良反应,即术后有无并发症及术后1 d复查血象肝肾功有无能异常。
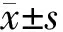
2 结果
11例患者胸腺肿瘤及转移胸膜均获得肉眼完全切除,其中1例患者因灌注侧肺难以萎陷而灌注失败,仅进行了肿瘤原发病灶及胸膜切除;10例完成胸腔灌注的患者术后6个月复查CT,均未见胸膜复发病灶,仅有1例患者出现颈部淋巴结远处转移,经局部放疗后缓解。灌注失败的1例患者术后6个月随访缺失。10例患者顺利完成胸腔温热灌注化疗,术中生命体征平稳。温热灌注前后,心率、中心静脉压、平均动脉压、血氧饱和度的差异无统计学意义;仅有鼻咽温度升高,最高为38.5℃,与灌注前相比,差异有统计学意义(P<0.05)。11例患者术后恢复良好,无严重并发症或住院死亡发生。10例完成胸腔温热灌注化疗的患者术后1d未出现血象或肝肾功能明显异常,仅有白细胞较术前增高,与温热灌注前的差异有统计学意义(P<0.05),见表2。
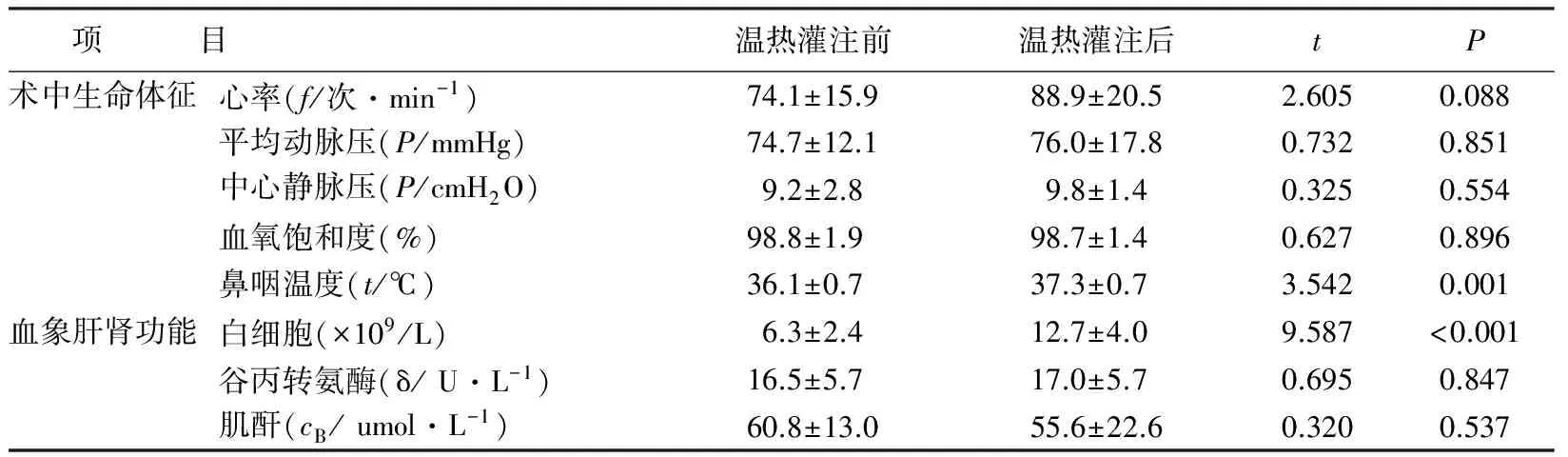
表2 温热灌注前后患者一般情况的比较
注:1 mmHg=0.133 kPa;1 cm H2O=0.098 kPa
3 讨论
胸膜切除术联合胸腔温热灌注化疗治疗Ⅳa期胸腺瘤的优势在于,该治疗手段强化围术期对胸腔的区域治疗,利用高温热疗及化疗的协同作用,杀灭可能残存的微小转移灶,最大限度的达到局部根治,预防胸膜局部复发[9-10]。这样既避免了EPP的严重并发症,又减少了术后放化疗的不良反应。本组有10例患者完成温热灌注化疗,术后恢复良好,均未出现明显血象或肝肾功能异常,术后6个月随访除1例患者出现颈部淋巴结(治疗野外)转移外,其余9例均未出现局部胸膜复发。结果表明,这种跨学科综合治疗的新模式安全有效,为局部晚期胸腺肿瘤患者延长生存、提高生活质量提供了新思路。
充分的术前准备,是手术顺利进行的基础。手术联合胸腔温热灌注化疗由于手术复杂、参与人员众多,术前应积极主动和医生沟通手术方式。本组11例患者根据原发肿瘤位置、侵犯程度和胸膜播散情况,采用VATS、胸骨正中和后外开胸三个手术方式的多种不同组合,术中涉及多种入路和患者体位的改变。因此,充分的术前评估及用物准备尤为重要,特别是术前1 d,护士必须加强与体外循环组医生的沟通,共同完成术中灌注时所需用物的准备,确保灌注的顺利进行。由于手术方式的特殊性,术中需要巡回护士更换患者体位,过程中必须警惕双腔气管插管移位。本组中第1例患者术中因双腔气管插管移位导致左肺不能萎陷,即使在减小潮气量后肺组织依旧膨胀,致使灌注液持续溢出而取消温热灌注。经总结分析,后10例患者在术中变换体位时,巡回护士协同麻醉医生加强对气管插管的保护,未再发生插管移位,均顺利完成胸腔温热灌注。
术中精准地温度管理是保证胸腔温热灌注化疗成功的关键。肿瘤细胞在38℃~43℃持续1 h,即可出现不可逆损害,而正常组织可耐受45℃的高温[10-12]。本研究利用体外循环加热器合理控制灌入液温度在40℃,从源头上确保灌注温度;灌注时加强对胸腔保温,减少温度流失,并确保灌注液与胸膜腔充分接触;持续监测胸腔温度、灌注液温度、回流温度,避免灌注过程中出现温度衰减影响治疗效果。表1显示,本组胸膜腔灌注液温度始终保持在39℃以上,既保证胸腔残存肿瘤细胞的灭活又不损伤正常组织,疗效得到保障。此外,由于大量高温液体灌入胸腔,可能引起体温升高增加耗氧量、影响血流动力学稳定,并可能对中枢神经系统造成损害,故在维持胸腔温度同时要监测鼻咽温度,注意其他部位散热。本组中仅1例患者灌注过程中出现鼻咽温度高于38.5℃,给予头部冰袋降温后降至37.5℃,表2灌注后鼻咽温度平均值在37.3℃左右,相比较灌注前确有增高但仍在正常可控范围,显示精准的温度控制可有效保证温热灌注的安全性。
此外,灌注时由于体温升高、大量出汗及胸膜腔灌注对纵膈的压迫,对患者呼吸循环稳定性可能造成不良影响[13]。术中护士应配合麻醉医生加强对患者心率、血压、血氧饱和度、液体出入量及尿量的监测,及时反馈。本组灌注前后心率加快,但差异无统计学意义(P=0.088),其中2例患者在灌注期间出现心率增快、收缩压增高,及时汇报麻醉医生调整用药后很快恢复至正常水平,未出现严重不良反应,可见灌注过程中严密监测生命体征至关重要,有助于避免意外情况发生。本研究结果表明,在精心默契主动配合下,患者灌注前后血压、中心静脉压、血氧饱和度未见明显差异,术后恢复良好,无严重并发症或住院死亡发生。
综上所述,胸膜切除术联合胸腔热灌注化疗,能较好地控制晚期胸腺肿瘤患者局部胸膜病灶复发,同时降低治疗风险和创伤,为这部分患者提供良好的治疗手段。充分的术前准备、术中精准的配合及有效的温度管理是手术顺利完成的关键。
【 参考文献 】
[1] 吴开良,蒋国梁.胸腺瘤的治疗现状与争议[J].中华肿瘤杂志,2012,34(5):321-324.
[2] 王利欢,李月敏.复发胸腺瘤的临床特点和综合治疗现状[J].中华肿瘤防治杂志,2015,22(4):320-324.
[3] Murthy S C,Rice T W.Surgical management of malignant pleural effusions[J].Thorac Surg Clin,2013,23(1):43-49.
[4] Fabre D,Fadel E,Mussot S,et al.Long-term outcome of pleuropneumonectomy for Masaoka stage Ⅳa thymoma[J].Eur J Cardiothorac Surg,2011,39(5):133-138.
[5] 唐健,于长海,李捷等.Ⅲ、Ⅳa期侵袭性胸腺瘤的手术、综合治疗及预后分析[J].临床肺科杂志,2012,17(7):1285-1287.
[6] Lim Y J,Kim E,Kim H J,et al.Survival impact of adjuvant radiation therapy in masaoka stage Ⅱ to Ⅳ thymomas:A systematic review and Meta-analysis[J].Int J Radia Oncol Bio Phy,2016(94):1129-1136.
[7] 马可,谷志涛,韩泳涛,等.术后化疗胸腺肿瘤中的应用及对其预后的影响[J].中国肺癌杂志,2016,19(7):473-482.
[8] 高玮玮,姜云.电视胸腔镜全胸腺及胸腺瘤切除45例手术配合[J].交通医学,2012,26(5):499-502.
[9] 钱晓哲,潘文标,孙志勇,等.循环胸腔热灌注化疗治疗恶性胸腔积液的临床研究[J].中国现代手术学杂志,2013,17(5):325-329.
[10]Chen W J,Yuan S F,Yan Q Y,et al.Intrapleural chemo-and hyper thermotherapies for maligmant pleural effusion:A randomized-prospective study[J].Cancer Invest,2012,30(2):126-130.
[11]Yang C L,Liu S S,Ma Y G,et al.The influence of intraoperative pleural perfusion with matrine-eisplatin or eisplatin on stromalcell-derived factor-Ⅰ in non-small cell lung cancer patients with sub-clinical pleural metastasis[J].Med Oncol,2012,29(2):574-581.
[12]孙建华,姬忠贺,于洋,等.细胞减灭术加腹腔热灌注化疗治疗卵巢癌腹膜转移癌的临床研究[J].肿瘤防治研究,2016,43(4):282-286.
[13]林峰,陈玲阳,王明仓.胸腔镜下胸胸腔内持续热灌注治疗恶性胸腔积液的麻醉管理[J].现代实用医学,2011,23(8):941-942.
