细胞分化周期蛋白27基因沉默抑制GH3细胞迁移及其分泌功能
2018-05-11王安平郭清华母义明解放军总医院内分泌科北京00853解放军总医院海南分院内分泌科海南三亚5703
苏 星,王安平,郭清华,,母义明解放军总医院 内分泌科,北京 00853;解放军总医院海南分院 内分泌科,海南三亚 5703
垂体柄中断综合征(pituitary stalk interruption syndrome,PSIS)是指由于垂体柄的纤细和(或)缺如导致下丘脑分泌的各种促激素释放激素不能发挥生理作用而引起的一系列临床综合征,其典型的临床特征为不同程度的腺垂体激素分泌缺乏,常伴有垂体外中线结构发育异常或畸形,对患者的生活质量产生很大的负面影响。有关该病的致病因素目前倾向于两个方面:一是围生期不良事件对垂体—下丘脑区域造成损伤;二是先天基因缺陷导致垂体下丘脑的发育异常[1]。迄今为止,已经发现的致病基因有 HESX1、LHX4、PROP1、PROK2、PROKR2、OTX2、SOX3、GPR161、CDON[2-8]。 基因突变极有可能成为其主要的病因,但目前已经发现的基因导致PSIS发病的比例还不到5%[9],提示可能存在其他致病基因未被发现。垂体特异性转录因子-1和垂体特异性转录因子祖先蛋白在胚胎早期表达较高,在垂体发育过程中起着十分重要的作用[10-11]。该基因已经在多个种群的矮小型畸形研究中得到了证实,最主要的作用是引起多种垂体激素的缺乏而导致矮小现象的出现[12-13]。为进一步获得功能性研究的理论依据,本实验选取来自于临床病例中检测得到的细胞分化周期蛋白 27(cell division cycle protein 27,CDC27)、神经纤维瘤病 1型 (neurofibromatosis type 1,NF1)、X染色体关联的泛素特异性蛋白酶9(ubiquitin specific peptidase 9,X-Linked,USP9X)基因,对3种基因预先筛选后,研究其对GH3细胞性状的影响。
材料和方法
1 主要实验试剂及仪器 大鼠垂体瘤细胞(GH3),购自中国协和医科大学基础医学细胞中心;F-12K(Thermo公司,美国);2.5%胎牛血清(FBS,Thermo公司,美国);15%马血清(HS,应用生物系统公司,美国);胰酶(0.25% EDTA,Thermo公司,美国);RFect细胞小核酸转染试剂(百代生物科技有限公司,常州);细胞计数试剂盒(cell counting kit-8,CCK-8,DojinDo公司,日本);鼠CDC27单克隆抗体、鼠NF1单克隆抗体、鼠USP9X单克隆抗体、鼠POU1F1单克隆抗体、鼠PROP1单克隆抗体(Santa Cruz生物技术有限公司,美国);鼠生长激素放免试剂盒(GH ELISA试剂盒);鼠泌乳素放免试剂盒(PRL ELISA试剂盒);鼠促甲状腺激素放免试剂盒(TSH ELISA试剂盒,健坤生物技术有限公司,北京);Millipore超纯水制备系统Milli-Q(Millipore公司,美国);CFX96 RT-PCR仪(BIO-RAD公司,瑞典);-80℃冰箱(Thermo公司,美国)。
2 细胞培养 购买的GH3细胞保存于解放军总医院内分泌科实验室,常规传代培养,生长条件为F-12K培养基+ 2.5%FBS + 15%HS。于37℃、5%CO2饱和湿度的培养箱内培养,2 ~ 3 d可传代1次。
3 siRNA转染初筛培养 GH3细胞至融合度90%时,消化铺于24孔板,细胞密度为1×105/孔,继续培养至细胞融合度达到50%时开始转染,采用CDC27(sense:5'-GACGACCTTGTCACTGAGTTTGG-3';anti-sense :5'-CTGGCTTCTCACCTATTTCAC-3')、NF1(sense:5'-CTCTCTCAGTTGATCATATTGG-3';anti-sense:5'-CCGAAGTTCGGCTGCATGTTGG-3')、USP9X(sense:5'-CTCGTGGCTCTCCAGTTGGAGGG-3';anti-sense:5'-GCCAGGTCAGTGTGTGGAAATG-3')(GenePharma公司,上海)小干扰RNA瞬时转染的方式予以转染,均按照12.5×10-6mmol/L、25×10-6mmol/L、50×10-6mmol/L设置转染梯度。取出培养液,磷酸盐缓冲液(PBS,Sigma公司,美国),胰酶,37℃下预热,更换为无抗生素培养基,将siRNA分别配制于无血清培养基中,室温放置5 min。将转染试剂混合液,加至siRNA混合液中,室温孵育20 min。取转染混合液100μl至24孔板,混匀后入培养箱中培养。转染后2 h收集细胞,RT-PCR(GoTaq®qPCR Master Mix,Promega生物技术有限公司,北京)检测siRNA转染后的敲低效率。
4 siRNA转染复筛 根据预实验结果,CDC27选择siRNA-117和siRNA-1968序列,在25×10-6mmol/L、24 h时达到最佳敲低效率,NF1选择siRNA-6859和 siRNA-7139序 列, 在 50×10-6mmol/L、24 h时达到最佳敲低效率,USP9X选择siRNA-910和siRNA-2199序 列, 在 25×10-6mmol/L、24 h时达到最佳敲低效率。三种基因均同时设置阴性对照(negative control,NC)组和空白细胞组,运用Western bolt方法检测沉默后的蛋白水平。
5 总RNA提取和RT-PCR检测mRNA表达 采用Trizol法按RNA提取试剂盒(Invitrogen公司,美国)操作说明提取总RNA,然后按照逆转录试剂盒说明书将RNA特异性逆转录为cDNA,反应体 系:DNase缓 冲 液 1μl,DNase 1μl,RNA 5μl,RNA 酶抑制剂 0.2μl,超纯水 2.8μl。37℃孵育30 min,加1μl终止液,65℃孵育5 min终止反应。纯化后的RNA进行cDNA模板第一链的合成,合成的cDNA稀释至100μl。RT-PCR反应程序按照:95℃下2 min,(95℃ 10 s、55℃ 30 s、60℃ 30 s)35个循环,65℃下2 min。反应结束后对产物的溶解曲线进行分析,并用2-△△Ct分析数据。
6 Western blot检测蛋白表达 -80℃取出转染处理的GH3细胞样品(24孔板中),每孔加入60μl含蛋白酶抑制剂、磷酸酶抑制剂和PMSF的裂解液,细胞刮刀刮下细胞,收集液体至EP管中,4℃轻柔地摇40 min,16 000 r/min,4℃离心10 min,取上清至新的EP管。BCA蛋白浓度测定后,配制8%SDS-PAGE Gel胶,加入样品1/5体积的4×上样缓冲液,100℃加热5 min,脱脂奶粉室温封闭1 h,分别加入抗CDC27(1∶500)、NF1 (1∶100)、USP9X(1∶ 100)、POU1F1(1∶ 100)、PROP1(1∶100),4℃水平摇床孵育过夜后,用TBST(谱振生物有限公司,上海)洗涤膜3×10 min,加入相应的二抗(1∶5 000),TBST洗涤3×10 min后,化学发光成像仪拍照记录。
7 CCK-8法检测GH3细胞增殖能力 细胞铺24孔板,浓度选择CDC27 siRNA-117和siRNA-1968 25×10-6mmol/L转染,加上NC组和空白细胞组。转染完成后胰酶消化细胞5 min,重新铺入96孔板,每孔1 000个细胞。细胞贴壁过夜后,第2天记为0 d,分别在0 d、1 d、2 d、3 d、4 d检测细胞增殖并拍照记录细胞,视野选取40×。在酶联免疫检测仪上测定各孔光密度(optical density,OD),选择450 nm波长,记录结果。该步骤重复3次。
8 GH3细胞划痕实验检测细胞迁移能力 细胞铺24孔板,重新铺入24孔板,每孔5×105个细胞。细胞贴壁过夜后,直接加入丝裂霉素C处理1 h后,更换含0.1% HS的培养基,划痕拍照记为0 h,分别在0 h、24 h、48 h拍照,用倒置显微镜,于0 h、24 h、48 h下随机选择5个200×视野内计算迁移到划痕空隙中的细胞总数。通过Image J软件计算每个视野面积。
9 ELISA检测细胞分泌能力 采用ELISA法进行,将GH3细胞铺24孔板,转染48 h以后,收集48 h细胞及上清液,并同时制备标准品梯度,后加入包被有GH抗体、PRL抗体和TSH抗体的酶标板,37℃下孵育90 min,依次滴加生物素,37℃下孵育60 min,辣根过氧化物酶工作液,37℃下孵育30 min,洗板后加入底物溶液,37℃下避光孵育150 min,加终止液终止反应,相同标本设3个复孔,重复3次,在酶标仪450 nm测定OD值。绘制标准曲线,计算各样本OD值所对应的浓度。
10统计学方法 实验结果采用SPSS19.0进行分析,各实验独立重复3次,所有数据均检验其方差齐性,以±s表示,四组数据组间比较采用单因素方差分析(one-way ANOVA),事后检验采用LSD法;CCK-8法检测细胞增殖能力的比较采用重复测量方差分析,事后检验SNK-q法。P<0.05为差异有统计学意义。
结 果
1 三种siRNA转染初筛 经siRNA转染后,CDC27在25×10-6mmol/L浓度下,24 h时敲低效率相对较好(P<0.05,图1),这其中CDC27 siRNA-117序列和CDC27 siRNA-1968序列敲低效率为最佳(图中黑框);NF1在50×10-6mmol/L浓度下,24 h时敲低效率相对较好(P<0.05,图1),这其中NF1 siRNA-6859序列和NF1 siRNA-7139序列敲低效率为最佳(图中黑框);USP9X在50×10-6mmol/L浓度下,24 h时敲低效率相对较好(P<0.05,图1),这其中USP9X siRNA-910序列和USP9X siRNA-2199序列敲低效率为最佳(图中黑框)。三种基因对应的最佳敲低效率将进行下一步复筛实验。
2 siRNA转染复筛 将上述初筛中三种基因各自所能达到的最佳敲低效率的序列选出,NF1和USP9X在WB检测的蛋白水平的表达上没有差异(P>0.05,图2C ~图2F);CDC27敲低效率在蛋白水平上具有统计学意义(P<0.01,P<0.05,图2A、图2B)。结果表明CDC27不仅能够在mRNA水平上达到沉默效应,在蛋白水平也能够达到,而USP9X和NF1无法在蛋白水平上实现敲低,所以最终确定选取CDC27基因进行进一步研究。
3 CDC27 siRNA转染验证实验 将siRNA-117和siRNA-1968转染细胞后,分别在24 h和48 h各检测一次蛋白水平。通过Image J分析灰度值,结果显示siRNA-117和siRNA-1968转染效率稳定,能够达到预期的沉默效应(P<0.01,P<0.05,图3)。
4 细胞增殖与细胞形态 实验结果转染后,CCK-8检测结果显示CDC27沉默组(siRNA-117和siRNA-1968)与对照组(NC组)和空白细胞组比较,在细胞的增殖和形态等方面差异无统计学意义(P>0.05,图4和图5)。
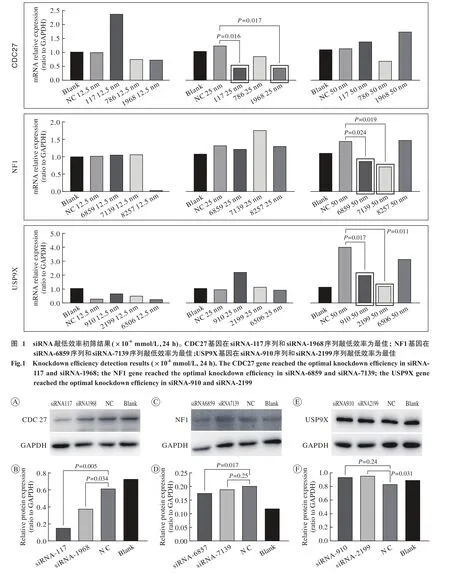
图 2 三种基因最佳敲低序列蛋白检测结果 A、 C、 E: Western bolt检测CDC27、 NF1、 USP9X蛋白水平; B、 D、 F: 分别为左侧对应的灰度值相对量统计图Fig. 2 Results of optimal silencing efficiency from the three genes A, C and E: Western bolt detections of protein level of CDC27, NF1,and USP9X; B, D and F: the corresponding amount of gray values from the left results
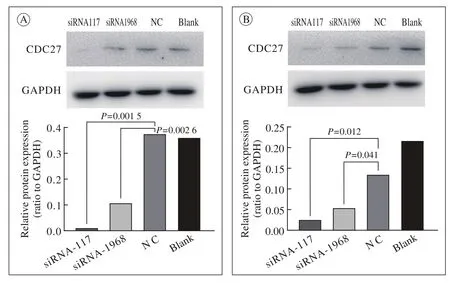
图 3 CDC27转染后沉默效应验证A:24 h; B:48 hFig. 3 Verifying experiment ofsilencing effect after CDC27 siRNA transfection A:24 h; B:48 h
5 划痕检测细胞迁移能力 相对于对照组,CDC27 siRNA转染后细胞的迁移能力有所下降,且在siRNA-117组中更为明显(P<0.05,图6)。提示CDC27沉默会使GH3细胞的迁移能力下降。
6 POU1F1与PROP1的表达水平 GH3细胞在CDC27 siRNA转染后,POU1F1与PROP1表达均明显低于对照组(P<0.05,P<0.01,图7)。
7 ELISA检测细胞分泌能力 细胞转染之后,分泌生长激素、泌乳素的能力与对照组相比明显下降(P<0.01,P<0.05,图8A和图8B),促甲状腺激素分泌未见统计学差异(P>0.05,图8C)。
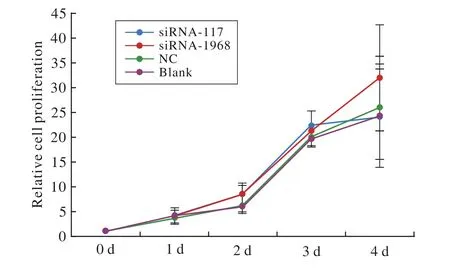
图 4 转染对细胞增殖影响。转染细胞达到沉默效应后,各组之间细胞增殖未见明显差异Fig. 4 Effects of transfection on cell proliferation. Observations were recorded for consecutive 4 days, and the results showed that there was no significant difference in the cell proliferation between each group
讨 论
垂体柄中断综合征是内分泌与代谢病学中的一种罕见的综合征,该疾病的发展常在胚胎或新生儿期开始,但由于其进展缓慢,常难以引起重视,所引起的临床症状一是外貌方面如面部、颅脑、生殖系统等的畸形;二是功能方面(相关激素缺乏)如生长、性腺、垂体功能发育不良[14]。
本研究中,CDC27基因沉默后在mRNA水平和蛋白水平上均能够呈现有差异性且稳定的敲低,达到了预期的沉默效应,后续的功能性实验主要是研究CDC27沉默对GH3细胞生物学功能的影响。验证实验确定成功转染后,细胞划痕和Western bolt的结果表明,CDC27沉默后GH3细胞的迁移能力和POU1F1、PROP1的表达水平均有所降低的,且有统计学差异,提示CDC27与细胞迁移的调控可能相关。研究表明,在机体内作为祖先蛋白的PROP1的作用是活化POU1F1基因,进而使其发挥功能[15-19]。POU1F1基因定位于人体第3号染色体上,由6个外显子和5个内含子组成,作为一个在垂体发育后期起作用的垂体特异性转录因子,其在胚胎期的第16天对GH、PRL和TSH分化的能力达到最强,加之这3种激素细胞均同属POU1F1细胞系,所以POU1F1突变对于GH、PRL和TSH发育的影响也是最大的,因此垂体功能低下可以通过POU1F1突变导致相关细胞不完全发育来解释[20-24]。针对PROP1基因而言,其在拉克特氏囊前体细胞迁移中则发挥着十分重要的作用,并参与垂体器官早期的形成,一旦其表达下降,则后续的迁移过程便无法完成,使得原本调控生长激素细胞增殖的POU1F1无法作用于生长激素释放激素受体和生长抑素受体,后续的生长激素分泌便明显下降,所以PROP1突变与POU1F1突变所引起的激素水平缺乏的结果往往是类似的,其病理原因正是自身表达水平的下降影响了后续的细胞迁移。在一些侏儒鼠模型中,如Snell和Jackson小鼠,POU1F1以及PROP1基因表达量在其体内很难测出,同样这些侏儒鼠体内GH、PRL、TSH细胞较野生正常的同种小鼠均是萎缩的[25]。
图 5 转染对细胞形态影响。转染细胞达到沉默效应之后,各组之间细胞形态未见明显差异(40×)Fig. 5 Effects of transfection on cell morphology. Observations were recorded, and the results showed that there was no significant difference in the cell morphology between each group (40×visual field)
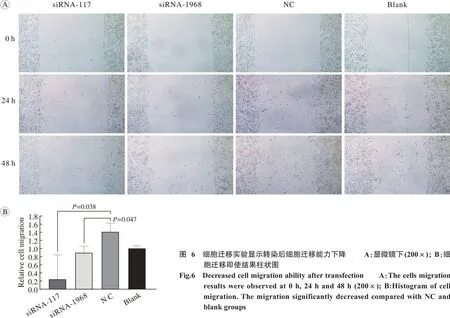
图 6 细胞迁移实验显示转染后细胞迁移能力下降 A:显微镜下(200×); B:细胞迁移即使结果柱状图Fig. 6 Decreased cell migration ability after transfection A:The cells migration results were observed at 0 h, 24 h and 48 h (200×); B:Histogram of cell migration. The migration significantly decreased compared with NC and blank groups
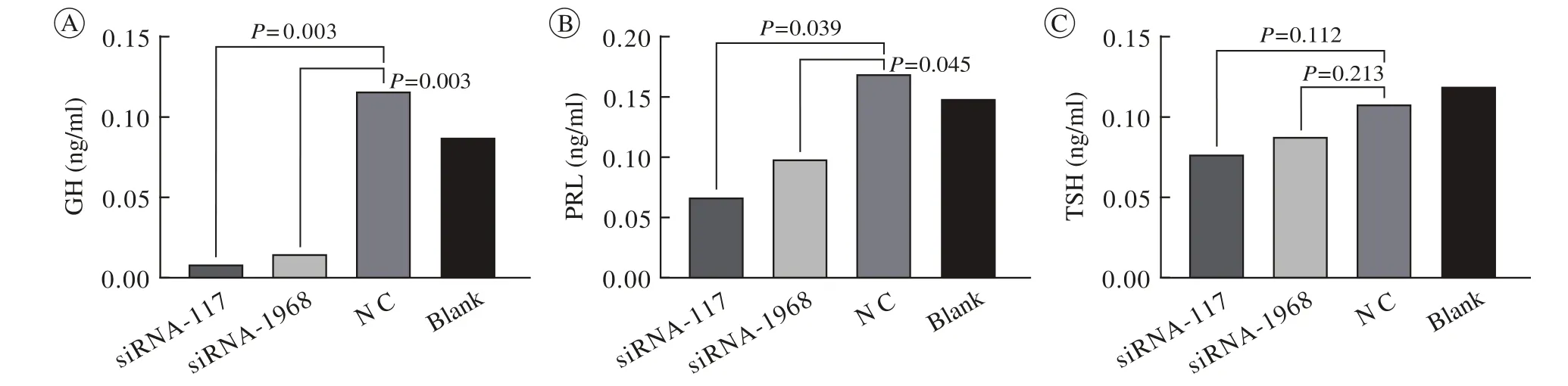
图 8 CDC27达到沉默效应后上清液中生长激素(A)、 泌乳素(B)、 促甲状腺激素(C)水平Fig. 8 Detections of GH, PRL and TSH from supernatant. A: GH level (ng/ml); B: PRL level (ng/ml); C: TSH level (ng/ml)
Lee等[26]指出胞葬作用、细胞迁移、神经突生长均与一个名为Elmo的蛋白家族有关(该家族共包含Elmo1、Elmo2、Elmo3三个成员),其中Elmo1在细胞迁移过程中发挥重要的作用,针对其的磷酸化或其他调节作用可能会使其成为后期促进复合物(anaphase-promoting complex,APC)的底物,而CDC27正是该复合物中的一个重要组成成分,且作为新伴侣与Elmo1相结合,但CDC27表达无论高低,对于细胞的吞噬和凋亡均没有影响。Nishimura等[27]进一步指出PROP1所表现出的转录活性为细胞类型依赖型,作用位点位于PROP1基因5'端上游区域和第1号内含子的位置处,该作用的发挥与Notch通路关系密切;此外还发现了18种涉及垂体早期器官形成和发育的转录因子(均为Notch通路中所包含的因子),也都是在5'端上游区域位点参与对PROP1的调节,而Notch通路是一个既可以在胚胎期也可以在成体后影响垂体的形态、增殖及最终垂体结构定位、分化的通路[28-29]。我们的实验结果也验证了CDC27沉默对于GH3细胞增殖和形态两个方面均未产生明显影响,即在细胞存活方面与前述的研究是相吻合的,证实了CDC27沉默主要是影响细胞迁移的过程,也就是说CDC27在细胞迁移中确实起着重要的作用。
综上所述,本研究表明,全基因组外显子测序所得的3种基因,即CDC27、NF1、USP9X,只有CDC27具有在体外实验验证的可行性,而且在体外实验中也验证了其会对细胞的迁移有明显影响,所以推测CDC27的沉默表达可能会在体内研究中导致涉及垂体器官发育重要过程的POU1F1以及PROP1表达的下降,最终导致细胞无法完成迁移而发挥应有的生理功能。该结果可能会对垂体形成发育产生负性的影响。当然,本研究仅在体外验证方面取得了一定结果,可以作为体内实验开展的理论依据,更多的功能性研究亟待在体内实验中进一步验证。
1 Wang Q, Hu Y, Li G, et al. Pituitary stalk interruption syndrome in 59 children: the value of MRI in assessment of pituitary functions[J].Eur J Pediatr, 2014, 173(5): 589-595.
2 Melo ME, Marui S, Carvalho LR, et al. Hormonal, pituitary magnetic resonance, LHX4 and HESX1 evaluation in patients with hypopituitarism and ectopic posterior pituitary lobe[J]. Clin Endocrinol (Oxf), 2007, 66(1): 95-102.
3 Bas F, Uyguner ZO, Darendeliler F, et al. Molecular analysis of PROP1, POU1F1, LHX3, and HESX1 in Turkish patients with combined pituitary hormone deficiency : a multicenter study[J].Endocrine, 2015, 49(2): 479-491.
4 McCabe MJ, Gaston-Massuet C, Gregory LC, et al. Variations in PROKR2, but not PROK2, are associated with hypopituitarism and septo-optic dysplasia[J]. J Clin Endocrinol Metab, 2013, 98(3):E547-E557.
5 Shimada A, Takagi M, Nagashima Y, et al. A Novel Mutation in OTX2 Causes Combined Pituitary Hormone Deficiency, Bilateral Microphthalmia, and Agenesis of the Left Internal Carotid Artery[J].Horm Res Paediatr, 2016, 86(1): 62-69.
6 Laumonnier F, Ronce N, Hamel BC, et al. Transcription factor SOX3 is involved in X-linked mental retardation with growth hormone deficiency[J]. Am J Hum Genet, 2002, 71(6): 1450-1455.
7 Karaca E, Buyukkaya R, Pehlivan D, et al. Whole-exome sequencing identifies homozygous GPR161 mutation in a family with pituitary stalk interruption syndrome[J]. J Clin Endocrinol Metab,2015, 100(1): E140-E147.
8 Kahn BM, Corman TS, Lovelace K, et al. Prenatal ethanol exposure in mice phenocopies Cdon mutation by impeding Shh function in the etiology of optic nerve hypoplasia[J]. Dis Model Mech, 2017, 10(1):29-37.
9 Bashamboo A, Bignon-Topalovic J, Moussi N, et al. Mutations in the Human ROBO1 Gene in Pituitary Stalk Interruption Syndrome[J].J Clin Endocrinol Metab, 2017, 102(7): 2401-2406.
10 Lamberts SW, Hofland LJ. Future treatment strategies of aggressive pituitary tumors[J]. Pituitary, 2009, 12(3): 261-264.
11 Viacava P, Gasperi M, Acerbi G, et al. Microvascular density and vascular endothelial growth factor expression in normal pituitary tissue and pituitary adenomas[J]. J Endocrinol Invest, 2003, 26(1):23-28.
12 李宏滨, 曹红鹤, 郑友民. PIT—1基因在人、鼠及猪中的研究现状[J]. 遗传, 2001, 23(6): 605-608.
13 王玺年, 陈金萍. Pit-1基因的结构及生物信息学分析[J]. 畜牧兽医杂志, 2015, 34(5): 22-25.
14 苏星, 王成芷, 王安平, 等. 从胚胎发育说起——垂体柄中断综合征的基因研究进展[J]. 中华内分泌代谢杂志, 2017, 33(8):702-704.
15 Ward RD, Raetzman LT, Suh H, et al. Role of PROP1 in pituitary gland growth[J]. Mol Endocrinol, 2005, 19(3): 698-710.
16 Davis SW, Potok MA, Brinkmeier ML, et al. Genetics, gene expression and bioinformatics of the pituitary gland[J]. Horm Res,2009, 71(Suppl 2): 101-115.
17 Himes AD, Raetzman LT. Premature differentiation and aberrant movement of pituitary cells lacking both Hes1 and Prop1[J]. Dev Biol, 2009, 325(1): 151-161.
18 Perez Millan MI, Brinkmeier ML, Mortensen AH, et al. PROP1 triggers epithelial-mesenchymal transition-like process in pituitary stem cells[J]. 2016, 5 : e14470.
19 Mortensen AH, MacDonald JW, Ghosh D, et al. Candidate genes for panhypopituitarism identified by gene expression profiling[J].Physiol Genomics, 2011, 43(19): 1105-1116.
20 Sakagami Y, Okimura Y, Kondoh T, et al. Expression of mPOU protein in the human pituitary adenomas[J]. Kobe J Med Sci,2003, 49(5-6): 117-122.
21 Schoenmakers N, Alatzoglou KS, Chatterjee VK, et al. Recent advances in central congenital hypothyroidism[J]. J Endocrinol,2015, 227(3): R51-71.
22 Iguchi G, Bando H, Takahashi Y. A Novel Clinical Entity of Autoimmune Endocrinopathy: Anti-PIT-1 Antibody Syndrome[J].Front Horm Res, 2017, 48 : 76-83.
23 Davis SW, Keisler JL, Perez-Millan MI, et al. All Hormone-Producing Cell Types of the Pituitary Intermediate and Anterior Lobes Derive From Prop1-Expressing Progenitors[J]. Endocrinology,2016, 157(4): 1385-1396.
24 Takagi M, Kamasaki H, Yagi H, et al. A novel heterozygous intronic mutation in POU1F1 is associated with combined pituitary hormone deficiency[J]. Endocr J, 2017, 64(2): 229-234.
25 Galsgaard ED, Rasmussen BB, Folkesson CG, et al. Re-evaluation of the prolactin receptor expression in human breast cancer[J]. J Endocrinol, 2009, 201(1): 115-128.
26 Lee J, Moon B, Lee DH, et al. Identification of a novel protein interaction between Elmo1 and Cdc27[J]. Biochem Biophys Res Commun, 2016, 471(4): 497-502.
27 Nishimura N, Ueharu H, Nishihara H, et al. Search for regulatory factors of the pituitary-specific transcription factor PROP1 gene[J].J Reprod Dev, 2016, 62(1): 93-102.
28 Nantie LB, Himes AD, Getz DR, et al. Notch signaling in postnatal pituitary expansion : proliferation, progenitors, and cell specification[J]. Mol Endocrinol, 2014, 28(5): 731-744.
29 Oyama T, Harigaya K, Sasaki N, et al. Mastermind-like 1 (MamL1)and mastermind-like 3 (MamL3) are essential for Notch signaling in vivo[J]. Development, 2011, 138(23): 5235-5246.
