99mTc标记磁性纳米Fe3O4颗粒双模态探针的制备及其成像实验研究
2018-05-11杜鹏刘红姚琦马倩习玉峰
杜 鹏 刘 红 姚 琦 马 倩 习 玉 峰
湖北大学中药生物技术省重点实验室,湖北武汉 430062
磁性聚合物微粒是采用一定的合成方法,将具有磁性的物质和高分子聚合物反应而制成的一种新型聚合物材料。可以获得具有长血液循环时间的磁性氧化铁纳米颗粒,也可以通过与特定的配体或受体的偶联结合,从而获得功能更为复杂的磁性氧化铁纳米颗粒MRI分子影像探针[1,15]。Fe3O4纳米颗粒以其超顺磁特性在磁共振成像(MRI)中表现出独特的造影剂功能,并具有良好的生物安全性和表面可修饰性等诸多优点,因此磁性纳米颗粒在生物医学上展现出巨大的应用价值[2]。造影剂可以增强信号对比度和提高软组织图像的分辨率,用于恶性肿瘤的早期诊断及鉴别。在影像医学研究中Fe3O4纳米颗粒已成为最受青睐的MRI造影剂[3]。
本实验室已经合成与表征了具有一定超顺磁性,粒径分布均匀的Fe3O4纳米微粒,本文中主要选用此颗粒为核心,在其表面偶联上99mTc(锝)和RGD小肽,制备SPECT/MRI双模态探针。主要考察该双模态探针应用于裸鼠模型的SPECT/MRI成像,研究其在体内体外的靶向行为。
1 实验部分
1.1 实验材料
二亚乙基三胺五乙酸二酐(DTPA二酐),Tween-20分析纯,透析袋(mw,8000~ 14000),均由国药集团化学试剂有限公司;羧基聚乙二醇(mw,2000)(HOOC-PEG-COOH)、氨基聚乙二醇(mw,2000)(HOOC-PEG-NH2)、DMSO 和 RGD小肽(C(RGDyK))均由炎怡生物技术公司提供;超净台、CO2培养箱,Therome公司;正置荧光显微镜DM2500,Leica(德国)公司;3T Trio 磁共振成像仪系统,西门子(德国)公司;SPECT/CT,Bioscan(美国)公司;烘箱LC-213,上海爱斯佩克环境设备有限公司;电子天平PB602-N,METELER TOLEDO公司;超声波清洗器USC-202,上海波龙电子设备公司;高速离心机Microfuge 16,BECKMAN COULTER公司;动态光散射(DLS)仪、粒度分析仪Nano-ZS,Malvern公司;γ放射免疫计数器GC-1200,中佳光电公司;超滤管HyClone(美国)公司;Milli-Q 纯水系统制备溶液配置用水。人肺癌H1299细胞株、裸鼠BALB/C-nu购自上海斯莱克动物实验有限公司。
1.2 SPECT/MRI双模态靶向探针的制备
1.2.1 Fe3O4@PEG-DTPA-RGD的制备及DLS测量颗粒的水力学尺寸 (1)配制15mL混合液(HOOC-PEG-NH21mL,HOOC-PEG-COOH 1mL,Fe3O4透析液2mL(本实验室准备),PBS 11mL),超声1小时。(2)将15mL混合液置于分子量30K的超滤管中,5000rpm,10min,上层约有5mL残留,加 PBS 5mL,5000rpm,10min,重复 2次,以除去游离PEG。(3)将残留液转移至分子量3K的超滤管中,6000rpm,15min,约 2mL 残留,静置后有沉淀,上清呈深棕色。(4)以DMSO为溶剂,配制DTPA二酐-DMSO溶液,浓度为1mg/mL。(5)取DTPA二酐-DMSO溶液100μL,加到(3)中残留液中,振荡 1min,5000rpm,15min,约 200μL残 留,加 PBS 3mL,5000rpm,10min,重复 2次,以除去 DMSO 及游离DTPA,约1mL残留。(6)取8mLPBS与10mL离心管中,加入2μL Tween-20。(7)称取20mg NHS、20mg EDC,分别置于2个EP管中,在两管中各加入400μL(6)中溶液,混匀。(8)从(7)两管中各取出200μL溶液,加入以新EP管中,再加入 (5)中残留液(Fe3O4@PEG-DTPA)50μL。(9)涡旋10s,将EP管固定在垂直混合仪上,室温反应15min。(10)将50μg RGD小肽投入(9)溶液中。(11)在37℃中振荡3小时,反应完成后,封口在4℃保存。
1.2.2 99mTc标记Fe3O4@PEG-DTPA-RGD (1)称取 10mg SnCl2,溶于 10mL 10mM 的 HCl溶液,混匀。配制0.25 mM的乙酸铵溶液。(2)取40μL Fe3O4@PEG-DTPA-RGD溶 液,40μL的 0.25 mM乙酸铵溶液,20μL PBS 溶液,10μL Na99 mTcO4溶液,混匀。反应一小时,每20min涡旋1min,使其充分反应。(3)反应结束后,用薄层色谱法(TLC)检测探针的放化纯度。取1mm×10mm层析纸条,在一端1cm处用铅笔画一虚线,在虚线中点3μL样品,将有虚线一端浸入丙酮中,待丙酮跑到层析条4/5处,取出层析条。将其剪为4段,用表面沾污仪分别检测者4段的核素活度。见图1。

图1 Fe3O4@PEG-DTPA-RGD的制备原理
1.2.3 用动态光散射(DLS)仪测量颗粒的水力学尺寸 制备的探针溶液,用PBS(pH=7.4)和超纯水稀释到适量的浓度,分别在在不同的时间点(0h、2h、6h、8h、24h)测量颗粒的水化直径。见图 2。

图2 Fe3O4@PEG-DTPA分别在水中和在PBS中不同时间点的水合直径
1.3 探针的细胞靶向性分析
采用Fe3O4@PEG-RGD探针和Fe3O4@PEG与H1299细胞共培养,时间梯度为1h、2h和3h,探针浓度定为2mM;分为三组:靶向组,加入2mM靶向探针Fe3O4@PEG-RGD共培养;对照组,加入2mM的非靶向探针Fe3O4@PEG共培养;竞争组中,加入浓度为1.5×10-3mg/mL的多肽,加入2mM靶向探针Fe3O4@PEG-RGD的共培养。
将18mm×18mm的盖玻片在75%中浸泡5s,在火焰上烘干盖玻片,放入六孔板中(一孔一片)。将生长状态良好的H1299细胞取400μL,滴于盖玻片上,待细胞贴壁后,吸出培养基,加入含指定浓度探针的培养基,培养至指定时间,吸出培养基,用PBS清洗三次,进行普鲁士蓝染色。具体操作如下:细胞普鲁士蓝染色:利用三价铁与亚铁氰化钾在酸性条件下反应,能够生成普鲁士蓝,来定性分析细胞对纳米铁粒子的吞噬情况。将细胞铺板,并照上面过程共培养并处理后,采用4%的多聚甲醛固定10min,吸出固定液后风干15min,再用 PBS 浸泡5min。加入 10%的 Prussian blue (K4Fe(CN)63H2O)浸 泡 5min,再 用 Prussian blue (K4Fe(CN)63H2O)和20% HCl (1:1)混合液浸泡45min,用水浸泡5min。用核固红染 15min。然后依次用75%,95%,100%乙醇(2次)梯度脱水并风干,用二甲苯浸泡玻片,并最终用中性树脂封片。待晾干后置于显微镜下(LEICA DM2500)观察拍片[4]。
1.4 探针的SPECT/MRI成像实验[5-6]
在15只BALB/C-nu裸鼠右上肢腋下皮下接种人H1299细胞株,细胞液用量200μL,约含肿瘤细胞3×107个。接种后约2周,肿瘤直径长至约1.0cm时用于实验。
(1)SPECT/CT成像:取5只已建立肿瘤模型的BALB/C-nu裸鼠,分为三组:靶向组、竞争组和对照组。尾静脉注射探针,靶向组每只注射900uci99mTc标记Fe3O4@PEG-DTPA-RGD探针(200μL);竞争组每只提前15min注射100mg RGD,然后每只注射900uci99mTc标记Fe3O4@PEG-DTPA-RGD探针(200μL);对照组每只注射900uci99mTc标记Fe3O4@PEG探针(200μL),探针注射后分1h、3h成像。
NanoSPECT/CT每只小鼠在进行SPECT显像之前首先进行CT扫描,CT扫描参数选取256×512的帧分辨率、45 kVp的球管电压和0.15 mA电流以及500 ms/帧的曝光时间,小鼠全身扫描时间约为7分钟,在采集图像的同时通过Nucline 1.02软件(匈牙利Mediso公司)进行实时图像3D重建。CT扫描结束后,进行同机SPECT扫描,SPECT扫描选用4个高分辨9孔板配合锥形准直器同时实现图像的高分辨及高灵敏度,能峰选择140KeV,窗宽10%,扫描参数选择1 mm/pixel的分辨率及 256 × 256的矩阵排列以及24个投影和60s/投影的扫描时间,小鼠全身扫描约需33分钟,扫描完成后,图像通过InVivoScope 1.44软件(美国Bioscan公司)进行3D-OSEM重建,重建算法选择4个子集及6次迭代计算,重建分辨率为0.4 mm/pixel。见图4。(2)MRI成像:取9只已建立肿瘤模型的BALB/C-nu裸鼠,分为三组:靶向组、竞争组和对照组。尾静脉注射探针,靶向组每只注射200μL99mTc标记Fe3O4@PEG-DTPA-RGD探针(含铁0.5mg);竞争组每只提前15min注射100mg RGD,然后每只注射200μL 99mTc标记Fe3O4@PEG-DTPA-RGD探针(含铁0.5mg);对照组每只注射200μL Fe3O4@PEG探针(含铁 0.5mg)。
探针注射后3h ,上机检测前,每只裸鼠注射150μL麻醉剂(8%水合氯醛:氯胺酮=2:13,v/v)。分别采用T1加权和T2加权序列成像,参数如下:T1加权自旋回波序列:TR=500ms,TE=10ms,FOV=75×100mm2,data matrix=192×256,slice thickness=2mm,扫描4次;T2加权自旋回波序列:TR=1500ms,TE=83ms,FOV=75×100mm2,data matrix=192×256,slice thickness=2mm,扫描 4次。
1.5 裸鼠体内核素浓度测定及肿瘤组织中探针的分布
SPECT/CT成像结束后,将5只裸鼠断颈处死,取下全身各主要脏器(心、肝、脾、肺、肾、胃、肠、肌肉)和肿瘤,γ放射免疫计数器测量上述器官中残余的核素浓度,除以成像实验前注射的总的核素浓度,再除以该器官的质量,即可得到ID/g%。
MRI成像结束后,将9只裸鼠断颈处死,取下肿瘤组织,放于-80℃保存。
2 结果与讨论
2.1 Fe3O4@PEG-DTPA颗粒分别在水中和在PBS中不同时间点的水合直径
由图2可知,Fe3O4@PEG-DTPA在水中和PBS中的DLS图谱峰型较单一,特别是在PBS中,各峰的重合度较好。Fe3O4@PEG-DTPA在PBS中的水合粒径为120nm,Fe3O4@PEG在PBS中的水合粒径为100nm,二者相差20nm,说明DTPA成功与Fe3O4@PEG偶联。分散系数在0.3左右,说明Fe3O4@PEG-DTPA在两种溶剂中的单分散稳定性较好。
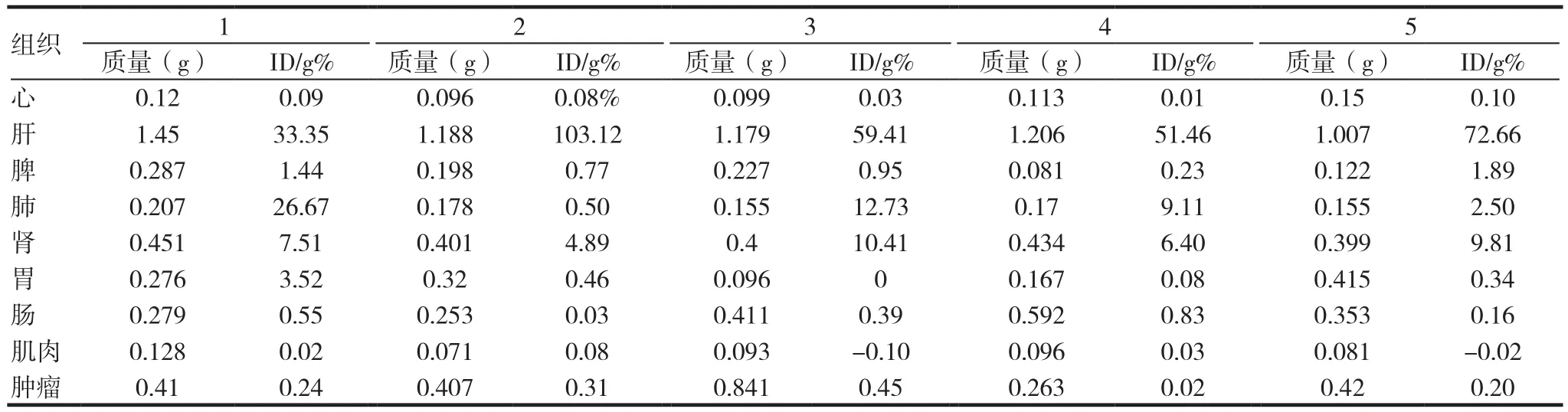
表1 99mTc标记Fe3O4@PEG-DTPA-RGD探针在裸鼠各主要器官的残余核素活度
2.2 探针的细胞靶向性分析结果
放化纯度的测定显示99mTc的标记率在90%左右,说明标记良好。
H1299细胞对靶向探针的吞噬量要高于非靶向探针的吞噬量。游离多肽RGD的加入能够一定程度上抑制细胞对靶向探针的吞噬。对照组b、e和h显示,细胞对非靶向探针的吞噬量随时间增加。
游离多肽RGD的加入能与靶向探针竞争细胞表面的受体,抑制细胞对靶向探针的吞噬,在与游离多肽RGD共培养1小时,2小时与3小时后细胞对探针的吞噬从竞争组f、i来看没有明显差异。说明在短期内游离多肽RGD对靶向探针的抑制作用明显。
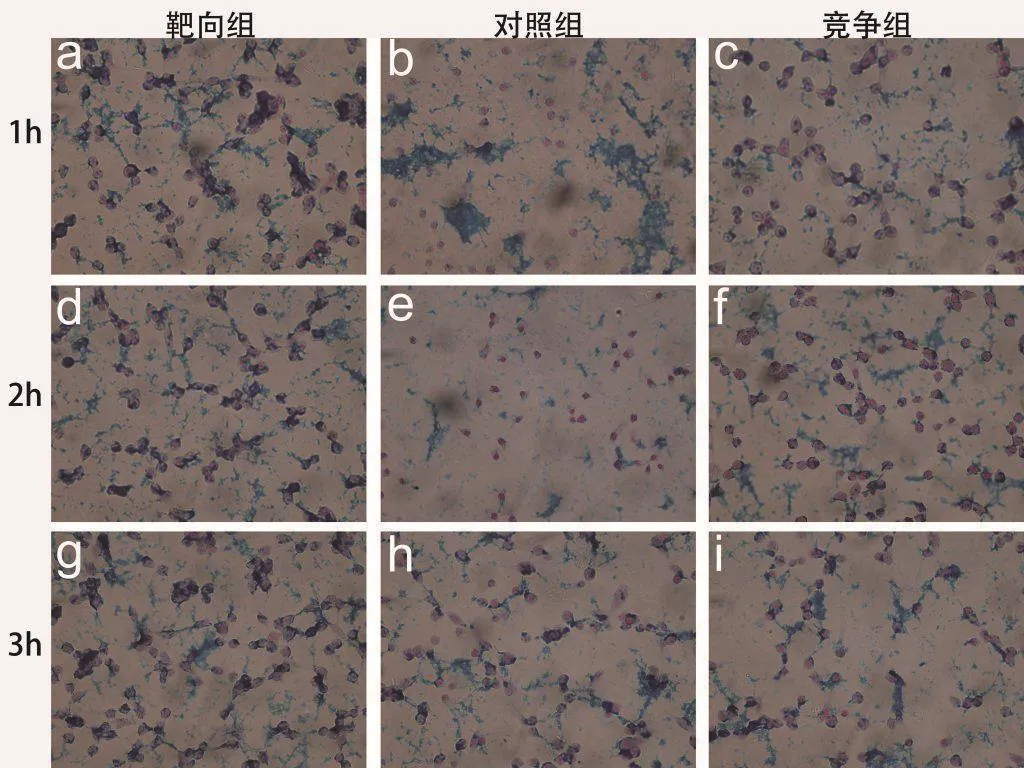
图3 H1299细胞与99mTc标记Fe3O4@PEG-DTPA-RGD探针在不同时间共培养下普鲁士蓝染色结果
2.3 SPECT/CT成像结果及分析
在注射探针1小时后,靶向组(图4a)可看出肿瘤部位。竞争组(图4d)中能看出肿瘤部位,该肿瘤中心已经坏死,而且探针主要分布在肿瘤的表面。在注射探针三小时后,靶向组(图4c)的肿瘤部位在图中没有显示。而在竞争组(图3d)中肿瘤的中心部位有少量探针,说明随着时间的增加,探针随着体内代谢而排出体外。
由表1可以看到99mTc标记Fe3O4@PEGDTPA-RGD探针在肝、肾、肺部积蓄较多。说明当探针注射到体内后,被肝脏吞噬较多。
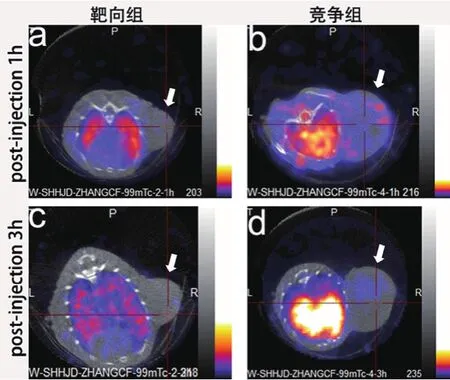
图4 99mTc标记Fe3O4@PEG-DTPARGD探针在裸鼠SPECT/CT成像图
2.4 MRI成像结果及分析
图5显示出,靶向组、竞争组和对照组之间的成像有差异,尤其是在T2加权成像中,在靶向组f图中出现的黑色区域是三组中最广的,竞争组g图其次,对照组h最少。说明99mTc标记Fe3O4@PEGDTPA-RGD探针能在肿瘤部位富集,提高了信号强度,有一定的靶向性。比较靶向组与Pre-injection的图片,b图中的肿瘤部位比a图中的肿瘤部位亮度要高;f图中的肿瘤部位比e图中的肿瘤部位的边缘部位要暗。在f、g和h图中,肿瘤部位出现不同程度的暗区,说明该探针具有较好的T2成像效果。在b图和d图中肿瘤的边缘部位的亮度有稍有加强,T1成像效果也很明显,99mTc标记Fe3O4@PEG-DTPA-RGD探针具有T1造影潜能。
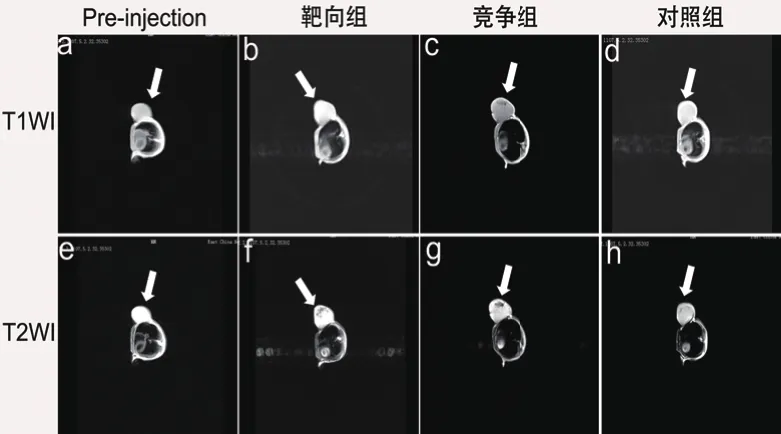
图5 99mTc标记Fe3O4@PEG-DTPARGD探针在裸鼠MRI成像图
3 讨论
制备的99mTc标记Fe3O4@PEG-DTPA-RGD双模态探针,通过修饰纳米颗粒,在表面偶联上共聚物等高分子材料与现有的小分子造影剂相比,其有着更高的体内安全性和检测灵敏度,已成为构建新型MRI造影剂的首选材料[7]。
多肽RGD能够与细胞表面的αvβ3受体特异性结合,并通过整合素-亲和素强相互作用被细胞吞噬。游离多肽RGD的加入能够一定程度上抑制细胞对靶向探针的吞噬[8],这种竞争作用在短时间内作用明显,在较长时间内的竞争作用还需验证。
在体内肿瘤成像实验中,探针的靶点主要是新生血管内皮细胞。新生血管内皮细胞表面表达αvβ3受体,在SPECT/CT成像以及MRI成像中,肿瘤边缘的信号强于肿瘤的中心区域,说明新生血管在肿瘤内部分布不均匀,边缘新生血管丰富而内部缺血,细胞大量坏死[9-10]。ID/g%的分布实验同样也证明了靶向探针具有良好的靶向性,能在肿瘤部位富集。
在MRI成像中,纵向弛豫时间T1、横向弛豫时间T2是基本物理量,能定量反映组织弛豫特性。在主磁场固定的情况下,组织的弛豫特性基本稳定。通过测量肿瘤组织弛豫时间可以定量的评价肿瘤组织特性,有助于肿瘤的诊断以及评估患者的疗效和预后[11]。磁共振造影剂在靶组织内大量聚集,提高水中质子的弛豫速率,从而增强正常与病变组织之间的磁共振信号对比度,提高成像分辨率,可分为T1造影剂和T2造影剂[12]。T1造影剂可以提供亮信号,超顺磁性氧化铁纳米颗粒(SPIOs)是经典的T2造影剂,它的最大的缺点在于其固有的阴性造影效果和磁敏感伪影,T1-T2双模成像策略在这一需求下应运而生,力求提供互补的成像信息以提高诊断的精确性。磁性纳米颗粒不仅具有优良的磁学性质,也具有良好的的生物安全性和表面可修饰性,因此基于磁性纳米颗粒的双模造影剂已成研究热点[13-14]。
本实验三个组在注射探针后T2加权成像中,肿瘤边缘部位均出现不同程度的暗斑,说明探针能作为T2造影剂。在T1加权成像中,肿瘤的边缘部位比在探针注射前亮度有所提升。因此,制备的99mTc标记Fe3O4@PEG-DTPA-RGD双模态探针既具备T2造影能力,又具有T1造影潜能。同时,其新颖的结构为双模造影剂的设计提供了新思路。
[参考文献]
[1] Portney NG,Ozkan M.Nano-oncology:drug delivery,imaging,and sensing[J].Anal Bioanal Chem,2006, 384(3):620-630.
[2] Liu Z,Kiessling F,Gtjens J.Advanced nanomaterials in multimodal imaging:design, functionalization and biomedical applications[J].Journal of Nanomaterials,2010,(1):51-57.
[3] 周晖,吴俊娇,范洁琳.多模态分子影像技术应用于肿瘤的研究进展[J].中国医学影像学杂志,2011,19(10):794-796.
[4] Xie H,Zhu Y,Jiang W,et al.Lactoferrin-conjugated superparamagnetic iron oxide nanoparticles as a specific MRI contrast agent for detection of brain glioma [5] Sun N,Chen DX,Gu HC,et al.Experimental study on T2 relaxation time of protons in water suspensions of iron-oxide nanoparticles: waiting time dependence. Journal of magnetism and magnetic materials [J].2009,321(18):2971-2975. [6] Lee S,Chen X.Dual-modality probes for in vivo molecular imaging[J].Molecular imaging,2009,8(2):87-91. [7] 乔瑞瑞,曾剑锋,贾巧娟,等.磁性氧化铁纳米颗粒-通向肿瘤磁共振分子影像的重要基石[J].物理化学学报,2012,28(5):993-1011. [8] Liu TH,Chang G,Cao RJ,et al.Applications of superparamagnetic Fe3O4 nanoparticles in magnetic resonance imaging[J].Progress in Chemistry,2015,27(5):601-613. [9] Su HY,Wu CQ,Li DY,et al.Self-assembled superparamagnetic nanoparticles as MRI contrast agents [J].Chinese Physics B,2015,24(12):891-895. [10] Sapsford KE,Algar WR,Berti L,et al.Functionalizing Nanoparticles with Biological Molecules: Developing Chemistries that Facilitate Nanotechnology[J].Chemical reviews,2013,113(3):1904-2074. [11] 古冬连,金观桥,苏丹柯.磁共振弛豫时间T1、T2的测量方法及其在肿瘤中的应用价值[J].广西医学,2017,39(5):686-688. [12] 黄国明.基于磁性纳米材料的高性能磁共振成像造影剂的合成及生物医学应用研究[D].厦门大学,2014. [13] 王巧英,曾晓霞,祝青,等.磁共振造影剂的研究进展[J].现代生物医学进展,2013,13(16):3186-3189. [14] Liu W,Dahnke H,Rahmer J,et al.Ultrashort T2* relaxometry for quantitation of highly concentrated superparamagnetic iron oxide (SPIO) nanoparticle labeled cells[J].Magnetic Resonance in Medicine Official Journal of the Society of Magnetic Resonance in Medicine,2010,61(4):761-766. [15] Scharlach C,Warmuth C,Schellenberger E.Determination of blood circulation times of superparamagnetic iron oxide nanoparticles by T2* relaxometry using ultrashort echo time (UTE) MRI [J].Magnetic Resonance Imaging,2015,33(9):1173-1178.
