超高效液相色谱-串联质谱法快速测定火锅底料中的5种罂粟壳生物碱残留
2018-05-10李兴根乔勇升冯寅洁
李兴根,乔勇升,陈 伟,冯寅洁,朱 渊,胡 慧
(1.泰州市产品质量监督检验院,江苏 泰州 225300;2.泰州市食品药品检验所,江苏 泰州 225300)
罂粟壳为罂粟科植物罂粟(Papaversomniferum)采完鸦片后的干燥成熟果壳,含有20多种生物碱,其中以吗啡(Morphine)、可待因(Codeine)、那可丁(Narcotine)、罂粟碱(Papaverine)、蒂巴因(Thebaine)等为主要成分[1]。由于罂粟壳的易成瘾性,国内部分不法商贩将其加入火锅底料、小吃调料等食品中,以达到吸引消费者的目的。消费者长期食用含有罂粟壳的食物容易成瘾,还会对人体神经系统造成损害,并可能造成慢性中毒[2]。鉴于其危害,2008年中国卫生部将罂粟壳列于《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批)》[3]中,禁止在食品中违法添加,并对其进行严格监管。
目前,测定罂粟壳生物碱的方法主要有分光光度法[4]、薄层色谱法[5]、气相色谱法[6-7]、高效液相色谱法[8-9]、气相色谱-质谱联用法[10-11]和液相色谱-质谱联用法[12-17]。国内针对罂粟壳生物碱的检测标准仅有上海市地方标准DB31/2010-2012[18],该标准使用QuEChERS方法对样品进行提取净化,液相色谱-串联质谱法测定分析。该方法需两步提取净化,并且针对成分复杂的火锅底料或调味料样品,经过两个步骤的提取净化后,部分样品仍颜色较深,净化效果不理想。由于火锅底料含有较多的脂肪和磷脂,极大地干扰目标化合物的分析,因此,有效去除脂肪和磷脂是前处理的关键。本文使用对脂肪类物质有较好净化作用的Oasis PRiME HLB固相萃取小柱,采用通过式净化方式去除样品中干扰物,获得了理想的净化效果,使样品前处理过程更加简便省时,适合大批量的日常分析检测。
1 实验部分
1.1 仪器、试剂与材料
ACQUITY UPLC H-Class超高效液相色谱仪、Waters Xevo TQ-S三重四极杆质谱仪(美国Waters公司),Allegra 64R冷冻台式高速离心机(美国Beckman Coulter公司),Milli-Q Reference 超纯水机(美国Millipore公司),XS204型电子分析天平,感量为0.000 01 g(瑞士Mettler Toledo公司),JP-100超声波清洗器(深圳市洁盟清洗设备有限公司)。
吗啡、可待因、蒂巴因、罂粟碱和那可丁5种生物碱混合标准溶液购自美国O2si smart solutions公司(质量浓度分别为50.5、50.15、10.04、9.987、10.08 mg/L,批号271423)。甲醇、乙腈(色谱纯,西班牙Scharlau公司),甲酸、乙酸铵(LC MS级试剂,美国Anaqua公司),氨水(分析纯,国药集团化学试剂有限公司)。Oasis PRiME HLB固相萃取柱(6 mL,200 mg,美国Waters 公司)。尼龙针式滤膜(0.22 μm,天津津腾公司)。氮气、氩气(>99.999%)。实验所用样品来源于流通和餐饮市场。
1.2 标准溶液的制备
生物碱混合标准溶液于-18 ℃冷冻保存,使用前以空白基质提取液稀释配制成浓度合适的混合标准工作溶液,置于棕色瓶中,4 ℃冰箱中保存备用。
1.3 实验条件
1.3.1色谱条件色谱柱:Waters ACQUITY UPLCTMBHE C18柱(1.7 μm,2.1 mm×50 mm);流动相:A:乙腈,B:氨水溶液(pH 8.0)。梯度洗脱程序:0~1.0 min,8%A;1.0~1.2 min,8%~35%A;1.2~2.4 min,35%~70%A;2.4~2.5 min,70%~90%A;2.5~3.9 min,90%A;3.9~4.0 min,90%~8%A;4.0~5.0 min,8%A。进样量10 μL,柱温30 ℃,流速0.3 mL/min。
1.3.2质谱条件离子源:电喷雾离子(ESI)源;正离子模式;毛细管电压:3.0 kV;离子源温度:120 ℃;脱溶剂气温度:300 ℃;RF透镜电压:0.5 V;脱溶剂气流速:600 L/h;锥孔气流速:50 L/h;采集模式:MRM采集,其他参数见表1。

表1 5种罂粟壳生物碱的质谱参数Table 1 MS-MS conditions for five alkaloids of poppy husk
*quantification ion
1.4 样品前处理
称取均质后样品2 g(精确至0.01 g)于50 mL离心管中,加入20 mL含0.2%甲酸的乙腈,旋涡混合30 s,超声提取5 min,在5 000 r/min下离心5 min。取上清液2 mL过 PRiME HLB小柱,5 mL乙腈洗净小柱残留,吹干柱床收集全部滤液。滤液经氮气吹干后加入2 mL含0.1%甲酸的乙腈-水(50∶50,体积比)溶解残渣,过0.22 μm有机相滤膜,待测。
空白基质提取液的配制:根据配制标准工作曲线的使用量,称取适量空白基质样品,按上述步骤处理,得到的空白基质提取液用于标准工作曲线配制。
2 结果与讨论
2.1 质谱条件的优化
采用直接进样方式,在电喷雾正离子模式下分析吗啡、可待因、蒂巴因、罂粟碱、那可丁5种生物碱,通过优化锥孔电压、碰撞能量等仪器参数,选取丰度高、干扰小的子离子作为定性、定量离子,建立多离子反应监测(MRM)方法。5种生物碱的母离子、子离子、锥孔电压、碰撞能量等质谱参数见表1。
2.2 色谱条件的优化
5种生物碱分子结构各不相同(图1),其极性差异较大。吗啡和可待因的分子结构式非常相似,二者的差异仅在与苯环相连的1个基团(羟基,甲氧基),酚羟基的存在使吗啡和可待因易溶于水,而极性较弱的罂粟碱在水中略溶,蒂巴因、那可丁则几乎不溶于水。由于分子结构中两个酚羟基的存在,使得吗啡在5种生物碱中极性最强。实验发现在酸性流动相条件下,吗啡在普通C18色谱柱上无保留。本研究尝试在中性或碱性条件下分离,参考已报道的文献[12,15],选择两种流动相进行比较,一种流动相为10 mmol/L乙酸铵水溶液(pH 7.0)和乙腈,另一种流动相为pH 8.0氨水溶液和乙腈。5种生物碱在两种流动相体系中分别使用Waters UPLC HSS T3(1.7 μm,2.1 mm×50 mm)和Waters BHE C18色谱柱(1.7 μm,2.1 mm×50 mm)进行分离。
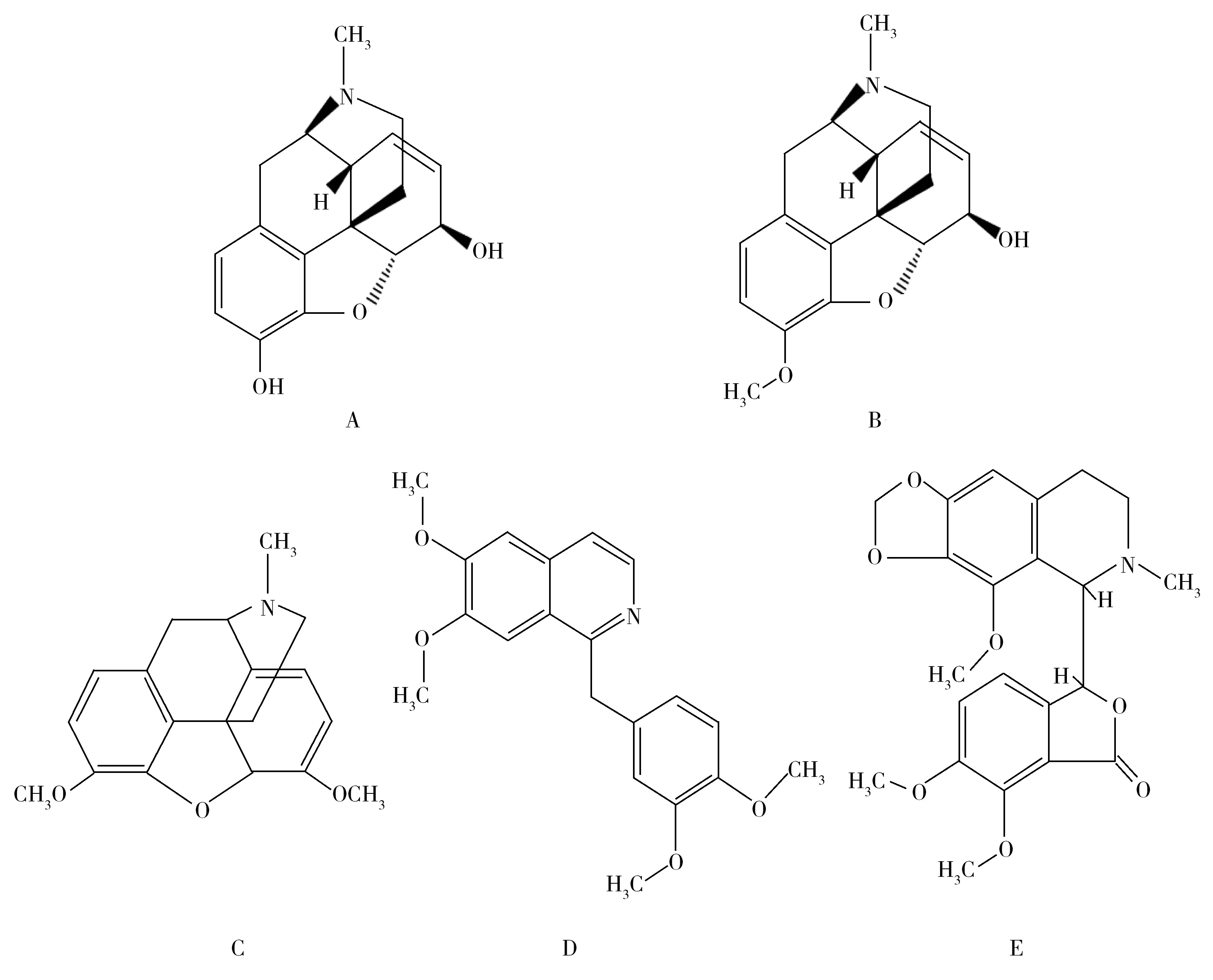
图1 罂粟壳中5种生物碱的化学结构Fig.1 Chemical structures of five alkaloidsA.morphine,B.codeine,C.narcotine,D.papaverine,E.thebaine
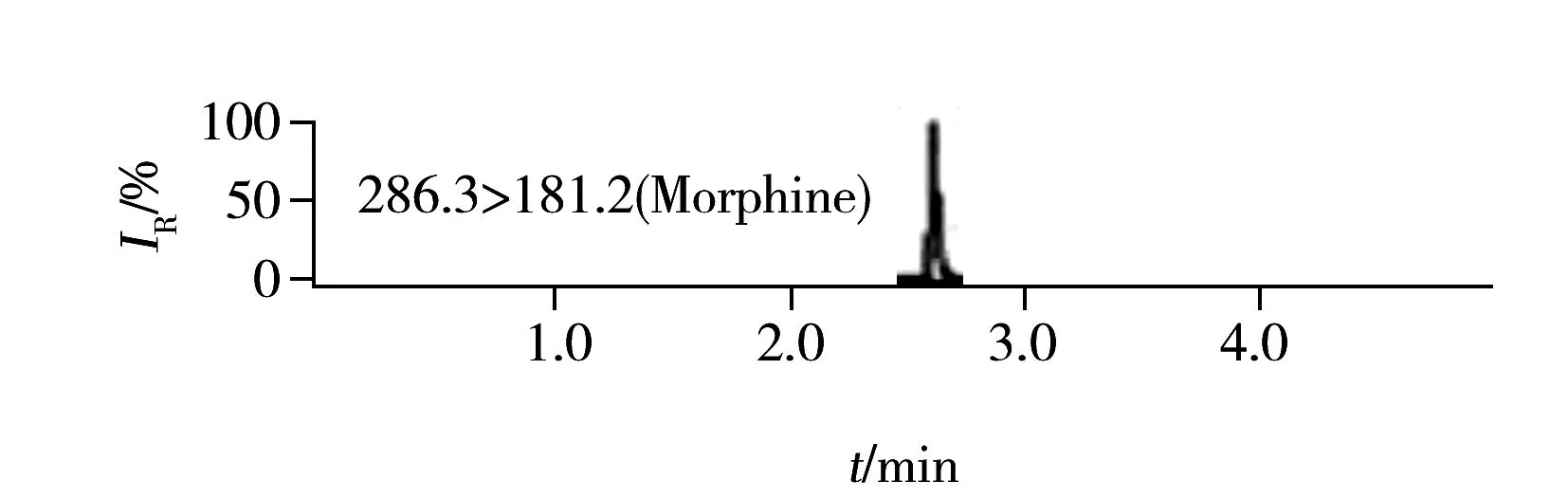
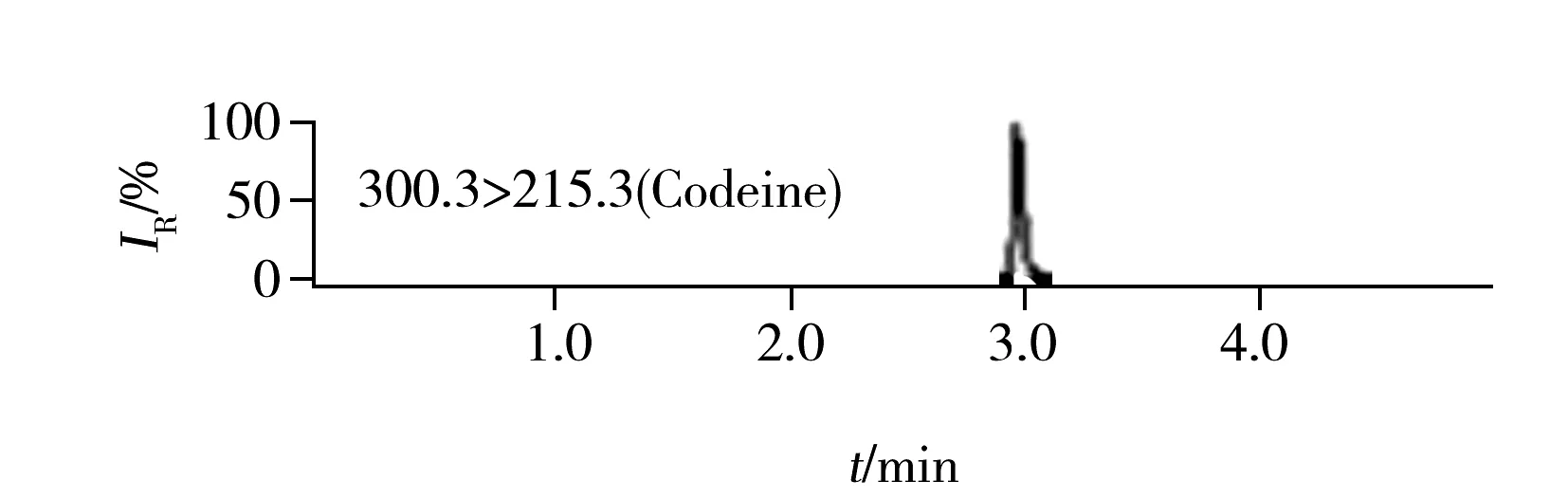



图2 5种罂粟壳生物碱混合标准溶液(罂粟碱、那可丁、蒂巴因浓度10 μg/L,吗啡、可待因浓度50 μg/L)的定量离子色谱图Fig.2 Quantitative ion chromatograms of five alkaloids of poppy husk in a standard solution(the concentrations are 10 μg/L for papaverine,narcotine,thebaine and 50 μg/L for morphine,codeine)
实验发现5种生物碱在弱碱性流动相中的色谱峰峰形更好,电离信号强度较高,吗啡和可待因的信号强度甚至有5倍以上的差距。但5种生物碱在弱碱性流动相中电离信号强度的增加降低了方法的检出限,也导致罂粟碱和那可丁在浓度较高时标准曲线弯曲,线性范围较窄,只能在0.05~10 μg/L内保持良好线性关系,实际工作中需将阳性样品浓度调整到标准曲线范围内进行测定。在弱碱性流动相中,使用HSS T3或C18色谱柱均能得到理想的分离效果。综合考虑,最终选择pH 8.0氨水溶液和乙腈作为流动相,使用Waters BHE C18色谱柱分离,并优化了梯度洗脱程序、流速、柱温等色谱参数,确定了最佳的色谱条件,5种生物碱的定量离子色谱图如图2所示。
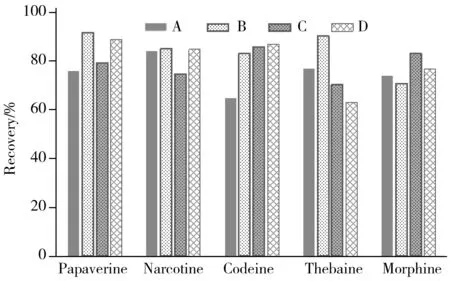
图3 5种罂粟壳生物碱在采用不同提取溶剂时的提取效率Fig.3 Extraction efficiencies of five alkaloids of poppy husk with different solventsA:acetonitrile-water(80∶20) containing 0.2% formic acid;B:acetonitrile containing 0.2% formic acid; C:acetonitrile-water(80∶20);D:acetonitrile
2.3 净化方法的选择
由于火锅底料成分复杂,其中含有大量油脂、蛋白质、盐类及其他种类繁多的香辛调味料成分,这些组分的存在会干扰目标化合物的测定,同时缩短色谱柱寿命,因此对提取液进行有效净化成为前处理的关键步骤。目前,针对罂粟碱等生物碱的前处理常采用MCX固相萃取柱法[14-15]和基质分散固相萃取法[12-13,16-17],上海地方标准DB31/2010-2012[18]采用后者进行处理。实验发现,基质分散固相萃取法操作较为简便,但经其净化所得的滤液常呈深或浅偏黄的颜色,针对成分复杂的火锅底料样品不能获得满意的净化效果。而MCX固相萃取柱除油脂效果不理想且操作较繁琐。由于生物碱在酸性条件下形成盐类易溶于水,本实验尝试采用酸性乙腈水溶液提取样品中的生物碱,并使用对脂肪蛋白质有吸附作用的PRiME HLB固相萃取小柱进行净化,发现5种罂粟壳生物碱在此柱上均不被吸附,可以使用通过式策略进行净化,并获得了满意的净化效果,缩短了检测周期,且操作更为简便。
2.4 提取溶剂的选择
由于5种生物碱极性差异较大,本文比较了含0.2%甲酸的乙腈-水(80∶20)、含0.2%甲酸的乙腈、乙腈-水(80∶20)、纯乙腈4种提取溶剂对生物碱的提取效率,结果如图3所示。
由图3可知,对于几乎不溶于水的蒂巴因和那可丁,使用含0.2%甲酸的乙腈作为提取溶剂时提取效率最高;对于略溶于水的罂粟碱,纯有机溶剂的提取效率高于乙腈-水(80∶20)的提取效率,含0.2%甲酸乙腈的提取效率最高;而对于易溶于水的可待因和吗啡,不添加甲酸的乙腈和乙腈-水(80∶20)能获得更高的提取效率。5种罂粟壳生物碱的提取效率受其极性影响很大,考虑到罂粟碱等生物碱在酸性条件下形成盐类更稳定,本实验选择含0.2%甲酸的乙腈作为生物碱的提取溶剂。
2.5 基质效应
使用LC-MS/MS法对成分复杂的样品进行痕量分析时,基质效应是不容忽视的问题[19]。火锅底料中含有油脂、蛋白质、盐及香辛调味料等,成分复杂,这些杂质的存在会影响测定结果的精密度和准确度。本文分别采用初始流动相和空白基质提取液配制生物碱标准曲线,考察了基质效应的影响。结果表明,当采用空白基质提取液配制标准曲线时,5种生物碱普遍存在基质抑制效应。为使定量分析更准确,实际检测中采用空白基质提取液配制曲线以降低基质效应的影响。
2.6 方法学验证
2.6.1线性关系采用空白基质提取液制备系列混合标准工作液,在本方法确定的实验条件下进行UPLC-MS/MS分析。以质量浓度(x,μg/L)为横坐标、定量离子峰面积(y)为纵坐标绘制标准曲线,得到回归方程与相关系数(见表2)。结果表明,那可丁、罂粟碱在本实验条件下的质谱灵敏度很高,但线性范围较窄,只能在0.05~10 μg/L范围内保持良好线性关系(r≥0.999 7),吗啡、可待因在0.25~100 μg/L范围内保持良好线性关系(r≥0.999 0),蒂巴因在0.05~100 μg/L范围内保持良好线性关系(r≥0.999 8)。
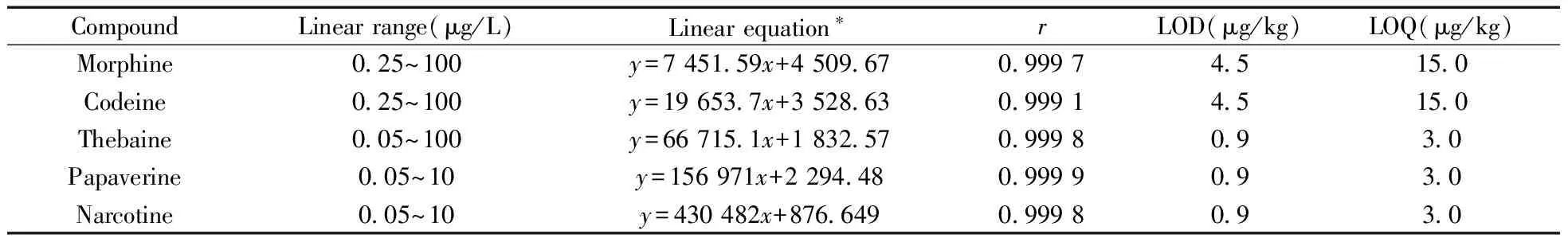
表2 5种生物碱的线性范围、线性方程、相关系数(r)、检出限和定量下限Table 2 Linear ranges,linear equations,correlation coefficients(r),limits of detection(LODs) and limits of quantitation(LOQs)of five alkaloids in poppy husk
*y:peak area;x:mass concentration(μg/L)
2.6.2检出限与定量下限采用在空白基质样品中添加生物碱标准物质的方法,设定目标物质定量离子色谱峰的检出限(LOD,S/N=3)和定量下限(LOQ,S/N=10),得出吗啡和可待因的LOD为4.5 μg/kg,LOQ为15.0 μg/kg,罂粟碱、蒂巴因、那可丁的LOD为0.9 μg/kg、LOQ为3.0 μg/kg,结果如表2所示。
2.6.3回收率与精密度在超市购置火锅调味底料样品,选取经测定不含待测组分的空白基质样品,添加3个浓度水平的混合标准工作液进行回收率试验,每个浓度水平重复测定5次[20],以基质空白工作曲线进行定量,计算方法的回收率及精密度(以相对标准偏差表示),结果见表3。
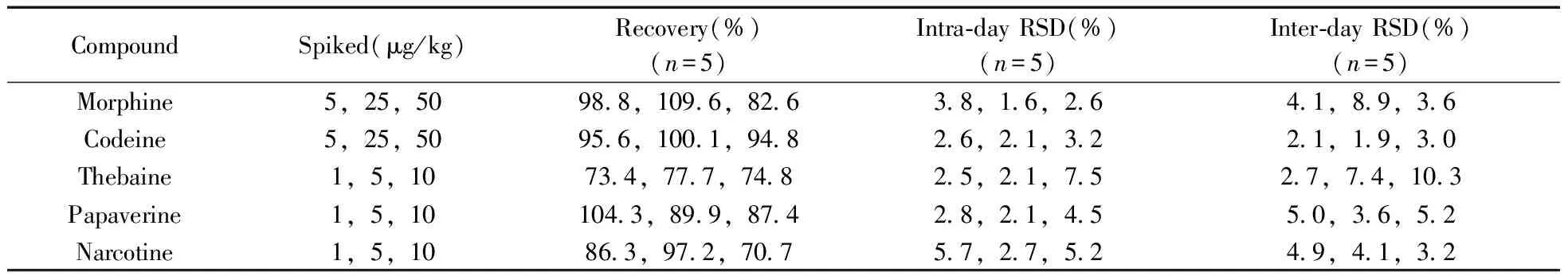
表3 火锅底料中5种生物碱的加标回收率和日内、日间相对标准偏差Table 3 Recovery,intra-day and inter-day precisions for five alkaloids in hot pot soup
由表3可知,在3个加标浓度水平下,生物碱的平均回收率为70.7%~109.6%,日内精密度为1.6%~7.5%,日间精密度为1.9%~10.3%。
2.7 实际样品检测
分别利用本研究建立的SPE/UPLC-MS/MS分析方法和DB31/2010-2012标准规定的方法对流通市场抽取的火锅底料及卤菜汤料样品进行测定,均未检出上述5种罂粟壳生物碱,未来将进一步扩大检测范围,加强监管。
3 结 论
本文采用PRiME HLB固相萃取柱净化火锅底料调味品,并对色谱和质谱检测条件进行优化,建立了同时测定吗啡、可待因、蒂巴因、罂粟碱和那可丁的UPLC-MS/MS方法。该方法前处理操作简便、灵敏度高,适合对大批样品的快速筛查检测。同时,本方法针对食品非法添加物的检测也具有一定的参考价值。
参考文献:
[1] Chen W,Qiao Y S,Dong G J.Sci.Technol.Cereals,OilsandFoods(陈伟,乔勇升,董贵军.粮油食品科技),2015,(6):89-91.
[2] Lu M L,Zhao C C,Cai J R,Zhao X L.Chin.J.HealthLab.Technol.(陆茂林,赵春城,蔡建荣,赵晓联.化学进展),2005,17(5):897-904.
[3] The list of Non-edible Substance and Abused Food Additives Which May be Illegal Added in Foods(First Batch)(食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批))[2008-12-15].http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsjdj/s3594/200812/38511.htm
[4] Zhang C Y.Chin.HealthLab.Technol.(张朝云.中国卫生检验杂志),1996,6(1):53-54.
[5] Tu X M.J.Environ.Health(涂晓明.环境与健康杂志),1992,9(Suppl.1):373-374.
[6] Li Y F,Fu Y H,Hou X Y.Chin.J.HealthLab.Technol.(李永芳,付耀华,侯晓燕.中国卫生检验杂志),2000,10(1):38-40.
[7] Qin Q F,Liu S L,Yang S L.J.Prevent.Med.Inf.(秦启发,刘守亮,杨素林.预防医学情报杂志),2002,18(2):187-188.
[8] Pi L,Hu F Z,Shi Z X.Chin.J.Chromatogr.(皮立,胡凤祖,师治贤.色谱),2005,23(6):639-641.
[9] Xin H H,Wang T X,Zhu L J,Zhang X Y,Wang Y.Chin.FoodAddit.(信海红,王庭欣,朱路甲,张晓宇,王羽.中国食品添加剂),2012,(4):250-252.
[10] Wang L L,Liu Z.Mod.Prevent.Med.(王莉莉,刘仲.现代预防医学),2005,32(1):51.
[11] Zhang Y P,Liao H L,Xiao B,Chen Z.J.Hyg.Res.(张艳萍,廖华乐,肖兵,陈湛.卫生研究),2011,40(4):512-513.
[12] Yang J,Wang Z,Zhang H Z,Zhai S X,Yu Z,Zhang F Y,Yin J Y,Wang X B.FoodSci.(杨洁,王智,张辉珍,翟士星,于宙,张凤艳,殷冀煜,王晓斌.食品科学),2014, 35(22):243-246.
[13] Wang K,Zheng R,Jian L H,Mao D,Ji S.Chin.J.HealthLab.Technol.(王珂,郑荣,简龙海,毛丹,季申.中国卫生检验杂志),2011,21(2):363-365.
[14] Wang L Q,Li M H,Li J Q,Chen H T, Fan Y,Zhao D X.FoodFerment.Ind.(王力清,郦明浩,李锦清,陈洪涛,樊垚,赵丹霞.食品与发酵工业),2012,38(8):168-172.
[15] Liao W J,Zhang H,Ren Y P.Chin.J.Anal.Chem.(廖文娟,张虹,任一平.分析化学),2006,34(8):1175-1178.
[16] Mao D,Jian L H,Zheng R,Wang K,Ji S.J.Environ.Health(毛丹,简龙海,郑荣,王珂,季申.环境与健康杂志),2012,29(1):88.
[17] Liu M M,Zhang C Z,Li Y Z,Wen J X.FoodRes.Dev.(刘敏敏,张朝正,李延志,温家欣.食品研究与开发),2013,34(1):91-94.
[18] DB31/2010-2012.Food Safety Local Standard-Determination of Papaverine,Morphine,Codeine and Thebaine,Noscapine in Hot Pot Soup Liquid Chromatography-Mass Spectrometry.Local Standards of Shanghai City(食品安全地方标准-火锅食品中罂粟碱、吗啡、那可丁、可待因和蒂巴因的测定 液相色谱-串联质谱法.上海市地方标准).
[19] Xiang P,Shen M,Zhuo X Y.J.Instrum.Anal.(向平,沈敏,卓先义.分析测试学报),2009,28(6):753-756.
[20] Food and Drug Administration:U.S.Department of Health and Human Services.(2003) Guidance for Industry,Bioanalytical Method Validation.FDA,www.fda.gov/cder/guidance/4252fnl.pdf.Date accessed 30 October 2011.
