3种手术方式治疗脾功能亢进症的临床对比分析
2018-05-10杜慧敏陈晓品
朱 婧,朱 辉,杜慧敏,陈晓品,张 涛△
(1.重庆医科大学附属第一医院肿瘤科 400016;2.重庆医科大学附属第二医院海扶肿瘤中心 400014)
脾功能亢进症(简称脾亢)是临床上常见的综合征,以门静脉高压引起的脾亢最为常见。主要表现为脾脏肿大、一种或多种血细胞减少,并常出现皮肤黏膜出血、左上腹胀痛、乏力以及反复的感染等[1]。脾亢的传统治疗主要是对症治疗和脾切除术,但对症治疗疗效有限,外科脾切除术可以消除脾亢引起的血细胞的破坏,然而,脾切除术往往伴有机体免疫功能的下降,易并发感染,并易引起原有侧支循环再出血以及脾静脉栓塞等并发症。另外,目前的研究认为,脾脏具有抗感染与抗肿瘤的重要免疫功能。因此,保留部分脾脏成为脾亢治疗的一种趋势,微创及无创技术迅速兴起。
随着介入影像学的发展,部分性脾动脉栓塞术(partial splenic embolization,PSE)逐渐成为治疗脾亢较为成熟的方式。PSE术后机体仍然维持正常的免疫和破血功能,避免了脾切除后潜在感染和高黏滞血症的危险。此外,PSE也能够提高患者的肝功能及预后,扩大脾亢治疗的适应证,因其独特而良好的疗效,已经成为治疗各种原因所致脾亢的主要方法之一[2]。但PSE并发症较多,如继发感染、脾脓肿、脾囊肿、发烧、疼痛等,因此,局部消融治疗如射频消融术、冷冻、微波、高强度聚焦超声(high intensity focused ultrasound,HIFU)等用于治疗脾亢越来越广泛[3-14]。其中,最受关注的是射频消融术,但由于脾脏组织本身的脆弱性以及肝硬化后脾脏高动力的血流学特点,在穿刺过程中和穿刺后很容易出现脾破裂出血的风险。与射频消融相比,近年来兴起的体外HIFU用于治疗脾亢理论上具有更好的优势。HIFU的治疗原理是利用超声波具有生物组织内可穿透性及能量沉积性的特点,通过超声聚焦换能器将超声能量聚焦于靶组织,通过超声的热效应使该处组织的温度瞬间(0.5~1 s)上升至60~100 ℃,从而导致蛋白变性及组织凝固性坏死;同时通过空化、机械作用等生物学效应,杀死靶区内的肿瘤细胞。HIFU技术目前已广泛应用肝癌、乳腺癌、子宫肿瘤等良恶性肿瘤,随着HIFU适应证的扩大,HIFU的非肿瘤适应证得到了逐步的拓宽,如脾亢[12-14]。 因此,脾脏切除术、 PSE和HIFU分别代表着治疗脾亢的传统、成熟和最新的治疗方式,本研究对比分析脾切除术、PSE和HIFU治疗脾亢患者的临床资料,现报道如下。
1 资料与方法
1.1一般资料 随机选择重庆医科大学附属第一医院、重庆医科大学附属第二医院2006年1月至2016年1月进行了外科脾脏手术切除、PSE以及HIFU治疗脾亢的患者,每组20例。其中,脾脏手术切除组男13例,女7例,中位年龄49岁,患者入院时肝功能分级(Child-Pugh)A级18例,B级2例,C级0例;PSE组男14例,女6例,中位年龄52岁,患者入院时肝功能分级为A级17例,B级3例,C级0例;HIFU组男12例,女8例,中位年龄54岁,患者肝功能分级为A级11例,B级8例,C级1例。
术前均经B超和MRI证实为肝硬化引起不同程度的门静脉高压,合并重度脾亢并导致外周血象明显下降[血红蛋白(Hb)<8 g/dL,白细胞(WBC)<3.5×109/L,血小板(PLT)<1.5×109/L],且有不同程度的贫血、乏力、反复牙龈出血、皮下淤血、腹胀等临床表现。脾脏切除术的适应证包括:(1)门静脉高压伴随严重的脾肿大或脾功能亢进;(2)肝功能良好,持续、稳定高于Chid-Pugh B级;(3)胰腺门脉高压;(4)无或只有轻微的重要器官损伤。PSE的适应证包括:(1)由各种原因引起的脾功能亢进;(2)门脉高压合并食管胃底静脉曲张;(3)没有严重的腹部脏器损害或腹腔感染。HIFU治疗脾亢的适应证更为广泛,Chid-Pugh C级的患者仍可谨慎考虑。治疗方式的选择主要基于临床判断、医疗条件和患者的意愿。
1.2治疗方法
1.2.1脾脏切除术 取左肋缘下切口进腹,结扎脾动脉主干,离断脾胃、脾肾和脾膈韧带,取出脾脏予以切除。手术要点包括切断和结扎脾周围的血管和韧带、注意保护相邻器官和组织避免损伤和出血、妥善处理副脾以及精细的术后治疗、护理等。
1.2.2PSE 在严格的无菌条件下,采用Seldinger法经皮穿刺右股动脉,置入5F导管鞘,经导管鞘引入5F的脾动脉导管至脾动脉主干,进一步超选插管至脾动脉主干远端,以避开胰背动脉和胃短动脉防止误栓胰腺。然后进行脾动脉造影(DSA)显示脾脏动脉期、毛细血管期和静脉期。经导管注入混有造影剂和适当抗生素的1~2 mm3明胶海绵颗粒进行栓塞治疗,缓慢栓塞避免回流。治疗终点是至少达到50%的脾栓塞面积。
1.2.3HIUF 采用JC型聚焦超声肿瘤治疗系统(重庆海扶技术有限公司),所有患者全身麻醉后,对治疗区皮肤脱脂、脱气,固定患者体位,主要以左侧后倾卧位为主。以机载诊断超声确定脾脏的位置、大小、形态、与邻近器官的关系,治疗计划区域主要是脾门及脾脏中下方区域,依据治疗计划确定治疗靶区,在诊断超声实时引导、监测下,通过超声引导的HIFU由点到线到面到体、由深到浅消融靶区内的各个层面,脾脏治疗靶组织回声明显增强后停止治疗,消融至整个计划治疗靶区被覆盖,脾脏HIFU治疗参数:治疗频率0.85 MHz,焦距140 mm,曲面直径200 mm,治疗功率300~400 W,治疗时间1 000~7 000 s。

2 结 果
2.1手术时间、住院时间及术中出血量 3个治疗组均成功完成治疗,脾切除术组和HIFU组的手术时间分别为(119.7±49.89)min和(131.1±30.48)min,差异无统计学意义(P>0.05),脾切除术组和HIFU组的手术时间均超过PSE组(30.2±8.26,P<0.01)。3组治疗过程中,仅脾切除术组会发生术中出血,出血量为(482.6±348.5)mL。经治疗后,脾切除术组有7例患者需要输血,PSE组有2例患者需要输血,HIFU组无输血病例。脾切除术组、PSE组与HIFU组的住院时间分别为(10.75±3.81)、(5.57±2.37)d和(8.32±3.54)d。
2.2术后并发症及随访 3个治疗组均无死亡病例,具体的术后并发症见表1。根据文献[15]将相关的并发症分为重度并发症和轻度并发症。重度并发症是指需要手术或介入治疗或延长术后住院时间(超过30 d)或需要重新住院的并发症,包括脾脓肿、脾破裂、肺炎、难治性腹腔积液、胸膜腔积液、消化道出血、肝性脑病和血栓形成。轻度并发症是指患者能够忍受或者仅需保守治疗的并发症,包括腹痛、发烧和打嗝等,轻度的并发症为暂时的,保守治疗后消失。本研究表明,与脾切除术组(n=5, 25%)和HIFU组(n=3,15%) 相比,PSE组更易发生重度并发症(n=7,35%)。

表1 3组患者的并发症发生情况(n)
2.3影像学检查 为了观察HIFU组与PSE组患者的脾脏消融或栓塞的效果,患者在术后2周进行腹部增强MRI或腹部CT扫描或腹部超声检查,PSE组患者脾脏栓塞信号在T1WI减少并在T2WI增加。而经HIFU治疗后的患者腹部增强MRI显示消融后的脾脏靶区组织在T1WI上无特异性,高、等、低信号区均代表凝固性坏死;在T2WI上,凝固性坏死则表现为低信号;增强扫描后靶区无强化,显示的病灶范围较T1WI和T2WI更为广泛。
2.4外周血细胞的变化 与治疗前相比,3组患者术后的WBC计数无明显改变(P>0.05),而在术后第1天、第1个月以及第6个月时,3组患者的WBC和PLT计数明显高于术前(P<0.01),脾切除术组和PSE组患者的外周血细胞增加更为明显,尤其是脾切除术组;HIFU组的外周血细胞增加更为稳定缓慢。3组之间的WBC和PLT计数差异有统计学意义(P<0.05)。
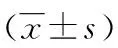
表2 3组手术方式患者的外周血细胞的变化
3 讨 论
在本研究中,没有患者出现治疗后死亡或脾切除术后暴发性感染(overwhelming postsplenectomy infection,OPSI)。结果表明,脾切除术和PSE患者外周血细胞的增加更为明显,尤其是脾切除术患者。然而,脾切除术组和PSE组患者更易发生并发症,在脾切除术组,并发症主要表现为腹痛、腹胀和伤口疼痛。1例患者发生了肝性脑病,经过治疗和监测后患者逐渐好转并痊愈。2例患者发生了血栓,血栓形成可能与异常的血小板及血液黏稠度增加有关,然而,血小板的变化并不能够预测患者是否会形成血栓,正常数量血小板的患者也可能发生血栓。当血小板上升过快时则有必要进行干预。因此,术后评估是非常重要的,外科脾切除术对于患者的选择有着更高的标准和要求。PSE的并发症主要是腹部疼痛和发烧,腹部疼痛主要是腹部左上象限的疼痛,可能是因为脾脏包膜的刺激引起,大多数患者可以忍受。胸腔或腹腔积液可能是由于膈膜的刺激以及脾脏栓塞后左胸及腹腔的炎症。PSE的并发症发生率与脾脏栓塞体积和大小有关,虽然目前关于PSE并发症发生率和栓塞面积之间的关系有部分研究,然而,仍然需要更多大样本、多中心、长期随访的临床研究,才能为脾亢患者提供最优的治疗方案。HIFU组的所有患者均能够耐受手术,没有出现死亡病例,未出现胃肠道穿孔、腹膜炎、脾破裂或脾脓肿等严重并发症,HIFU组患者的WBC、PLT缓慢上升,避免了脾静脉血栓形成和继发性血小板增多症等并发症。其他并发症包括腹痛、发热、胸腔或腹腔积液、治疗区域的皮肤淤斑。发热可能是脾脏消融后坏死物质的吸收引起,治疗区域的皮肤淤斑考虑与脾亢较为严重以及治疗时间过长有关。这些并发症是暂时性的,经保守治疗后消除。HIFU的并发症发生率远低于脾切除术和PSE。本研究中,甚至有1例Child-Pugh C级患者经HIFU治疗后症状好转。
在动物实验研究中,经HIFU消融的脾脏组织会出现凝固性坏死,血管闭塞,胶原变性以及血栓形成,坏死组织逐渐吸收、纤维化或包裹机化[12]。本研究显示患者经HIFU治疗后,MRI增强扫描显示消融区域无强化,靶区内血液供应减少或消失,提示局部组织的凝固性坏死和血流灌注障碍,在影像随访中,消融靶区逐渐缩小,脾脏体积缩小,坏死的脾脏组织被纤维组织所取代,由于纤维瘢痕收缩,使脾脏局部轮廓凹陷呈现分叶状。因此,从理论上来讲,HIFU可能更不容易出现感染性并发症。
在长期随访中,笔者观察到PSE组和HIFU组分别有2例和5例患者再次出现血细胞下降,鉴于PSE和HIFU的可重复性,对这类血细胞再次下降的患者可以重复实施PSE或HIFU治疗。患者再次出现血细胞下降的原因可能与手术栓塞或消融体积偏小、患者脾亢程度较重有关。在脾切除术组患者,笔者同样观察到2 例患者的血细胞再次下降,虽然传统脾切除术组发生血细胞再次下降的比例低于HIFU和PSE,但一旦发生,处理更为棘手,因此,医生和患者应该更加谨慎地选择脾切除术。治疗方式的选择取决于不同治疗方式的效果评价和安全性,脾切除术和PSE患者外周血细胞的增加更为明显,尤其是脾切除术,但是HIFU治疗更为安全。因此,对于低风险的脾亢患者,为了达到更好的治疗效果,脾切除术和PSE可以优先考虑,然而,对于高风险的脾亢患者可能不适合脾切除术和PSE,尤其是老年患者、严重肝硬化患者、较差的Child-Puge分级或有基础疾病的患者,应当首先考虑HIFU治疗。
经过回顾性分析表明,脾切除术、PSE、HIFU都是有效和安全治疗脾亢的方式,脾切除术效果最为明显,但是如果患者术后发生了严重的并发症,其处理更为棘手,尤其是再次复发的患者。PSE减少了手术时间和住院时间,但它具有较高的风险,更易出现并发症。目前,脾切除术和PSE是治疗脾亢和血小板减少更为普遍的选择,问题在于,他们是否是高风险患者的最佳治疗选择?HIFU有广泛的临床适应证,是治疗脾亢最新的替代方案,临床上往往被忽视。然而,HIFU是相对无创的,它对于患者有着更低的标准和要求,并且为脾亢患者提供更为安全的治疗。因此,HIFU对于高风险患者是一个不错的治疗选择。总而言之,脾亢的治疗应当遵守“个体化原则”,结合医疗条件和设备,医生应当进行综合的评估并作出最佳的治疗选择。在未来的研究中,进一步确定评估风险因素以及治疗标准是有必要的。
[1]LV Y,LAU W Y,LI Y,et al.Hypersplenism:History and current status[J].Exp Ther Med,2016,12(4):2377-2382.
[2]PECK M.Hypersplenism[J].Eur J Gastroenterol Hepatol,2001,13(4):317-323.
[3]DUAN Y Q,LIANG P.Thermal ablation for partial splenectomy hemostasis,spleen trauma,splenic metastasis and hypersplenism[J].Hepatogastroenterology,2013,60(123):501-506.
[4]MA K S,WU Q,LIU Q D,et al.Clinical research on radiofrequency ablation for hypersplenism[J].Zhonghua Wai Ke Za Zhi,2004,42:944-946.
[5]LIU Q,MA K,SONG Y,et al.Radiofrequency ablation for hypersplenism due to portal hypertension:clinical study surgery[J].Zhonghua Yi Xue Za Zhi,2008,143(4):509-518.
[6]HU K,LEI P,YAO Z,et al.Laparoscopic RFA with splenectomy for hepatocellular carcinoma[J].World J Surg Oncol,2016,14(1):196.
[7]MARTINS G L,BERNARDES J P,ROVELLA M S,et al.Radiofrequency ablation for treatment of hypersplenism:A feasible therapeutic option[J].World J Gastroenterol,2015,21(20):6391-6397.
[8]DUAN Y Q,GAO Y Y,NI X X,et al.Changes in peripheral lymphocyte subsets in patients after partial microwave ablation of the spleen for secondary splenomegaly and hypersplenism:a preliminary study[J].Int J Hyperthermia,2007(23):467-472.
[9]LIANG P,GAO Y,ZHANG H,et al.Microwave ablation in the spleen for treatment of secondary hypersplenism:a preliminary study[J].AJR Am J Roentgenol,2011(196):692-696.
[10]HA J,HENDRIX M,GUYER A G.Microwave ablation for the treatment of hypersplenism:short waves,low cost,big results[J].Dig Dis Sci,2016,61(1):6-7.
[11]JIANG X,GAO F,MA Y,et al.Percutaneous microwave ablation in the spleen for treatment of hypersplenism in cirrhosis patients[J].Dig Dis Sci,2016,61(1):287-292.
[12]SHI B,ZHU H,LIU Y J,et al.Experimental studies and clinical experiences on treatment of secondary hypersplenism with extracorporeal high-intensity focused ultrasound[J].Ultrasound Med Biol,2012,38(11):1911-1917.
[13]ZHU J,ZHU H,MEI Z,et al.High-intensity focused ultrasound ablation for treatment of hepatocellular carcinoma and hypersplenism:preliminary study[J].J Ultrasound Med,2013,32(10):1855-1862.
[14]ZHU J,ZHU H,MEI Z,et al.High-intensity focused ultrasound ablation:an effective and safe treatment for secondary hypersplenism[J].Br J Radiol,2014(87):20140374.
[15]HE X H,GU X H,GU J J,et al.Comparison of total splenic artery embolization and partial splenic embolization for hypersplenism[J].World J Gastroenterol,2012,18(24):3138-3144.
