联合检测CMV-IgM及CMV-DNA对婴幼儿巨细胞病毒肝炎的诊断价值*
2018-05-10谢付静陈大力杨亚培刘洪波
谢付静,陈大力,杨亚培,刘洪波△
(1.山东省聊城市人民医院儿科 252000;2.山东省潍坊市益都中心医院检验科 262500;3.山东省聊城市人民医院中心实验室 252000)
人巨细胞病毒(HCMV)属于双链DNA疱疹病毒,成人大多属于隐性感染,婴幼儿由于免疫系统不完善,常出现明显症状,严重者可出现多脏器损害[1]。大多数巨细胞病毒(CMV)感染的患儿因黄疸持续不退或黄疸持续加重前来就诊[2],可见肝脏是CMV感染的主要靶器官[3-4]。本研究选用对早期诊断价值较大的CMV-IgM及CMV-DNA这两项指标进行筛查,拟探讨单独及联合检测这两项指标对婴幼儿巨细胞病毒肝炎的诊断价值。
1 资料与方法
1.1一般资料 将聊城市人民医院儿科2013年1月至2017年1月确诊的巨细胞病毒肝炎患儿122例作为病例组,其中男71例,女51例,年龄1 d到3岁,无其他影响CMV-IgM及CMV-DNA的并发症。另取同期健康查体儿童186例作为对照组,其中男90例,女96例,年龄1个月至3岁,查体儿童无感染症状。两组之间性别及年龄的差异均无统计学意义(P>0.05)。本研究由聊城市人民医院伦理委员会审核通过且患儿家属知情同意。
1.2仪器与试剂 CMV-IgM采用意大利索灵化学发光仪及配套试剂检测,CMV-DNA采用ABI Prism 7500实时荧光PCR仪检测,试剂由上海之江生物科技公司提供。上述检测均严格按照说明书进行。
1.3方法 清晨空腹抽取两组婴幼儿静脉血3 mL,放入促凝管,混匀后静置半小时,室温3 000 r/min离心10 min进行CMV-IgM及CMV-DNA检测;另外留取两组婴幼儿中段晨尿10 mL进行尿液CMV-DNA检测。CMV-IgM>22 U/mL为阳性,CMV-DNA>1 000 copies/mL为阳性。

2 结 果
2.1两组CMV-IgM、CMV-DNA比较 CMV-IgM与CMV-DNA任意一项指标阳性加上具备肝脏损伤症状判定为肝炎确诊阳性。病例组与对照组比较,CMV-IgM与CMV-DNA阳性率差异有统计学意义(P<0.05),见表1。

表1 病例组与对照组CMV-IgM、CMV-DNA比较[n(%)]
2.2不同年龄分组巨细胞病毒肝炎患儿CMV-IgM、CMV-DNA比较 将患儿组根据年龄分为4组,分别为1 d至6个月(53例),6个月至小于1岁(39例),1~<2岁(18例),2~3岁(12例)。不同年龄分组巨细胞病毒肝炎患儿CMV-IgM、CMV-DNA的总阳性率差异有统计学意义(P<0.05),见表2。
2.3不同症状巨细胞病毒肝炎患儿CMV-IgM、CMV-DNA 本研究122例患儿中黄疸82例、大便色浅36例、肝脾肿大60例、 发热咳嗽37例、先天畸形及发育不良7例。根据上述症状将患儿分组进行CMV-IgM与CMV-DNA的检测,各组总阳性率之间的差异有统计学意义(P<0.05),见表3。

表2 不同年龄组患儿CMV-IgM、CMV-DNA检测[n(%)]

表3 不同症状巨细胞病毒肝炎患儿CMV-IgM、CMV-DNA检测[n(%)]
2.4CMV-IgM、CMV-DNA单独及联合检测的ROC曲线分析 CMV-DNA曲线下面积为0.406,CMV-IgM曲线下面积为0.665,联合检测两项指标的曲线下面积为0.872,见图1、表4。
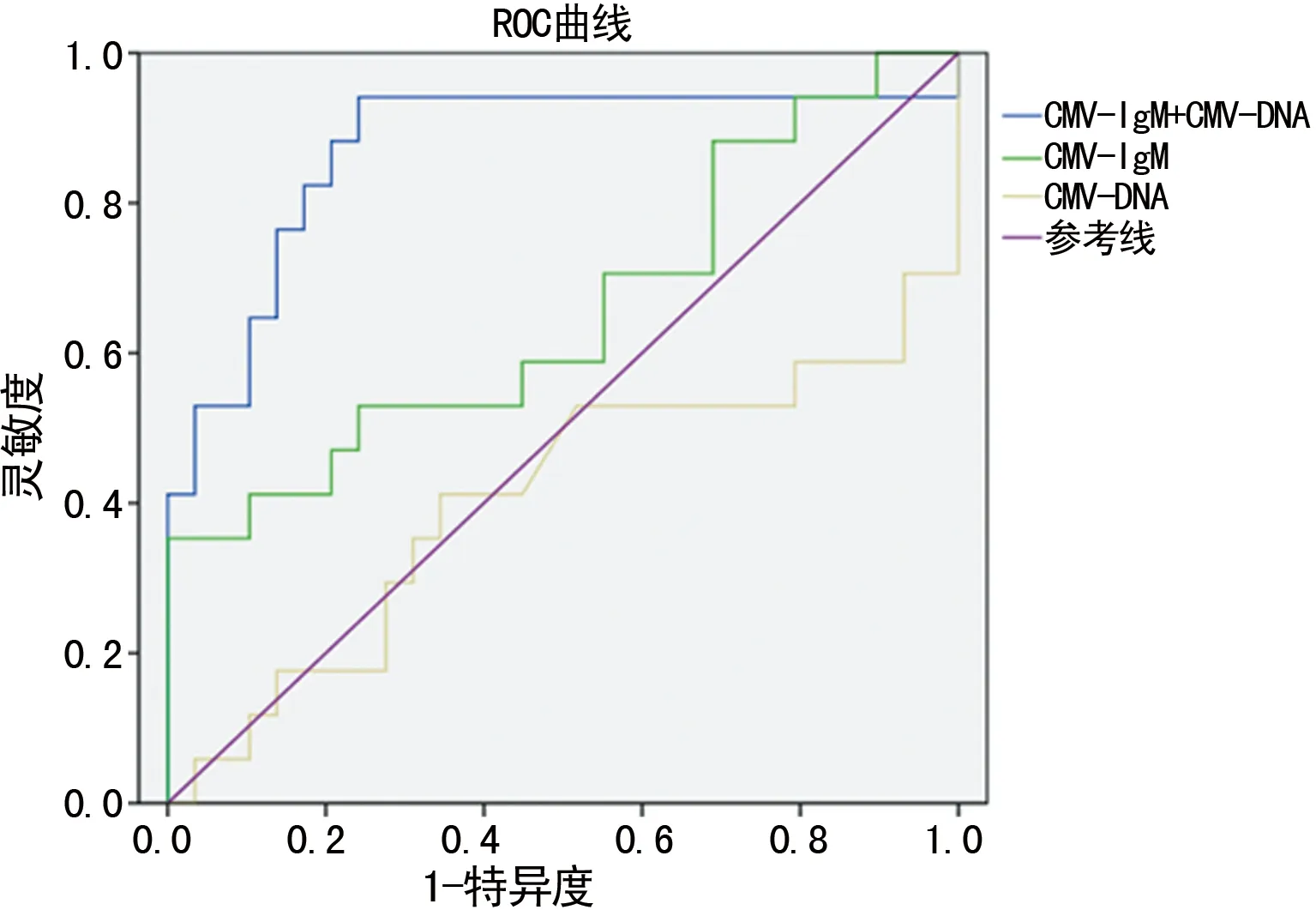
图1 单独及联合检测CMV-IgM与CMV-DNA的ROC曲线
3 讨 论
婴幼儿病毒性肝炎的病原体多种多样,常见的有乙型肝炎病毒、CMV、EB病毒、柯萨奇病毒等,如何明确病原体对诊断及治疗至关重要[5]。婴幼儿CMV感染与传播主要通过胎盘、产道、母乳,根据感染的时间可分为先天性、围生期及获得性感染。肝脏是CMV最常侵犯的靶器官[6],感染人体后可分为4种临床类型:亚临床、无黄疸、黄疸及淤胆型。其中以黄疸型肝炎最为多见[7],临床表现为黄疸持续不退或退而复现,肝脾肿大质地硬,部分伴有陶土样浅色便。有研究[8]表明:CMV也可侵犯其他器官如肺脏、神经系统导致患儿肺炎、先天发育异常等,个别患儿甚至出现多脏器综合征。本研究收集了CMV感染肝炎患儿(临床表现多为黄疸、肝脾肿大、肝功能受损)122 例及健康儿童186例进行CMV-IgM及CMV-DNA检测,结果显示:病例组与对照组CMV-IgM、CMV-DNA的阳性率比较差异均有统计学意义(P<0.01),这种结果说明在病毒感染早期CMV-IgM与CMV-DNA对疾病的鉴别诊断起到了重要作用,对疾病的早期诊断帮助甚大。
CMV感染人体后,由于患儿的年龄及免疫状态不同,首发症状也不尽相同,容易导致误诊和漏诊,国内学者黄玉玲[9]根据患儿的年龄进行了细致的分组,结果显示0~6个月组的感染率最高。邝辉等[10]同样发现1~6个月组的感染率最高,此外该学者根据患儿的症状和体征进行了分组,结果表明以肝功异常、黄疸、肺炎最常见,其他还包括先天畸形、营养不良等。从表2可见1 d至6个月患儿组为CMV-IgM及CMV-DNA阳性率最高的组,同时也是CMV筛查指标联合检测总阳性率最高的组,总阳性率在各组之间的差异有统计学意义(P<0.05),这和以上两位学者的研究相符。由表3可见在以临床特征的分组中,黄疸组为各指标阳性率及总阳性率最高的组,联合检测两项指标的总阳性率在各组之间的差异有统计学意义(P<0.05)。朱艳萍等[11]的研究指出联合检测尿CMV-DNA与血CMV-IgM诊断价值最大。本研究表明联合检测CMV-IgM与CMV-DNA的曲线下面积最大为0.872,灵敏度、特异度、阳性预测值、阴性预测值分别为71.8%、66.7%、82.2%、75.6%,均高于各单项检测,上述数值与各单项检测之间的差异均有统计学意义,这说明联合CMV-IgM与CMV-DNA比单项筛查的意义更大,选用指标的联合检测对肝炎患儿的筛查效率更高。
综上所述,联合检测CMV-IgM与CMV-DNA可以很好地筛选出婴幼儿肝炎中的CMV病毒感染,对于患儿的早期诊断、早期治疗、预防并发症意义重大。本研究采用的化学发光法测定CMV-IgM也比传统的酶联免疫吸附试验(ELISA)法灵敏度、特异度都高[12-13],因患儿均为婴幼儿,并未对3岁以上患儿进行检测,也未对患儿的治疗用药及预后随访进行评估,以上这些工作还有待进一步的探讨完善。
[1]葛存兴,赵晶,王宏志,等.比较婴儿血液和母乳中人巨细胞病毒检测在诊断婴儿感染中的价值[J].中国实用医药,2016,16(2):101-102.
[2]NAING Z,RAYNER B,KILLIKULANGARA A,et al.Prevalence of viruses in stool of premature neonates at a neonatal intensive care unit[J].J Paediatr Child Health,2013,49(3):E221-E226.
[3]浮苗,田可港,郑晓群.人巨细胞病毒潜伏感染相关基因研究进展[J].中国病原生物学杂志,2014,9(12):1134-1138.
[4]白华,李汶静,梁丽俊.婴儿巨细胞病毒肝炎130例临床特点及预后分析[J].宁夏医科大学学报,2015,37(9):1065-1068.
[5]YASUDA K,SUGIURA K,ISHIKAWA R,et al.Perinatal cytomegalovirus-associated bullae in an immunocom-petent infant[J].Arch Dermatol,2012,148(6):770-772.
[6]PEREIRA L,PETITT M,FONG A,et al.Intrauterine growth restriction caused by underlying congenital cytomegalovirus infection[J].J Infect Dis,2014,209(10):1573-1584.
[7]WATERS A,JENNINGS K,FITZPATRICK E,et al.Incidence of congenital cytomegalovirus infection in Ireland:implications for screening and diagnosis[J].J Clin Virol,2014,59(3):156-160.
[8]赵兴艳.小儿巨细胞感染92例临床分析[J].中国社区医师,2015,31(3):66-67.
[9]黄玉玲.不同年龄阶段儿童巨细胞病毒感染临床表现差异探讨[J].临床医学工程,2016,23(6):729-730.
[10]邝辉,周瑾,张媛,等.婴幼儿巨细胞病毒IgM抗体阳性结果分析及临床应用意义[J].国际检验医学杂志,2016,37(13):1840-1841.
[11]朱艳萍,于珍,布月青,等.尿液CMV-DNA联合血清CMV-IgM检测对婴幼儿巨细胞病毒感染的诊断价值[J].中国妇幼保健,2015,30(18):2960-2962.
[12]袁浩,唐曾,周毅峰.巨细胞病毒的3种检测方法在诊断小儿巨细胞病毒感染中的评价[J].现代预防医学,2014,41(14):2607-2610.
[13]吴晓波,吕贞燕,何勇.更昔洛韦联合丙种免疫球蛋白治疗婴儿巨细胞病毒感染的系统评价[J].临床药物治疗杂志,2016,14(2):31-36.
