TGF-β1促进人胃癌MKN28细胞上皮-间质转化和转移的研究
2018-05-10马国娟胡晓杰尹香云彭彦辉
孙 云,马国娟,胡晓杰,尹香云,彭彦辉
(河北省人民医院:1.普外四科;2.门诊部;3.普外三科,石家庄 050051)
研究表明,上皮-间质转化(epithelia to mesenchymaltransition,EMT)在肿瘤侵袭转移中发挥重要作用,它是指上皮细胞在形态学上向间质细胞转变,在此过程中细胞浸润和迁移能力明显增强[1-2]。转化生长因子-β1(the transforming growth factor-β1,TGF-β1)是EMT的重要诱导因子,在细胞增殖、分化、凋亡中发挥重要作用。研究显示,进展期胃癌患者TGF-β1表达升高,通过促进细胞EMT进程,增强肿瘤细胞的侵袭迁移能力[3]。但是,胃癌中TGF-β1调控EMT的分子机制尚不清楚。LMO1是由2个LIM结构域组成的辅助转录因子,其LIM结构域可作为蛋白质相互作用的适配器,通过与其他蛋白相互作用形成复合体,调控基因转录活性,参与细胞分化、增殖等生物学过程[4]。研究显示,LMO1在T淋巴细胞白血病、神经母细胞瘤、乳腺癌患者中表达升高,且与患者预后密切相关,提示LMO1在肿瘤发生、发展中发挥重要作用[5]。有研究显示LMO家族其他成员LMO2、LMO4参与了EMT的调控[6]。然而,LMO1是否参与TGF-β1介导的EMT进程目前尚未见报道。本研究通过Real time-PCR和Western blot等技术探讨LMO1在TGF-β1诱导的胃癌MKN28细胞EMT及转移中的作用,为阐明胃癌发病机制及治疗提供理论依据。
1 材料与方法
1.1细胞株与试剂 人胃癌MKN28细胞购自军事医学科学院;兔抗人E-cadherin、N-cadherin、LMO1、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)、血管内皮生长因子(vascular endoth elial growth factor,VEGF)多克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶标记的羊抗鼠IgG抗体、BCA蛋白浓度检测试剂盒购自北京中杉金桥有限公司;胎牛血清、PRMI 1640培养基、Lipofectamine 2000、TGF-β1、Trizol、实时荧光定量试剂盒购自美国Invitrogen公司;LMO1 siRNA及阴性对照siRNA 由上海吉玛基因化学技术有限公司合成;Transwell小室、Matrigel 基质胶购自美国BD公司。
1.2方法
1.2.1细胞培养 在37 ℃、5% CO2条件下,用含10%胎牛血清、1%青霉素和链霉素的RPMI 1640培养基常规培养细胞,2 d换液1次。将处于对数生长期的细胞接种于6孔板中,细胞分4组:对照组(5% BSA)、TGF-β1诱导组(10 μg/L)、阴性转染组(TGF-β1+阴性转染siRNA)、LMO1-siRNA转染组(TGF-β1+LMO1-siRNA)。每组设3个复孔,重复3次。
1.2.2细胞转染 根据Gene Bank中人LMO1基因序列设计特异性siRNA。LMO1-siRNA序列为:正义:5′-GGG CCC GAG ACA ATG TGT AT-3′,反义:5′-AGA CGG ACA GAT GGA CCT GG-3′;同时合成一条荧光素标记的阴性对照siRNA。收集处于对数生长期的MKN28细胞接种于6孔板中,调整细胞密度为2×105个/孔,利用脂质体Lipofectamine 2000转染。转染24 h后在荧光显微镜下观察转染效率,转染48 h后收集细胞用于实验。
1.2.3Real time-PCR检测目的基因mRNA的表达 根据Gene Bank中人LMO1 mRNA序列,采用DNAMAN软件设计引物,引物序列见表1,由上海生工生物工程技术服务有限公司合成。Trizol提取细胞总RNA,用紫外分光光度计测定RNA的纯度和浓度。在ABI 7300型荧光定量PCR仪上进行反转录和扩增试验。反应结束后采用仪器自带的SDS v1.3软件分析得出各样本、各基因扩增的Ct值。设对照组样品为标准1,目的基因表达水平的相对定量值RQ=2-ΔΔCt,将RQ值用于统计分析,以GAPDH为内参照基因。

表1 LMO1、E-cadherin、N-cadherin、GAPDH引物序列
1.2.4Western blot检测目的基因蛋白质 细胞加入裂解液100 μL,冰上静置30 min,4 ℃ 12 000 r/min离心30 min,用BCA法进行蛋白定量。将50 μg总蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至聚偏氟乙烯(PVDF)膜上,用10%脱脂奶粉封闭2 h,加入特异性E-cadherin、N-cadherin、LMO1、MMP-9、VEGF抗体,4 ℃孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的羊抗鼠IgG,室温孵育1 h,TBST清洗,ECL化学发光法显色、定影。用UVP软件检测并分析蛋白条带IOD值,以GAPDH作为内参照,以目的蛋白吸光度值/内参照吸光度值的比值进行定量分析。
1.2.5Transwell小室检测细胞侵袭力 将Matrigel胶用PRMI 1640培养基稀释后均匀涂于8 μm小孔聚碳酸酯滤膜的Transwell小室上室。收集转染组和对照组MKN28细胞,用不含血清的PRMI 1640培养基重悬细胞,制备单细胞悬液(2×105个/mL),取200 μL单细胞悬液接种于Transwell小室的上室,下室加入含10%胎牛血清(FBS)的PRMI 1640培养基800 μL。培养24 h后取出Transuell小室,用棉签擦拭掉小室底部未转移的细胞,用4%多聚甲醛固定15 min,0.1%结晶紫染色15 min。在倒置显微镜下随机选取10个视野(×200)计算穿膜细胞数,求均值。
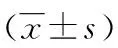
表2 TGF-β1诱导对胃癌MKN28细胞E-cadherin、N-cadherin、LMO1表达的影响
*:P<0.01,与对照组比较;▲:P<0.01,与TGF-β1诱导组、阴性转染组比较
1.2.6Transwell小室检测细胞迁移能力 Transwell小室不涂抹Matrigel胶,其余步骤同1.2.5。

2 结 果
2.1TGF-β1诱导对胃癌MKN28细胞形态学的影响 对照组细胞仍表现为上皮细胞形态,细胞呈鹅卵石样,且细胞间连接紧密。TGF-β1诱导组和阴性转染组细胞由紧密连接的多角形变为长梭形或纺锤体形,细胞多分散,呈典型的EMT形态改变。LMO1-siRNA转染组部分细胞恢复成梭形,细胞间连接略疏松,即LMO1-siRNA特异性下调LMO1能够明显减弱TGF-β1诱导MKN28细胞引起的EMT形态改变。
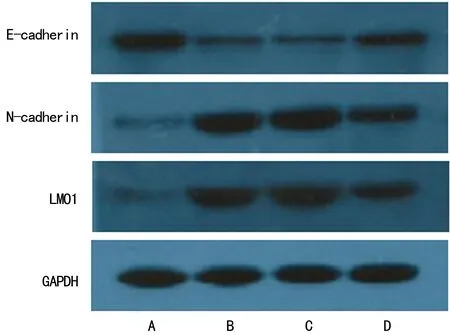
A:对照组;B:TGF-β1诱导组;C:阴性转染组;D:LMO1-siRNA转染组
图1 Western blot检测各组E-cadherin、N-cadherin、LMO1表达情况
2.2TGF-β1诱导对胃癌MKN28细胞EMT相关标志物及LMO1表达的影响 Real time-PCR和Western blot结果显示,与对照组比较,TGF-β1诱导组和阴性转染组E-cadherin表达显著下降,N-cadherin、LMO1表达显著上升(P<0.01),TGF-β1诱导组和阴性转染组比较差异无统计学意义(P>0.05);LMO1-siRNA转染组E-cadherin表达较TGF-β1诱导组和阴性转染组显著回升,N-cadherin、LMO1表达较TGF-β1诱导组和阴性转染组显著降低(P<0.01),但和对照组比较差异仍有统计学意义(P<0.01),见表2,图1。
2.3TGF-β1诱导对各组胃癌MKN28细胞侵袭能力的影响 Transwell小室侵袭实验结果显示,TGF-β1诱导组、阴性转染组穿膜细胞数分别为(312±22)个和(318±26)个,较对照组[(116±18)个]显著增加(P<0.01),TGF-β1诱导组和阴性转染组比较差异无统计学意义(P>0.05);与TGF-β1诱导组、阴性转染组比较,LMO1-siRNA转染组穿膜细胞数[(197±20)个]显著降低(P<0.01),但与对照组比较差异仍有统计学意义(P<0.01),见图2。

A:对照组;B:TGF-β1诱导组;C:阴性转染组;D:LMO1-siRNA转染组
图2 TGF-β1诱导对各组胃癌MKN28细胞侵袭能力的影响
2.4TGF-β1诱导对各组胃癌MKN28细胞迁移能力的影响 Transwell小室迁移实验结果显示,TGF-β1诱导组、阴性转染组穿膜细胞数分别为(458±28)个和(470±26)个,较对照组[(231±22)个]显著增加(P<0.01),TGF-β1诱导组和阴性转染组比较差异无统计学意义(P>0.05);与TGF-β1诱导组、阴性转染组比较,LMO1-siRNA转染组穿膜细胞数[(301±27)个]显著降低(P<0.01),但与对照组比较差异仍有统计学意义(P<0.01),见图3。
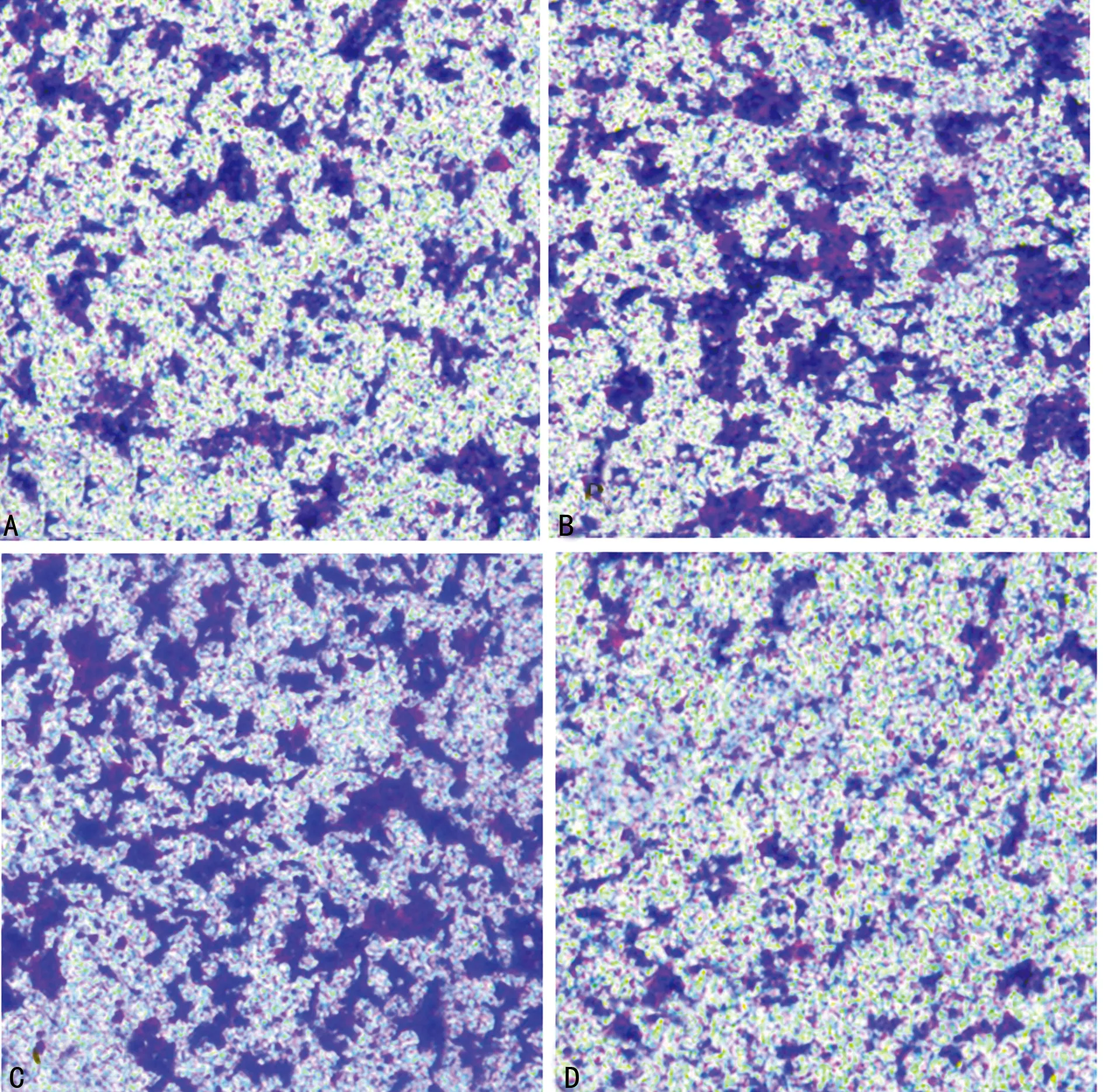
A:对照组;B:TGF-β1诱导组;C:阴性转染组;D:LMO1-siRNA转染组
图3 TGF-β1诱导对各组胃癌MKN28细胞迁移能力的影响
2.5TGF-β1诱导对胃癌MKN28细胞侵袭转移相关基因表达的影响 Western blot结果显示,与对照组比较,TGF-β1诱导组和阴性转染组MMP-9、VEGF表达显著上升(P<0.01),TGF-β1诱导组和阴性转染组比较差异无统计学意义(P>0.05);LMO1-siRNA转染组MMP-9、VEGF表达较TGF-β1诱导组和阴性转染组显著下降(P<0.01),但和对照组比较差异仍有统计学意义(P<0.01),见表3、图4。
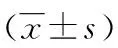
表3 TGF-β1诱导对胃癌MKN28细胞MMP-9、VEGF表达的影响
*:P<0.01,与对照组比较;▲:P<0.01,与TGF-β1诱导组、阴性转染组比较

A:对照组;B:TGF-β1诱导组;C:阴性转染组;D:LMO1-siRNA转染组
图4 Western blot检测各组MMP-9、VEGF表达情况
3 讨 论
胃癌是来源于胃黏膜上皮的消化道恶性肿瘤,其发病率和死亡率极高,居恶性肿瘤的第2位[7]。侵袭和转移是恶性肿瘤的重要特征,也是导致治疗失败的主要原因,据统计每年约有60%的胃癌患者死于复发和转移[8]。因此,寻找与胃癌侵袭和转移相关的靶向分子,对于深入探讨胃癌发生、发展的分子机制并探索积极有效的治疗措施、改善患者预后具有重要意义。
TGF-β1是TGF家族的重要成员,具有多种生物学功能,已有研究发现TGF-β1在诱导肿瘤细胞EMT进程中发挥关键作用[9-10]。TGF-β1可通过Smad依赖性和非Smad依赖性途径介导肿瘤细胞EMT进程。LMO1是LMO家族成员,主要通过调控基因转录活性参与细胞分化、增殖等生物学过程[4]。研究显示,LMO1与T淋巴细胞白血病、神经母细胞瘤、乳腺癌等恶性肿瘤发生、发展密切相关。患者LMO1表达升高,且与患者预后密切相关,提示LMO1在肿瘤发生、发展中发挥重要作用[5]。
本研究结果显示,TGF-β1诱导人胃癌MKN28细胞后出现典型的EMT形态学变化,细胞由紧密连接的多角形变为长梭形或纺锤体形,细胞多分散。Real time-PCR和Western blot结果显示,TGF-β1诱导后MKN28细胞EMT标志物E-cadherin表达显著下调,N-cadherin表达显著上调,说明TGF-β1是EMT的有效诱导因子,与HELDIN等[11]的报道一致。同时在TGF-β1诱导MKN28细胞出现的EMT进程中,LMO1表达显著上调。SAEKI等[12]研究显示,TGF-β1通过上调LMO1表达进而促进胃黏膜上皮细胞的凋亡进程,与本研究结果一致。本研究采用Tanswell小室实验及Western blot检测TGF-β1诱导后MKN28细胞侵袭迁移能力及转移相关蛋白(MMP-9、VEGF)表达的变化。结果显示,TGF-β1诱导后MKN28细胞侵袭迁移能力明显增强,MMP-9、VEGF蛋白表达明显上调,说明TGF-β1诱导后MKN28细胞经历了EMT进程。为进一步阐明LMO1在TGF-β1调控MKN28细胞发生EMT转移的作用,笔者采用RNA干扰技术下调LMO1表达,结果显示,下调LMO1表达能够明显逆转TGF-β1诱导的MKN28细胞出现EMT形态学变化,同时E-cadherin表达显著回升,N-cadherin、MMP-9、VEGF表达显著下降。以上结果充分证实LMO1在TGF-β1介导的信号转导通路中可能发挥重要作用。
本研究结果显示,TGF-β1可能通过某种信号通路上调其靶基因LMO1表达,从而明显增强胃癌MKN28细胞的侵袭转移能力,这可能是TGF-β1诱导MKN28细胞发生EMT和转移的可能机制。本研究为深入探讨胃癌发生、发展的分子机制及寻找治疗胃癌的分子靶点提供了新思路。然而,TGF-β1调控LMO1表达的具体分子机制尚待后续研究。
[1]BEZDENEZHNYKH N,SEMESIUK N,LYKHOVA O,et al.Impact of stromal cell components of tumor microenvironment on epithelial-mesenchymal transition in breast cancer cells[J].Exp Oncol,2014,36(2):72-78.
[2]TALBOT L J,BHATTACHARYA S D,KUO P C.Epithelial-mesenchymal transition,the tumor microenvironment,and metastatic behavior of epithelial malignancies[J].Int J Biochem Mol Biol,2012,3(2):117-136.
[3]LI J,WANG J,ZOU Y,et al.The influence of delayed compressive stress on TGF-β1-induced chondrogenic differentiation of rat BMSCs through Smad-dependent and Smad-independent pathways[J].Biomaterials,2012,33(33):8395-8405.
[4]顾卉,佟宇鑫,刘彤,等.GST-LMO1融合蛋白表达载体的构建及其在原核细胞中的表达[J].中国医科大学学报,2011,40(11):961-963,978.
[5]VANNELLA L,LAHNER E,OSBORD J,et al.Risk factors for progression to gastric neoplastic lesions in patients with atrophic gastritis[J].Aliment Pharmacol Ther,2010,31(9):1042-1050.
[6]李静怡,申秀锦,邓红.LMO4调节肿瘤发生过程中的上皮-间质转化[J].浙江大学学报(医学版),2011,40(1):107-111.
[7]LUYIMBAZI D,NELSON R A,CHOI A H,et al.Estimates of conditional survival in gastric cancer reveal a reduction of racial disparities with long-term follow-up[J].J Gastrointest Surg,2015,19(2):251-257.
[8]吴菲,林国桢,张晋昕.我国恶性肿瘤发病现状及趋势[J].中国肿瘤,2012,21(2):81-85.
[9]MORRISON C D,PARVANI J G,SCHIEMANN W P.The relevance of the TGF-β Paradox to EMT-MET programs[J].Cancer Lett,2013,341(1):30-40.
[10]KATSUNO Y,LAMOUILLE S,DERYNCK R.TGF-β signaling and epithelial-mesenchymal transition in cancer progression[J].Curr Opin Oncol,2013,25(1):76-84.
[11]HELDIN C,VANLANDEWIJCK M,MOUSTAKAS A.regulation of EMT by TGF-β in cancer[J].FEBS Lett,2012,586(14):1959-1970.
[12]SAEKI N,KIM D H,USUI T,et al.GASDERMIN,suppressed frequently in gastric cancer,is a target of LMO1 in TGF-beta-dependent apoptotic signalling[J].Oncogene,2007,26(45):6488-6498.
