PEG预处理对水分胁迫下水稻根系抗氧化酶同工酶及其表达的影响
2018-05-11李雪妹李雪梅
李雪妹, 刘 畅, 单 羽, 李雪梅
(沈阳师范大学生命科学学院,辽宁沈阳 110034)
植物生长于自然界会受到诸多因素的影响。在非生物胁迫中水分胁迫对植物产生的影响不容小觑,近年来随着全球气候的不断变化,干旱胁迫已成为水稻生长过程最易遭受的逆境因子之一[1]。干旱引起植物体内代谢的变化,严重影响了农作物的生长和产量。
正常情况下,植物体内活性氧(ROS)产生与清除处于平衡状态。但是当植物受到逆境胁迫时,其体内会产生大量的氧自由基,于是体内清除过剩自由基的抗氧化保护系统会启动[2]。抗氧化酶同工酶的合成和活性始终受到遗传基因的控制和调节,不良环境常引起基因变异而使酶结构及其活性改变,进而导致同工酶酶谱变化[3]。李国龙的研究表明通常耐旱作物在干旱条件下能使保护酶活力维持在一个较高水平[4]。曾秀存等在对白菜型冬油菜的研究中指出Cu/Zn-SOD基因是低温诱导条件下差异表达的基因,其表达可减轻或抵抗低温条件下产生的活性氧对根部伤害[5]。李敬蕊等发现低氧胁迫下,甜瓜幼苗根系的SOD、POD1、POD2、CAT、APX基因表达水平上调,根系和叶片的SOD、POD、CAT、APX的活性、同工酶表达增强[6]。Li等也提出较低水平的ROS可以诱导抗氧化酶基因表达上调[7]。本试验采用10% PEG预处理和15% PEG直接处理水稻,检测抗氧化酶活性以及抗氧化酶相关基因的表达水平并分析其变化,探讨水分预处理是否能通过对抗氧化酶及其基因表达的调节来提高水稻的抗旱性,从而进一步探究水稻的抗旱机制。
1 材料与方法
1.1 材料培养
试验于2015年在沈阳师范大学实验中心进行,将水稻种子(辽星1号)28 ℃浸种48 h,30 ℃催芽24 h。将催芽后的种子播种于装有改良Hoagland完全营养液的塑料烧杯中,放置在光照强度为300 μmol/(m2·s),相对湿度为80%,28 ℃光照12 h、22 ℃黑暗12 h为一周期的光照培养箱中培养。
1.2 试验处理
幼苗长至2 cm左右时进行如下处理:(1)对照1,水稻始终用完全营养液培养;(2)预处理复水组,10% PEG预处理 3 d(阶段一),进行复水处理3 d(阶段二),15% PEG胁迫处理3 d(阶段三);(3)对照2,阶段一、阶段二均为完全营养液培养,阶段三为15% PEG胁迫处理;(4)预处理组,阶段一为完全营养液培养,阶段二为10% PEG预处理,阶段三为15% PEG胁迫处理。分别在处理阶段一的0、6、12、24、48、72 h取对照1、预处理复水组的叶片以及处理阶段三的24、48、72 h取4种处理的叶片进行抗氧化酶同工酶的检测。在处理阶段三的72 h分析所有处理叶片抗氧化酶的基因表达。
1.3 检测方法
1.3.1 同工酶检测 将新鲜的根取1 g加入预冷pH值为 7.8 的50 mmol/L磷酸缓冲液(含0.1 mmol/L EDTA,10 g/L PVP),研磨成匀浆,15 000 r/min、4 ℃离心15 min,上清液即为酶液。抗氧化酶同工酶分析采用垂直板聚丙烯酰胺凝胶电泳PAGE)法,参照胡能书等的方法[8]制备凝胶,对SOD、POD、CAT同工酶进行分离、染色以及准备电泳条件。
1.3.2 SOD、APX1、CAT1的mRNA表达分析 参照孙德权等的方法[9]进行RNA提取,SOD、APX1、CAT1的mRNA表达采用RT-PCR检测。表1为PCR扩增引物。

表1PCR扩增上游和下游引物核酸序列
2 结果与分析
2.1 PEG预处理对水分胁迫下抗氧化酶同工酶的影响
2.1.1 对水稻根系SOD同工酶的影响 水稻在10%PEG(阶段一)预处理下SOD同工酶酶谱变化(图1-A),10%PEG预处理组与对照1相比酶Ⅱ的酶带变窄,颜色变浅。伴随着水稻幼苗的生长,酶Ⅱ、Ⅲ谱带在预处理组和对照1中均表现为增强的趋势。在水稻整个胁迫过程中(阶段三)SOD同工酶活性呈现出先增大后减小的趋势,在胁迫24 h时,酶活性增大最为明显(图1-B)。经过预处理的水稻根系的SOD同工酶活性与对照1同工酶活性没有明显变化,而未经过预处理的水稻中的SOD同工酶活性有明显的增大迹象。由此推断,PEG预处理可以提高水稻对水分胁迫的抗性。

2.1.2 对水稻根系POD同工酶的影响 水稻在10% PEG(阶段一)预处理下POD同工酶活性主要表现出上升的趋势(图2-A)。对照1与预处理组相比较,酶Ⅲ和酶Ⅳ的酶带变宽,颜色加深,说明10% PEG预处理在一定程度上抑制了这2种酶的活性。当水稻在15% PEG(阶段三)胁迫时,POD同工酶变化趋势见图2-B。此阶段水分胁迫相较阶段一更加明显,此阶段中酶Ⅰ、Ⅱ、Ⅲ的酶带较宽,颜色较深,而酶Ⅳ、Ⅴ的酶带宽度在预处理组中随着胁迫时间的增加呈现出先变窄后变宽的趋势。在胁迫72 h后对照2出现酶Ⅳ、Ⅴ,而对照1在胁迫过程中一直未出现酶Ⅳ、Ⅴ,相反预处理组一直有这2种酶。由此推断酶 Ⅳ、Ⅴ是预处理后新诱导出与水稻水分胁迫相关的酶。
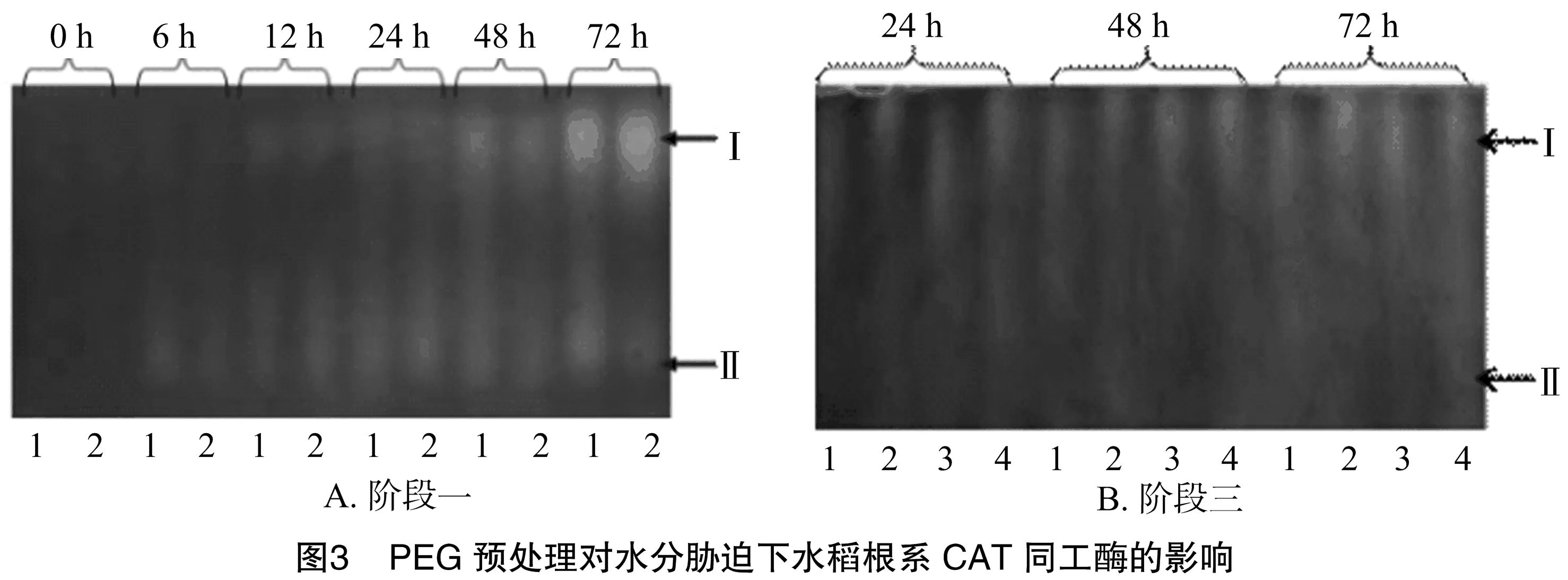
2.1.3 对水稻根系CAT同工酶的影响 水稻在10% PEG(阶段一)预处理下CAT总活性较小(图3-A)。在预处理后的12 h和6 h,酶Ⅰ、酶Ⅱ才出现,且酶Ⅰ的谱带在整个胁迫过程逐渐变宽,说明10% PEG在一定程度上抑制了CAT同工酶的表达。当水稻在15% PEG(阶段三)胁迫时,CAT同工酶活性整体上表现出先上升后下降然后再上升的趋势(图3-B)。预处理组的CAT同工酶酶带颜色较深,而预处理复水组与对照1的酶带没有明显的差异。由此推断,PEG预处理提高了水稻CAT同工酶对再次胁迫的应答能力,使其再次遭受更强的胁迫时能够快速应答,减少水分胁迫给植物体带来的伤害。
2.2 PEG预处理对水分胁迫下抗氧化酶基因表达的影响
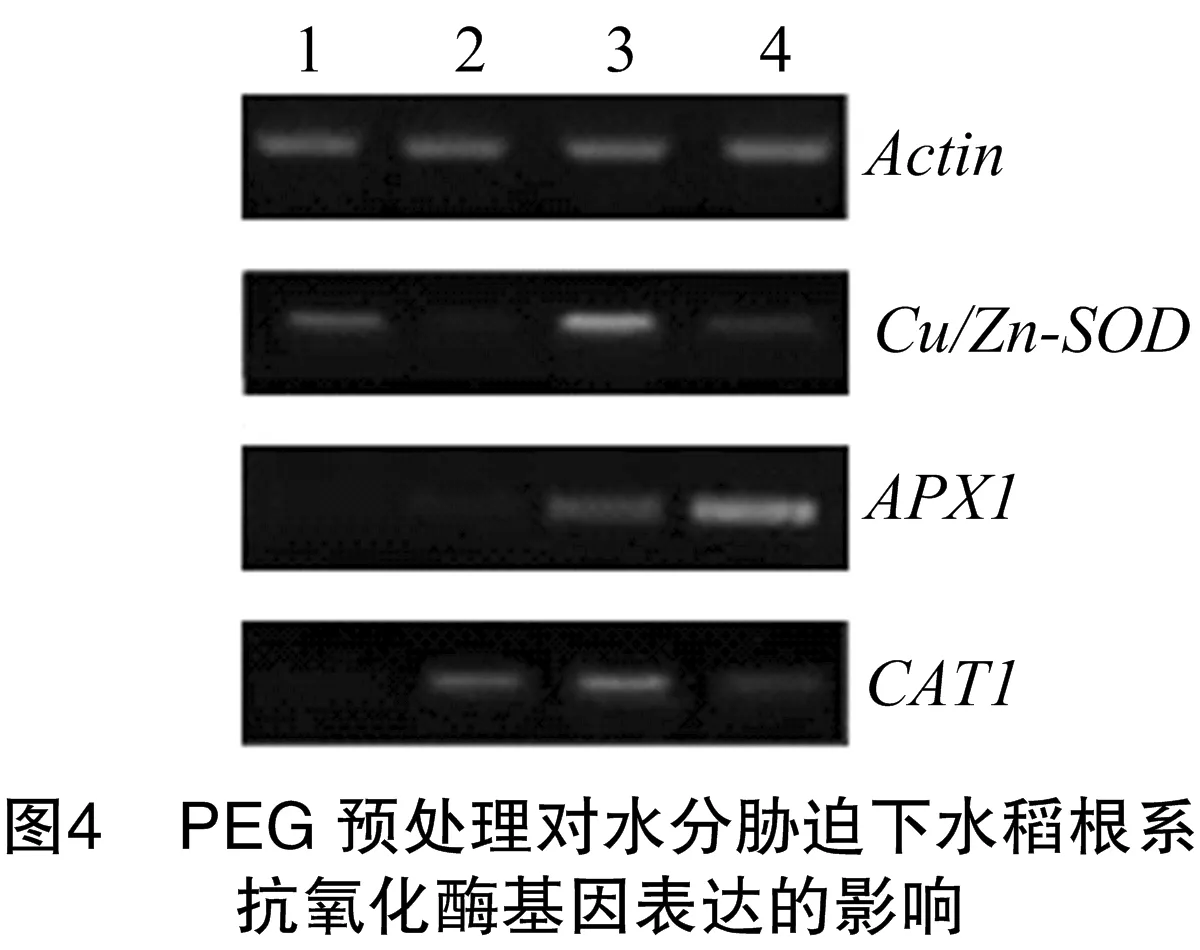
在不同的处理下SOD抗氧化酶基因表达水平不同,预处理复水组的Cu/Zn-SOD表达水平明显低于其他各组,相反直接遭受更强水分胁迫的对照2基因的表达水平远远高于其他各组,而预处理组基因表达水平居于二者之间(图4)。APX1基因的表达水平在不同处理下也不相同,预处理复水组与对照1的表达水平相似并且低于对照2,而预处理组的基因表达却远远高于其他各组。对于CAT1基因而言,对照2的基因表达水平高于其他各组,预处理组的表达水平低于预处理复水组但高于对照1。整体来看,未经过预处理的对照2中的抗氧化酶Cu/Zn-SOD、APX1和CAT1基因的表达水平要高于经过预处理的各组,说明预处理可以提高水稻根系的抗性,当其遭受更强的水分胁迫时抗氧化酶基因依旧可以以较低的表达水平应对。但预处理组Cu/Zn-SOD和APX1的表达水平仍然高于预处理复水组,以此推断出复水阶段可以使抗氧化酶基因系统有一个很好的恢复,使其能应对更强的水分胁迫。水分预处理可以很好地提高水稻根系抵抗水分胁迫的能力,使水稻幼苗更耐旱。
3 讨论
3.1 预处理对水分胁迫下抗氧化酶同工酶的影响
SOD、POD、CAT都是植物重要的保护酶,与品种的抗旱性密切相关,在植物抗旱过程中发挥着极大的作用,是衡量作物抗旱性强弱的重要生理指标[10-11]。夏民旋等在超氧化物歧化酶与植物抗逆性的试验中提到SOD参与植物应答水分胁迫,并在其中起到重要的作用[12]。在本试验中SOD的活性呈现出短时间胁迫升高,长时间胁迫或遭受到更强的水分胁迫时降低的趋势。这与李晓青等提到的在不同浓度的水分胁迫下抗氧化酶同工酶的活性呈现出先升高后降低的趋势相似[13]。有研究结果表明,不同植物的SOD、POD、CAT活性对干旱的响应有所差别,不同干旱程度对SOD、POD、CAT活性的影响也不相同[14]。在左应梅等对干旱胁迫下 4种人参属植物抗性生理指标的研究中显示,POD在4种人参属的植物中的变化趋势和变化幅度都不同[15]。本研究中POD活性在预处理组中呈现出上升的趋势,但是在遭受到更强的水分胁迫时其活性表现为先下降后上升的走向,并且还伴有新的酶带Ⅴ产生,这一系列变化都说明水稻幼苗的根系在适应水分胁迫。此外,10% PEG预处理阶段在处理后的12 h和 6 h 出现了CAT同工酶新酶带酶Ⅰ与酶Ⅱ,这说明在预处理阶段有新的酶带产生,并且经过预处理的水稻幼苗根系中CAT的活性要高于未经处理的对照,此结论与石鹏的研究结果[16]相似。
3.2 预处理对水分胁迫下抗氧化酶基因表达的影响
有研究表示抗氧化酶活性与其基因的表达量具有显著的相关性[17]。张秀海等提出植物抗旱性的提高是通过干旱改变基因表达而引发的,这是一个长期进化的结果[18]。在不同的器官中,基因的积累表达量存在明显的差异[19]。不同的抗氧化酶基因在干旱及复水过程中呈现出不同的表达图谱,并且相同的酶在不同品种中基因表达水平也不相同[20]。李耀文提到小麦中CAT1和CAT2的表达量随着干旱条件的变化而发生改变,尤其在严重干旱时表达量显著增强[21]。在本试验中干旱胁迫明显增加了SOD、APX和CAT的表达水平,未经预处理的对照2谱带颜色明显比预处理组深,说明经过预处理的各组抗氧化酶Cu/Zn-SOD、APX1和CAT1基因的表达水平低于未经预处理的对照,这与张玉秀等提到的镉能在转录水平和转录后水平上调控抗氧化物同工酶基因的表达,提高其酶活性水平的研究结果[22]相似。黄静等通过对麻疯树的研究发现对照组和干旱胁迫组的与渗透感受器相关的基因表达存在着明显差异,说明干旱可以诱导麻疯树的某些基因表达[23]。在试验中预处理组抗氧化酶基因Cu/Zn-SOD和APX1的表达水平要高于预处理复水组,这就表示预处理后的复水能很好地使植物自身得到一个调节,使抗氧化酶基因的表达水平维持在一个正常的水平,使植物可以更好地适应更强的水分胁迫。由此可见,适当的水分胁迫可以通过提高抗氧化酶基因的表达水平来应对外界环境给予植物的水分胁迫[24-25],使植物可以更迅速地适应外界环境。
参考文献:
[1]侯鹏飞,马俊青,赵鹏飞,等. 外源甜菜碱对干旱胁迫下小麦幼苗叶绿体抗氧化酶及psbA基因表达的调节[J]. 作物学报,2013,39(7):1319-1324.
[2]陆晓民,高青海. 油菜素内酯对硝酸钙胁迫下黄瓜幼苗生长及其抗氧化酶同工酶表达的影响[J]. 热带作物学报,2011,32(11):2104-2108.
[3]Yuan L,Ali K,Zhang L Q. Effects of NaCl stress on active oxygen metabolism and membrane stability inPistaciaveraseedlings[J]. Acta Phytoecological Sinica,2005,29(6):985-991.
[4]李国龙. 甜菜苗期对干旱适应的生理生化及分子机制研究[D]. 呼和浩特:内蒙古农业大学,2011.
[5]曾秀存,刘自刚,史鹏辉,等. 白菜型冬油菜铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆及其在低温条件下的表达[J]. 作物学报,2014,40(4):636-643.
[6]李敬蕊,杨丽文,王春燕,等.γ-氨基丁酸对低氧胁迫下甜瓜幼苗抗氧化酶活性及表达的影响[J]. 东北农业大学学报,2014,45(11):28-36.
[7]Li L,Yi H. Effect of sulfur dioxide on ROS production,gene expression and antioxidant enzyme activity inArabidopsisplants[J]. Plant Physiology and Biochemistry,2012,58(3):46-53.
[8]胡能书,万国贤. 同工酶技术及其应用[M]. 长沙:湖南科学技术出版社,1985.
[9]孙德权,郭启高,胡玉林,等. 改良Trizol法提取香蕉叶片总RNA[J]. 广东农业科学,2009(5):162-164.
[10]Lascano H R,Melchiorre M N,Luna C M,et al. Effect of photooxidative stress induced by paraquat in two wheat cultivars with differential tolerance to water stress[J]. Plant Science,2003,164(5):841-848.
[11]周 磊,李 松,郭传龙,等. 聚乙二醇模拟干旱胁迫处理条件下2种大豆抗旱机制比较[J]. 扬州大学学报(农业与生命科学版),2013,34(3):54-60.
[12]夏民旋,王 维,袁 瑞,等. 超氧化物歧化酶与植物抗逆性[J]. 分子植物育种,2015,13(11):2633-2646.
[13]李晓青,荆月婷,冯全福,等. PEG模拟干旱胁迫对不同烤烟品种审理特性的影响[J]. 中国烟草科学,2016,37(3):15-21.
[14]田又升,王志军,于 航,等. 干旱胁迫对不同抗旱性棉花品种抗氧化酶活性及基因表达的影响[J]. 西北植物学报,2015,35(12):2483-2490.
[15]左应梅,杨维泽,杨天梅,等. 干旱胁迫下4种人参属植物抗性生理指标的比较[J]. 作物杂志,2016(3):84-88.
[16]石 鹏. 干旱预处理诱导白三叶抗旱性的生理机制与抗氧化酶基因差异表达[D]. 成都:四川农业大学,2012.
[17]陈 斌,王亚男,马丹炜,等. 土荆芥化感胁迫对玉米幼根抗氧化酶活性和基因表达的影响[J]. 生态环境学报,2015,24(10):1640-1646.
[18]张秀海,黄丛林,沈元月,等. 植物抗旱基因工程研究进展[J]. 生物技术通报,2001(4):21-25.
[19]何巧丽,张 喆,冉春燕,等. 干旱胁迫下甘蓝型油菜相关抗旱基因的表达分析[J]. 华东师范大学学报(自然科学版),2016(1):113-122.
[20]季 杨. 鸭茅对干旱胁迫的生理响应及分子机制研究[D]. 成都:四川农业大学,2013.
[21]李耀文. 水稻过氧化氢酶基因(CAT)同工酶在逆境胁迫下的比较分析[D]. 哈尔滨,东北林业大学,2009.
[22]张玉秀,金 玲,冯珊珊,等. 镉对镉超累积植物龙葵抗氧化酶活性及基因表达的影响[J]. 中国科学院研究生院学报,2013,30(1):11-17.
[23]黄 静,戴 晓,彭书明,等. 干旱对麻疯树部分生理生化指标及基因表达的影响[J]. 四川大学学报(自然科学版),2009,46(1):223-227.
[24]王 丹,张亚玲,徐春莹,等. 干旱胁迫对不同水稻品种抗逆性和抗瘟性相关酶的影响[J]. 江苏农业科学,2017,45(4):49-51.
[25]范春丽,罗 青. 干旱胁迫下外源甜菜碱对石榴光合作用、渗透调节及保护酶活性的影响[J]. 江苏农业科学,2016,44(11):229-232.
